开普拓 ®(盐酸伊立替康注射液)适用于晚期结直肠癌患者的治疗 1:
- 与5-氟尿嘧啶(5-FU)和亚叶酸联合治疗既往未接受化疗的晚期结直肠癌患者 1;
- 作为单一用药,治疗经含5-FU化疗方案治疗失败的患者 1。
推荐预防性给予患者止吐药。当患者出现胆碱能综合症时要考虑预防性或治疗性地给予阿托品治疗 1。
▍联合用药 1: 剂量方案
盐酸伊立替康与5-FU和LV(亚叶酸钙)联用
两周用药方案:
- 盐酸伊立替康180mg/m 2 静脉滴注30-90分钟,第1天;LV 400mg/m 2 应该在盐酸伊立替康输注后立即给予,滴注时间相同,之后再立即给予5-FU,第1天和第2天; 5-FU 400mg/m 2 静脉推注,然后600mg/m 2 持续静脉输注22小时,第1天和第2天。每2周重复 1。
- 盐酸伊立替康180mg/m 2静脉滴注30-90分钟,第1天;LV 400mg/m 2应该在盐酸伊立替康输注后立即给予,滴注时间相同,第1天; 5-FU 400mg/m 2静脉推注,第1天,然后1200mg/m 2/d×2天持续静脉输注(总量2400mg/m 2, 输注46-48小时)。每2周重复 1。
▍单药治疗 1: 剂量方案
- 本品应该静脉给药,滴注时间大于90分钟,每周或每3周一次给药方案 1。
表1 : 本品单药方案及剂量调整

a 随后的剂量可被调高至150 mg/m 2 或减低至50 mg/m 2 ,根据患者个体耐受情况以 25 到 50 mg/m 2 的水平递减。
b 随后的剂量可被调整至 200 mg/m 2 ,根据患者个体耐受情况以50 mg/m 2 的水平递减。
- 患者有以下任一情况者,可考虑盐酸伊立替康的起始剂量减少1个剂量等级:年龄大于65岁、曾接受盆腔/腹部放疗、体力状态2分或胆红素水平中度升高(17-34 µmol/L) 1。
▍有肝功能损害的患者 1
肝功能异常的患者,推荐以下起始剂量 1:
表2 : 有肝功能异常患者的起始剂量——单药方案
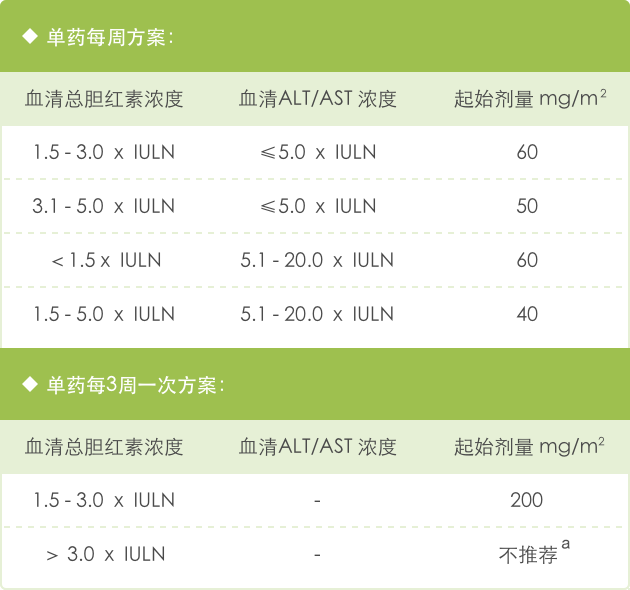
a 在胆红素>3.0 x IULN的患者中,盐酸伊立替康每3周一次给药方案的安全性和药代动力学尚不明确。而且该方案不推荐在这类患者中使用。
▍有肾功能损害的患者 1
目前没有对肾功能损害患者进行临床研究。因此要特别注意监测肾功能损害患者。不推荐透析患者使用本药物 1。
▍制备和用药注意事项 1
如同其它有潜在毒性的抗肿瘤药物,在制备本品输注液时要小心操作。推荐使用手套。如果盐酸伊立替康溶液接触到皮肤,应立即用肥皂和清水彻底冲洗皮肤。如果本品接触到粘膜,则用清水彻底冲洗 1。
▍制备输注液 1
- 与其他注射用药一样,本品溶液的配制必须严格遵循无菌原则 1。
- 盐酸伊立替康注射液只能一次性使用,任何未使用的部分必须丢弃 1。
- 盐酸伊立替康注射液在输注之前必须用5%葡萄糖注射液或0.9%氯化钠注射液稀释至终浓度为0.12至2.8mg/ml的输注液。其它药物不能加入输注液中。只要溶液和容器允许,应在输注之前检查输注液中是否有可见的颗粒物质和变色。检查药瓶中是否有颗粒物质,当药物从药瓶中抽入注射器时再检查一遍 1。
- 在5°C或30°C相对湿度和避光条件下,盐酸伊立替康注射液稀释于输注液(0.9%氯化钠溶液和5%葡萄糖溶液)并贮藏在低密度聚乙烯或聚氯乙烯容器中,其化学和物理稳定性可保持28天。如在光照条件下其化学和物理稳定性可保持3天 1。
- 然而为了减少微生物感染的风险,推荐在使用之前才准备输注液,而且输注液准备好后应尽快使用。如果未立即使用,输注液在2-8°C条件下贮藏时间不应超过24小时,或在室温条件下(25°C)贮藏时间不超过6小时 1。
- 不要冰冻盐酸伊立替康或其溶液混合物,因为这可能导致药物沉淀形成 1。
【肝功能损害】 1
在肝功能异常的患者体内盐酸伊立替康的清除率下降,同时相对暴露于活性代谢产物SN-38的时间增加。这些效应的强度与通过检测血清总胆红素和转氨酶所评估的肝功能损害程度呈正比 1。
【肾功能损害】 1
肾功能不全对盐酸伊立替康药代动力学的影响尚未被评估 1。
【怀孕期用药】 1
目前没有关于怀孕妇女使用盐酸伊立替康的严格对照的研究。当怀孕妇女使用本品后可能引起胎儿的损害。有生育能力的女性不应开始伊立替康治疗,除非已排除怀孕的可能性。如果伴侣双方有任何一方使用伊立替康,则应避免怀孕。
考虑到潜在遗传毒性,建议具有生育能力的女性患者在伊立替康治疗期间及末次给药后6 个月内始终采取高效避孕措施。考虑到潜在遗传毒性,如果男性患者的女性伴侣具有生育能力,建议该男性患者在伊立替康治疗期间及末次给药后3 个月内始终采取有效避孕措施 1。
【哺乳期用药】 1
可用数据仅限于一例患者。在一例哺乳期患者的乳汁中检测到了伊立替康及其活性代谢物SN-38。其对新生儿/婴儿的影响未知。由于喂养婴儿具有发生严重不良反应的潜在风险,所以推荐在使用本品时中断人乳喂养。
给鼠静脉滴注放射标记的盐酸伊立替康后5 分钟内,乳汁中显示有放射活性。而且在输注后的4 小时乳汁中浓度是相应血浆浓度的65 倍。已证明盐酸伊立替康会损害鼠的学习能力而且会引起出生后发育迟缓 1。
【儿童用药】 1
儿童使用本品的安全性或有效性尚不确定 1。
【老年用药】 1
在一些研究中每周输注盐酸伊立替康,其在≥65岁的患者体内的终末半衰期是6.0小时,而在<65岁的患者体内为5.5小时。在≥65岁的患者中SN-38的剂量--标准化AUC0-24 比<65岁的患者高11%。没有关于老年患者每三周一次给药方案的药代动力学数据。基于这个给药方案的临床药物毒性经验,建议在≥65岁的患者中使用较低的初始剂量 1。
▍CYP3A4和/或UGT1A1抑制剂 1
伊立替康和其活性代谢物SN-38代谢通过人细胞色素P450 3A4同工酶(CYP3A4)、尿苷二磷酸葡萄糖醛酸转移酶1A1(UGT1A1)。伊立替康与CYP3A4和/或UGT1A1抑制剂联合用药可能导致增加伊立替康和活性代谢物SN-38的全身暴露量。医生在使用伊立替康和这些药物的时候,应该考虑到这一点 1。
- 酮康唑:同时接受酮康唑治疗会引起盐酸伊立替康的清除率显著下降,导致其活性代谢产物SN-38暴露增加。在开始盐酸伊立替康治疗前至少一周应停止使用酮康唑,当然它也不能与盐酸伊立替康一同给药 1。
- 阿扎那韦:同时使用阿扎那韦,一种CYP3A4和UGT1A1的抑制剂,可能使伊立替康的活性代谢产物SN-38暴露增加 1。
▍CYP3A4诱导剂 1
- 抗惊厥剂:合并使用CYP3A诱导的抗惊厥剂(如卡马西平、苯巴比妥或苯妥英)会引起SN-38暴露减少。对于需要抗惊厥剂治疗的患者,应该考虑在初次使用盐酸伊立替康治疗之前至少一周开始或换用非酶诱导的抗惊厥剂 1。
- St. John’s Wort(贯叶连翘):在同时接受贯叶连翘治疗的患者,活性代谢产物SN-38的暴露减少。在初次使用盐酸伊立替康前至少一周停用贯叶连翘,该药也不能与盐酸伊立替康同时使用 1。
▍其它相互作用 1
- 神经肌肉阻断剂:盐酸伊立替康和神经肌肉阻断剂之间的相互作用不能被排除。因为盐酸伊立替康有胆碱酯酶抑制剂的活性,有胆碱酯酶抑制活性的药物可以延长氯琥珀胆碱的神经肌肉阻滞作用,并且可以对抗非去极化药物的神经肌肉阻滞作用 1。
- 抗肿瘤药物:本品的不良事件,如骨髓抑制和腹泻可以被其它有相似不良反应的抗肿瘤药物加重 1。
- 地塞米松:接受盐酸伊立替康治疗的患者有淋巴细胞减少的报道,地塞米松作为止吐药使用时可能会使这种情况加重。然而,并没有发现严重的机会性感染,也没有发现因为淋巴细胞减少症而导致的任何并发症。接受本品的患者有血糖增高的报道。通常这种情况发生在本品治疗之前就有糖尿病病史或有葡萄糖耐量下降的患者。部分患者的血糖增高有可能是因为接受地塞米松而引起的 1。
- 丙氯拉嗪:在单药每周给药方案的临床研究中,在盐酸伊立替康治疗当天同时给予丙氯拉嗪的患者,其静坐不能的发生率比较高(8.5%, 4/47 患者),当这两种药不是同天给予时其发生率比较低(1.3%, 1/80 患者)。然而,8.5%的静坐不能的发生率仍在丙氯拉嗪作为用其他药物化疗前用药出现静坐不能的报道范围之内 1。
- 缓泻剂:本品治疗的同时使用缓泻剂有可能会加重腹泻的严重程度或发生率,但是尚未进行这方面的研究 1。
- 利尿剂:由于在本品诱导的呕吐和/或腹泻后有继发脱水的潜在风险,医师应该避免在盐酸伊立替康治疗时使用利尿剂,当然在腹泻或呕吐时也不能使用利尿剂 1。
- 贝伐珠单抗:一项专门的药物相互作用试验的结果表明,贝伐珠单抗对伊立替康及其活性代谢物SN-38的药代动力学没有显著影响。1
- 慢性炎性肠病和/或肠梗阻 1。
- 胆红素超过正常值上限的3 倍 1。
- 严重骨髓抑制 1。
- WHO 体力状态评分> 2 1。
- 本品禁用于对该药物或辅料过敏的患者。在临床研究中未发现盐酸伊立替康具有抗原性,但是在豚鼠和兔子的被动皮内过敏反应实验中以及豚鼠的主动性全身过敏反应实验中都发现盐酸伊立替康有抗原性。在这些实验中,所有的动物都产生了针对盐酸伊立替康的抗体,部分豚鼠因为对盐酸伊立替康过敏而死亡 1。
- 本品禁用于准备怀孕的妇女 1。
- 本品禁用于怀孕和哺乳期的妇女 1。
- 应用:本品须在有使用细胞毒化疗药物经验的肿瘤专科医师的监督指导下使用。只有在能方便地获得充足的诊断和治疗设备的情况下,才可能给予并发症恰当的处理 1。
- 在以下情况下,只有在权衡预期获益与可能的治疗风险后才能开具伊立替康:1
- 在存在风险因素的患者中,尤其是WHO体力状态评分=2的患者。
- 治疗不良反应时患者可能不遵医嘱的极少数情况下(一旦出现迟发性腹泻需要立即并长时间接受止泻治疗并大量补液)。建议对此类患者进行严格的院内监督。
- 药物外渗:本品是通过静脉滴注给药的。需要注意防止外渗,静滴部位要注意观察是否有炎症发生。一旦发生外渗,用无菌水冲洗并推荐给予冰敷 1。
- Mayo Clinic方案:除非是设计完善的临床研究,本品不能与“Mayo Clinic”方案中的5-FU/LV给药方法(连续给药4-5天,每4周一次)联用是因为报告显示毒性有所增加,包括中毒性死亡 1。
- 免疫抑制剂效应/感染易感性增加:由于使用化疗药物包括盐酸伊立替康而导致免疫功能低下的患者接种活疫苗或减毒活疫苗,可能导致严重或致命的感染。使用盐酸伊立替康的患者应当避免接种活疫苗。可以接种死疫苗或灭活疫苗,但是可能会减弱疫苗的疗效 1。
- 心血管系统:使用本品的患者血栓事件罕有发生。具体发生的原因仍然不明 1。
▍在下述情况时慎用 1
- 有特殊风险的患者:体力状态差的、年老的和曾接受过盆腔/腹部放疗的患者接受本品治疗的时候,医师要特别注意监测。体力状态差的患者发生盐酸伊立替康相关不良事件的风险会增加。临床研究中比较接受盐酸伊立替康/5-FU/LV或5-FU/LV的患者,发现住院率、中性粒细胞减少性发热、血栓栓塞、第一疗程化疗中断率和早期死亡的发生率在体力状态评分为2 分的患者高于0或1分的患者。体力状态评分为3或4分的患者不能接受本品治疗 1。
- 肾功能损害:目前没有对肾功能损害患者进行临床研究。因此要特别注意监测肾功能损害患者。不推荐透析患者使用本药物 1。
- 放疗:曾接受盆腔/腹部放疗的患者在接受盐酸伊立替康治疗后,发生严重骨髓抑制的风险增加。关于放疗与本品同时进行的方案没有充分的研究,不推荐这种治疗方案 1。
- 肝功能损害:高胆红素血症的患者,盐酸伊立替康的清除率下降,所以其血液毒性的风险增加。血清总胆红素大于正常值上限3倍的患者,盐酸伊立替康作为单药每3周一次给药方案尚未确定。在单药每周给药方案的临床研究中,血清总胆红素中度增高(17-34 µmol/L)的患者在治疗第一周期中发生3或4级中性粒细胞减少的可能性高于血清总胆红素小于17 µmol/L的患者(50% 比18%; p<0.001)。胆红素糖脂化过程异常的患者,如有Gilbert综合症的患者,在接受本品治疗后发生骨髓抑制的风险较高 1。
- 胆碱能效应:盐酸伊立替康具有胆碱能效应,有哮喘或心血管疾病的患者在使用时要谨慎。有机械性肠梗阻或尿路梗阻的患者使用时也要谨慎 1。
- 呼吸系统:表现为肺内浸润的间质性肺部疾病在盐酸伊立替康治疗中很少见。间质性肺部疾病可能是致命的。先前存在的肺部疾病、使用有肺毒性的药物、放疗和使用集落刺激因子都可能是发生间质性肺部疾病的风险因子。有以上风险因子的患者在使用盐酸伊立替康之前和治疗期间都要密切观察呼吸系统症状 1。
▍给药前 1
- 监测:推荐在每次使用本品前要密切监测白细胞计数及分类,血红蛋白和血小板计数。在每次用药前、每月或有临床指征时监测肝功能 1。
- 恶心和呕吐:盐酸伊立替康可以引起呕吐。推荐患者用药前先给予止吐剂。在每周给药方案的临床研究中,大部分患者接受地塞米松10mg联合另一种止吐剂如5-HT3阻滞剂(如恩丹司琼或格拉司琼)的治疗。应该在化疗的当天,输注本品前至少30分钟给予止吐药。根据随后的需要,医师也可以考虑给予患者止吐药(如丙氯拉嗪)。如果患者呕吐伴有迟发性腹泻则需要尽快住院治疗 1。
- 患者须知:应该告知患者使用本品后的毒副作用,尤其是胃肠道并发症例如腹泻、恶心、呕吐、腹部痉挛和感染 1。
- 告知患者一旦在使用本品后出现下述任一情况,必须向医师咨询:第一次腹泻;24小时内无法控制腹泻;呕吐;发热或有感染的征象;脱水症状如身体衰弱、轻度的头晕或头昏;血便或黑便;因为恶心或呕吐而不能摄入液体。告知患者有脱发的可能。禁止使用泻药,如需使用任何泻药应联系自己的医师 1。
- 通过对两项联合治疗的III期研究和几项单药治疗的临床研究的安全性汇总分析,建立伊立替康的安全性概况 1。
- 联合治疗常见不良反应(≥30%)为:恶心、呕吐、腹痛、腹泻、便秘、厌食、粘膜炎、中性粒细胞减少、白细胞减少(包括淋巴细胞减少)、贫血、血小板减少、乏力、疼痛、发热、感染、胆红素异常、脱发 2。
- 单药治疗常见不良反应(≥30%)为:恶心、呕吐、腹痛、腹泻、便秘、厌食、中性粒细胞减少、白细胞减少(包括淋巴细胞减少)、贫血、乏力、发热、体重下降、脱发 2。
- 迟发性腹泻和中性粒细胞减少是伊立替康的主要剂量限制性毒性反应,是可预测、可逆转、无蓄积的,只要及时准确处理均可控制 3,4。
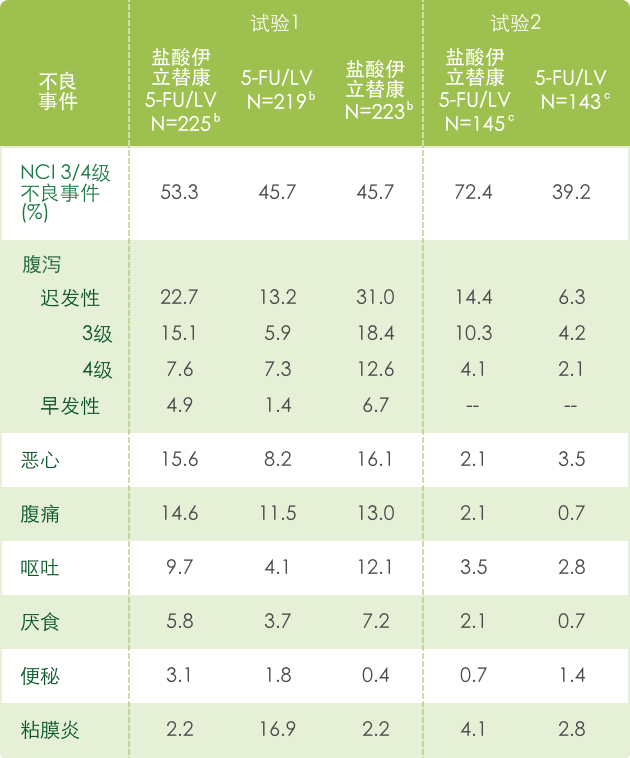
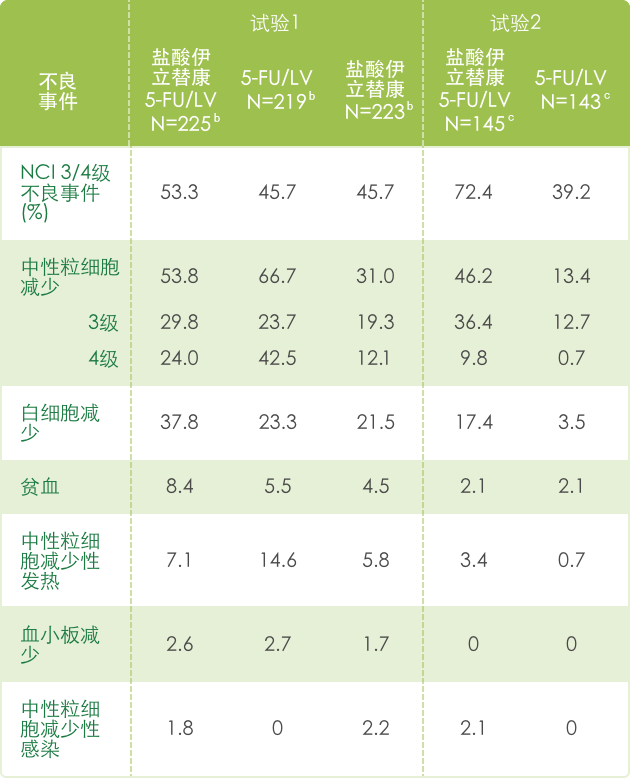
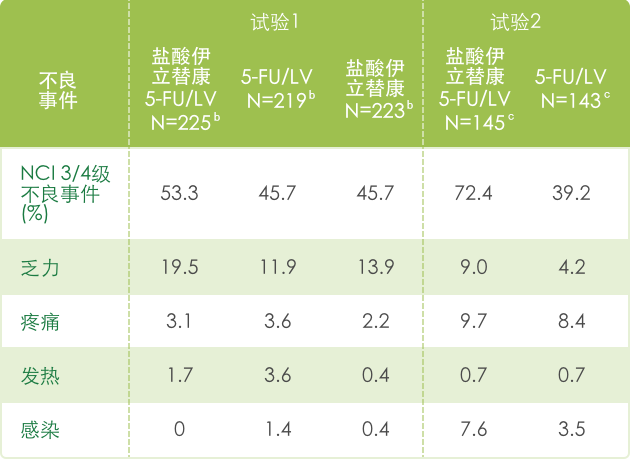
▍联合治疗常见3/4不良反应 a(N=995) 1
【胃肠道】
【血液系统】
【全身症状】
【代谢和营养】
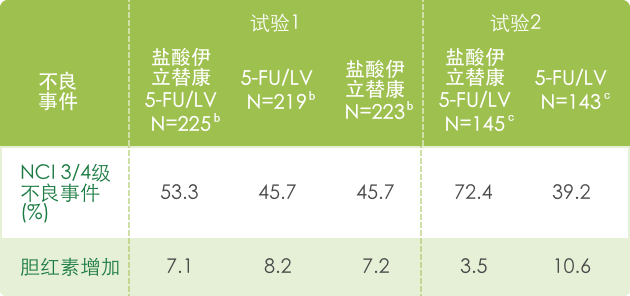
【皮肤病】
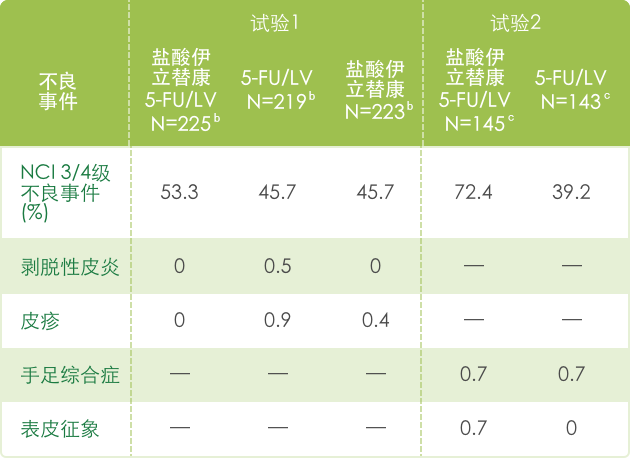
【呼吸系统】
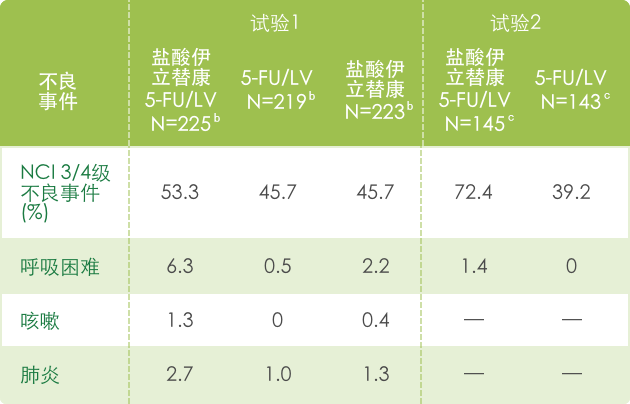
【神经系统】
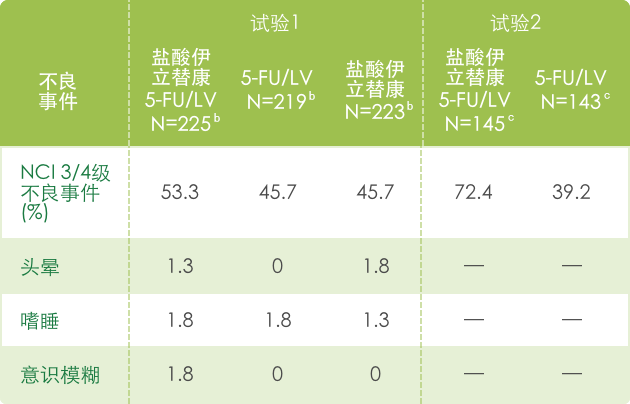
【心血管系统】
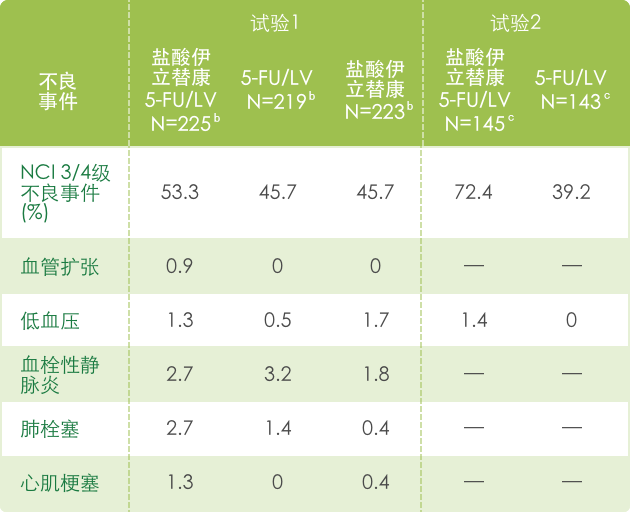
a 基于NCI CTC (version 1.0)标准评判不良事件的严重性,见 http://ctep.info.nih.gov/CTC3/default.htm
b 每组患者治疗数
c 接受de Gramont 方案治疗的患者人数。
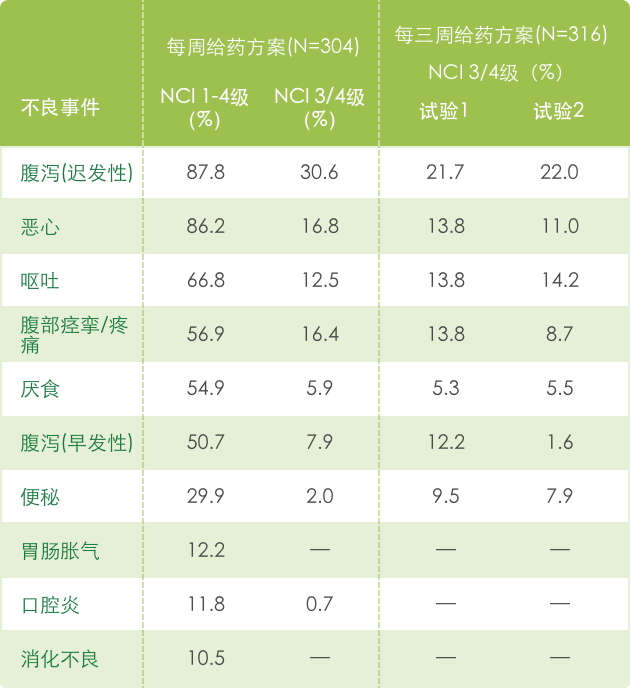
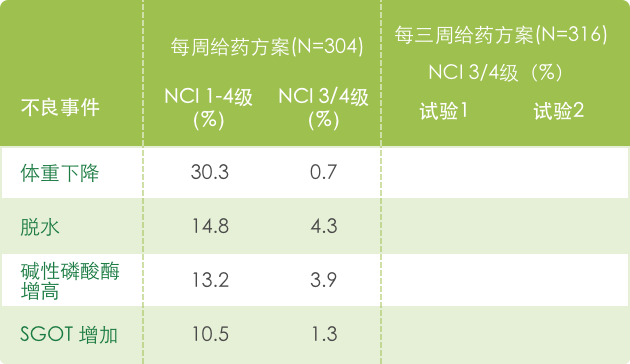
▍单药治疗常见不良反应 a(N=620) 1
【胃肠道】
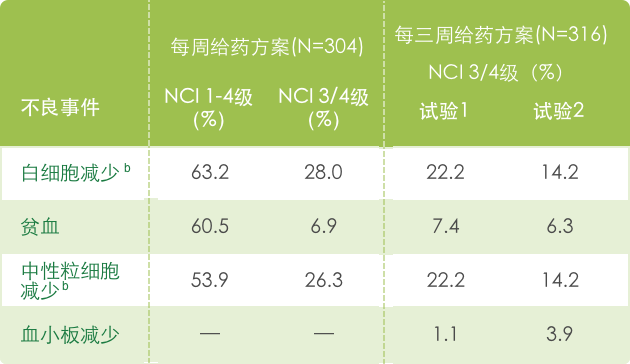
【血液系统】
【全身症状】
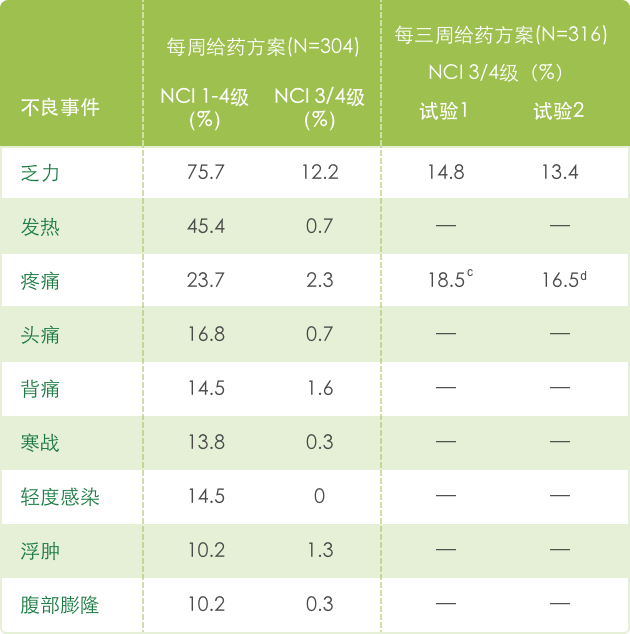
【代谢和营养】
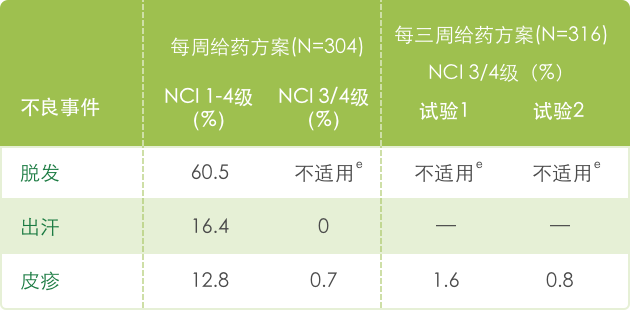
【皮肤病】
【呼吸系统】
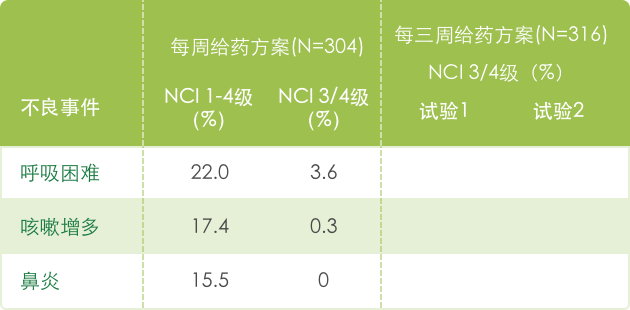
a 基于NCI CTC (version 1.0) 标准评判不良事件的严重性, 见 http://ctep.info.nih.gov/CTC3/default.htm。
b 每三周一次给药药方案中出现的白细胞减少和中性粒细胞减少数据结合在一起表述。
c 在这个试验中,22.2%接受最佳支持治疗的患者出现了NCI 3/4 级疼痛。
d 在这个试验中,13.2%接受静脉滴注5-FU 的患者出现了NCI 3/4 级疼痛。
e 头发完全脱落 = 2 级。
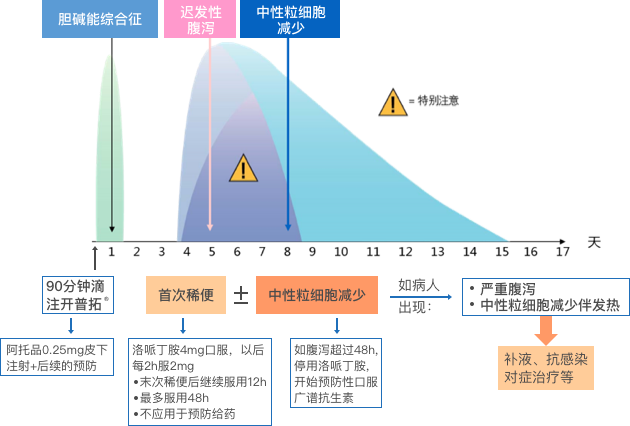
常见不良反应发生的中位时间及处理汇总 1,4,5,6。
伊立替康用药指南旨在帮助您评估患者出现的不良事件的分级,并提供伊立替康说明书及医学文献中描述的处理策略。辉瑞公司无法对患者的治疗做出任何建议,应由医生根据特定患者的病史和临床状况做出临床判断,以采取合适的治疗措施。
在伊立替康化疗期间,可能会发生两种类型的腹泻:早发性腹泻和迟发性腹泻 1。
▍概况
早发性腹泻:
● 在用药后的24小时内发生(在静滴伊立替康时或结束后的短时间内发生),是胆碱能综合征的表现之一 1,4。
● 国内有关伊立替康所致早发性腹泻发生率的文献报道很少 7,两项小样本研究表明,早发性腹泻发生率分别为4.0%和4.55% 7,8。
● 通常是暂时性的,很少为严重性的;有可能同时伴有鼻炎、流涎增多、瞳孔缩小、流泪、出汗、潮红、心动过缓和可引起腹部绞痛的肠蠕动亢进症状 1。
● 阿托品有助于缓解这些症状 1。
迟发性腹泻:
● 通常在使用伊立替康 24 小时后发生 1,呈剂量相关性,是伊立替康的剂量限制性毒性反应之一 4 。
● 总发生率为40% 9,10,单药治疗和联合治疗的严重腹泻(NCI 3/4级)发生率分别为16-22%和11-14% 11。
● 出现第一次稀便的中位时间为滴注后第5天 1。
● 接受单药125 mg/m2每周给药方案的患者中,发生任何级别的迟发性腹泻,其中位持续时间是3天,其中3或4级迟发性腹泻的中位持续时间是7天 1。
● 可能导致脱水、电解质紊乱或感染,甚至为致命性的 1。
● ≥65岁的患者发生3和4级腹泻的频率明显增高(39.8% 比 23.4%, p=0.0025) 1。
▍分级及剂量调整:腹泻分级 1,12
(点击下列分级按钮进行选择)
腹泻分级:1级
定义
与治疗前相比,每天排便增加<4次;与治疗前相比,造瘘口排便略有增加
◆盐酸伊立替康/5-FU/LV 联合方案
| 在治疗周期中 | 下一疗程开始时 |
| 延迟用药直至恢复至基线水平,然后给予相同的剂量 | 维持剂量水平 |
◆盐酸伊立替康单药方案
| 在某一治疗周期中 | 下一疗程开始时 | |
| 每周一次 | 每周一次 | 每3周一次 |
| 减少1个剂量水平 | 维持剂量水平 | 维持剂量水平 |
腹泻分级:2级
定义
与治疗前相比,每天排便增加4-6次,或夜间排便;与治疗前相比,造瘘口排便中度增加,但不影响正常活动
◆盐酸伊立替康/5-FU/LV 联合方案
| 在治疗周期中 | 下一疗程开始时 |
| 停止用药直至恢复至基线水平,然后减少1个剂量水平 | 维持剂量水平 |
◆盐酸伊立替康单药方案
| 在某一治疗周期中 | 下一疗程开始时 | |
| 每周一次 | 每周一次 | 每3周一次 |
| 减少1个剂量水平 | 维持剂量水平 | 维持剂量水平 |
腹泻分级:3级
定义
与治疗前相比,每天排便增加≥7次或尿失禁;或需要肠外输液治疗脱水;与治疗前相比,造瘘口排便严重增加,影响正常活动
◆盐酸伊立替康/5-FU/LV 联合方案
| 在治疗周期中 | 下一疗程开始时 |
| 停止用药直至恢复至基线水平,然后减少1个剂量水平 | 减少1个剂量水平 |
◆盐酸伊立替康单药方案
| 在某一治疗周期中 | 下一疗程开始时 | |
| 每周一次 | 每周一次 | 每3周一次 |
| 停药直到恢复至 2级,然后减少1个剂量水平 | 减少1个剂量水平 | 减少1个剂量水平 |
腹泻分级:4级
定义
需要重症监护;或血流动力学衰竭
◆盐酸伊立替康/5-FU/LV 联合方案
| 在治疗周期中 | 下一疗程开始时 |
| 停止用药直至恢复至基线水平,然后减少2个剂量水平 | 减少2个剂量水平 |
◆盐酸伊立替康单药方案
| 在某一治疗周期中 | 下一疗程开始时 | |
| 每周一次 | 每周一次 | 每3周一次 |
| 停药直到恢复至 2级,然后减少2 个剂量水平 | 减少2个剂量水平 | 减少1个剂量水平 |
注: a相对于先前化疗周期中使用的起始剂量。
▍腹泻的管理
腹泻是肿瘤患者在化疗中常见的并发症之一,严重者可导致水和电解质失衡,化疗中断,甚至危及生命。化疗药物导致腹泻的主要原因是化疗药物导致肠道黏膜细胞损伤而引起肠道黏膜坏死及炎症反应,导致肠道黏膜吸收、分泌失衡,即形成腹泻 4。
一般处理步骤 4:
● 首先,对其严重程度进行评估分级,并完善电解质、肝肾功能、血尿便常规等检查,积极对症支持治疗。
● 其次,对可能引起腹泻的病因进行分析,排除因抗生素引起的菌群失调造成的腹泻,如存在,需停用抗生素并给予调节菌群等对症支持治疗;判断是否是化疗相关不良反应,是否应用了容易引起腹泻的相关药物,如相关,应立即停止化疗及相关药物,及时给予治疗;另外排除是否存在感染,必要时完善细菌培养及药敏,给予对应抗生素治疗。
腹泻治疗方法 5:
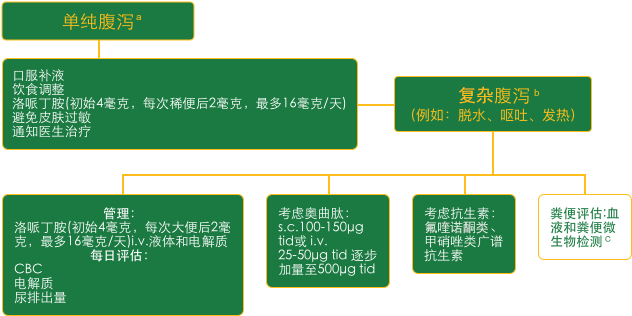
注: a治疗环境:门诊和/或门诊支持性护理门诊病房。 b住院治疗。 c艰难梭菌、沙门氏菌、弯曲杆菌和其他传染性结肠炎的原因。
CBC:全血计数;i.v.:静脉注射;s.c.:皮下;tid:一天三次。
▍概况
● 约9%的患者用药后出现短暂严重的急性胆碱能综合征。主要表现为:早发性腹泻及腹痛、结膜炎、鼻炎、低血压、血管舒张、出汗、寒战、全身不适、头晕、视力障碍、瞳孔缩小、流泪、流涎增多1,4。
● 产生机制主要与伊立替康母体药物抑制胆碱酯酶活性引起的胆碱能神经兴奋有关,具有明显的剂量相关性, 在高剂量的时候更容易发生 1,13,14,15。
● 常发生于用药后24h内,是一过性的。出现这些症状的时间与胃肠外盐酸伊立替康给药血浆峰浓度出现的时间一致;由于伊立替康的清除终末半衰期大约为5-12h左右, 24h后胆碱能综合征可逐渐缓解1,13,15。
● 偶尔情况较严重时,可采用皮下注射硫酸阿托品来治疗(有禁忌证者除外),一般均可缓解,既往发生过类似反应的患者也可给予阿托品预防 4,13。
● 有哮喘或心血管疾病的患者在使用时要谨慎。有机械性肠梗阻或尿路梗阻的患者使用时也要谨慎 1。
▍分级及剂量调整:腹痛分级 1,12
(点击下列分级按钮进行选择)
腹痛分级:1级
定义
轻度腹痛,不影响功能
◆盐酸伊立替康/5-FU/LV 联合方案
| 在治疗周期中 | 下一疗程开始时 |
| 维持剂量水平 | 维持剂量水平 |
◆盐酸伊立替康单药方案
| 在某一治疗周期中 | 下一疗程开始时 | |
| 每周一次 | 每周一次 | 每3周一次 |
| 维持剂量水平 | 维持剂量水平 | 维持剂量水平 |
腹痛分级:2级
定义
中度腹痛:疼痛或止痛药影响功能,但不影响日常生活活动
◆盐酸伊立替康/5-FU/LV 联合方案
| 在治疗周期中 | 下一疗程开始时 |
| 停药直到恢复至≤1级,然后减少1个剂量水平 | 维持剂量水平 |
◆盐酸伊立替康单药方案
| 在某一治疗周期中 | 下一疗程开始时 | |
| 每周一次 | 每周一次 | 每3周一次 |
| 减少1个剂量水平 | 减少1个剂量水平 | 减少1个剂量水平 |
腹痛分级:3级
定义
重度疼痛:疼痛或止痛药严重影响日常生活活动
◆盐酸伊立替康/5-FU/LV 联合方案
| 在治疗周期中 | 下一疗程开始时 |
| 停药直到恢复至≤2级,然后减少1个剂量水平 | 减少1个剂量水平 |
◆盐酸伊立替康单药方案
| 在某一治疗周期中 | 下一疗程开始时 | |
| 每周一次 | 每周一次 | 每3周一次 |
| 停药直到恢复至≤2级,然后减少1个剂量水平 | 减少1个剂量水平 | 减少1个剂量水平 |
腹痛分级:4级
定义
致残
◆盐酸伊立替康/5-FU/LV 联合方案
| 在治疗周期中 | 下一疗程开始时 |
| 停药直到恢复至≤2级,然后减少2个剂量水平 | 减少2个剂量水平 |
◆盐酸伊立替康单药方案
| 在某一治疗周期中 | 下一疗程开始时 | |
| 每周一次 | 每周一次 | 每3周一次 |
| 停药直到恢复至≤2级,然后减少1个剂量水平 | 减少2个剂量水平 | 减少1个剂量水平 |
▍分级及剂量调整:低血压分级1,12
(点击下列分级按钮进行选择)
低血压分级:1级
定义
血压改变,但不需要治疗(包括暂时性直立性低血压)
◆盐酸伊立替康/5-FU/LV 联合方案
| 在治疗周期中 | 下一疗程开始时 |
| 维持剂量水平 | 维持剂量水平 |
◆盐酸伊立替康单药方案
| 在某一治疗周期中 | 下一疗程开始时 | |
| 每周一次 | 每周一次 | 每3周一次 |
| 维持剂量水平 | 维持剂量水平 | 维持剂量水平 |
低血压分级:2级
定义
需要简单的补液或其他治疗,但不需住院;对生理无影响
◆盐酸伊立替康/5-FU/LV 联合方案
| 在治疗周期中 | 下一疗程开始时 |
| 停药直到恢复至≤1级,然后减少1个剂量水平 | 维持剂量水平 |
◆盐酸伊立替康单药方案
| 在某一治疗周期中 | 下一疗程开始时 | |
| 每周一次 | 每周一次 | 每3周一次 |
| 减少1个剂量水平 | 减少1个剂量水平 | 减少1个剂量水平 |
低血压分级:3级
定义
需要治疗和持续的医疗护理,但在对生理没有造成持续影响的情况下得到了解决
◆盐酸伊立替康/5-FU/LV 联合方案
| 在治疗周期中 | 下一疗程开始时 |
| 停药直到恢复至≤2级,然后减少1个剂量水平 | 减少1个剂量水平 |
◆盐酸伊立替康单药方案
| 在某一治疗周期中 | 下一疗程开始时 | |
| 每周一次 | 每周一次 | 每3周一次 |
| 停药直到恢复至≤2级,然后减少1个剂量水平 | 减少1个剂量水平 | 减少1个剂量水平 |
低血压分级:4级
定义
休克(与酸血症和组织灌注不足引起的重要器官功能损害有关)
◆盐酸伊立替康/5-FU/LV 联合方案
| 在治疗周期中 | 下一疗程开始时 |
| 停药直到恢复至≤2级,然后减少2个剂量水平 | 减少2个剂量水平 |
◆盐酸伊立替康单药方案
| 在某一治疗周期中 | 下一疗程开始时 | |
| 每周一次 | 每周一次 | 每3周一次 |
| 停药直到恢复至≤2级,然后减少1个剂量水平 | 减少2个剂量水平 | 减少1个剂量水平 |
▍胆碱能综合征的管理
对于乙酰胆碱能综合征, 一方面要注意预防, 另一方面要注意对症治疗 3。
● 给药前12 小时要嘱患者禁食 3。
● 当患者出现确诊的乙酰胆碱能综合征时, 皮下注射硫酸阿托品0.25 mg, 以尽快缓解症状 3,4。
● 对有急性严重乙酰胆碱能综合征既往史的患者, 下次给予伊立替康时, 应预防性使用硫酸阿托品 3,4。
● 除阿托品外,丁溴东莨菪碱也可以显著改善或预防胆碱能综合征的发生 14,16。
● 化疗过程中应加强巡视,严密观察患者有无腹痛、多汗、流涎、视力模糊等症状 17。
▍概况
● 恶心、呕吐是伊立替康常见的不良反应,无论是单药还是联合治疗发生率均≥30% 1,2;
● 单药治疗时出现严重恶心与呕吐的发生率约10%,联合5-FU/LV时稍低 13;
● 每次用药前应预防性使用止吐药 , 呕吐合并迟发性腹泻的患者应尽快住院治疗 18;
▍分级及剂量调整:恶心分级 1,12
(点击下列分级按钮进行选择)
恶心分级:1级
定义
可以进食
◆盐酸伊立替康/5-FU/LV 联合方案
| 在治疗周期中 | 下一疗程开始时 |
| 维持剂量水平 | 维持剂量水平 |
◆盐酸伊立替康单药方案
| 在某一治疗周期中 | 下一疗程开始时 | |
| 每周一次 | 每周一次 | 每3周一次 |
| 维持剂量水平 | 维持剂量水平 | 维持剂量水平 |
恶心分级:2级
定义
经口摄入明显减少
◆盐酸伊立替康/5-FU/LV 联合方案
| 在治疗周期中 | 下一疗程开始时 |
| 停药直到恢复至≤1级,然后减少1个剂量水平 | 维持剂量水平 |
◆盐酸伊立替康单药方案
| 在某一治疗周期中 | 下一疗程开始时 | |
| 每周一次 | 每周一次 | 每3周一次 |
| 减少1个剂量水平 | 减少1个剂量水平 | 减少1个剂量水平 |
恶心分级:3级
定义
无明显摄入,需要静脉输液
◆盐酸伊立替康/5-FU/LV 联合方案
| 在治疗周期中 | 下一疗程开始时 |
| 停药直到恢复至≤2级,然后减少1个剂量水平 | 减少1个剂量水平 |
◆盐酸伊立替康单药方案
| 在某一治疗周期中 | 下一疗程开始时 | |
| 每周一次 | 每周一次 | 每3周一次 |
| 停药直到恢复至≤2级,然后减少1个剂量水平 | 减少1个剂量水平 | 减少1个剂量水平 |
恶心分级:4级
定义
-
◆盐酸伊立替康/5-FU/LV 联合方案
| 在治疗周期中 | 下一疗程开始时 |
◆盐酸伊立替康单药方案
| 在某一治疗周期中 | 下一疗程开始时 | |
| 每周一次 | 每周一次 | 每3周一次 |
注:短横线(-)意味着不存在该分级
▍分级及剂量调整:呕吐分级 1,12
(点击下列分级按钮进行选择)
呕吐分级:1级
定义
经预处理,24小时内呕吐1次
◆盐酸伊立替康/5-FU/LV 联合方案
| 在治疗周期中 | 下一疗程开始时 |
| 维持剂量水平 | 维持剂量水平 |
◆盐酸伊立替康单药方案
| 在某一治疗周期中 | 下一疗程开始时 | |
| 每周一次 | 每周一次 | 每3周一次 |
| 维持剂量水平 | 维持剂量水平 | 维持剂量水平 |
呕吐分级:2级
定义
经预处理,24小时内呕吐2-5次
◆盐酸伊立替康/5-FU/LV 联合方案
| 在治疗周期中 | 下一疗程开始时 |
| 停药直到恢复至≤1级,然后减少1个剂量水平 | 维持剂量水平 |
◆盐酸伊立替康单药方案
| 在某一治疗周期中 | 下一疗程开始时 | |
| 每周一次 | 每周一次 | 每3周一次 |
| 减少1个剂量水平 | 减少1个剂量水平 | 减少1个剂量水平 |
呕吐分级:3级
定义
经预处理,24小时内呕吐≥6次;或需要静脉输液
◆盐酸伊立替康/5-FU/LV 联合方案
| 在治疗周期中 | 下一疗程开始时 |
| 停药直到恢复至≤2级,然后减少1个剂量水平 | 减少1个剂量水平 |
◆盐酸伊立替康单药方案
| 在某一治疗周期中 | 下一疗程开始时 | |
| 每周一次 | 每周一次 | 每3周一次 |
| 停药直到恢复至≤2级,然后减少1个剂量水平 | 减少1个剂量水平 | 减少1个剂量水平 |
呕吐分级:4级
定义
需要肠外营养;或生理情况需要重症监护;血流动力学衰竭
◆盐酸伊立替康/5-FU/LV 联合方案
| 在治疗周期中 | 下一疗程开始时 |
| 停药直到恢复至≤2级,然后减少2个剂量水平 | 减少2个剂量水平 |
◆盐酸伊立替康单药方案
| 在某一治疗周期中 | 下一疗程开始时 | |
| 每周一次 | 每周一次 | 每3周一次 |
| 停药直到恢复至≤2级,然后减少1个剂量水平 | 减少2个剂量水平 | 减少1个剂量水平 |
▍胃肠道反应的管理
● 化疗所致恶心呕吐(CINV)是一种常见且令人畏惧的伴随症状,它是导致患者化疗依从性下降的主要原因,CINV严重影响患者的生活质量及化疗的实施和疗效,若控制不佳,对临床工作和患者治疗均会带来严重影响 19。
● 抗呕吐治疗的目的就是在最大程度上减轻患者的恶心、呕吐反应,改善生活质量,保证化疗的正常进行 20。
● 根据抗肿瘤药物的催吐性分级,伊立替康属于中度催吐风险等级,如不予以预防处理,呕吐发生率为30%-90% 4,21。
治疗原则 4,22:
● 预防为主:在肿瘤相关治疗开始前,应充分评估呕吐发生风险,制订个体化的呕吐防治方案。如在化疗前给予预防性的止吐治疗。在末剂化疗后,接受高度和中度催吐风险药物进行化疗的患者,恶心、呕吐风险分别至少持续3 天和2 天。因此在整个风险期,均需对呕吐予以防护。
● 止吐药的选择:主要应基于抗肿瘤治疗药物的催吐风险、既往使用止吐药的经历以及患者本身因素。
● 对于多药方案:应基于催吐风险最高的药物来选择止吐药。联合应用若干种止吐药能够更好地控制恶心和呕吐,特别是采用高度催吐化疗时。
恶心和呕吐的预防 19,23:
- 化疗所致恶心呕吐的疗前管理主要体现在急性恶心呕吐和延迟性恶心呕吐的预防上。急性恶心呕吐一般发生在给药后数分钟至数小时,并在给药后5-6 h达高峰,但多在24 h内缓解。延迟性恶心呕吐多在化疗24 h之后发生,可持续数天,一般认为2-5 d19。
- 对于中度催吐性化疗所致恶心呕吐的预防19,23:

△:既往研究显示,在预防和治疗CINV方面, DXM 20 mg与12mg之间差异无统计学意义,考虑到临床获益及地塞米松带来的不良反应,可以将第1天地塞米松用量从20 mg减为12 mg。
*:如第1天使用过。
#:推荐选择性用于那些既往5-HT3 RA+DXM两联方案失败的,或还伴有其他恶心呕吐高危因素的患者。
恶心呕吐后续疗程 19:
- 指南提示,可基于Dranitsaris评分系统调整化疗所致恶心呕吐的后续疗程。≥16分的患者在下一次化疗时≥2级CINV发生率可达60%以上。该评分系统有87.4%的灵敏度,虽然特异度仅为38.4%,但仍可有效针对每例患者的治疗方案及个体情况,更准确便捷、更个体化的预测其CINV发生风险,从而优化患者的CINV管理和后续疗程调整用药 19。
Dranitsaris评分系统的风险评分算法19
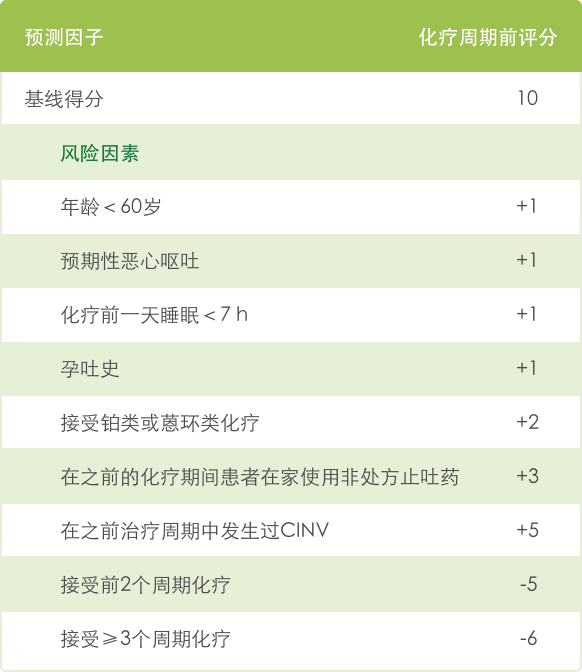
基于Dranitsaris评分系统调整CINV用药19
【HEC方案】

【含卡铂的MEC方案】

【不含卡铂的MEC方案】

【LEC方案】

【无致吐药物方案】

Dranitsaris评分系统:即基于患者特征,如年龄、心理预期、睡眠时间、既往孕吐、是否接受蒽环或铂类药物、是否在家服用止吐药,以及既往是否出现过CINV和化疗程数等进行评分。
▍概况
● 骨髓抑制是伊立替康的另一个主要剂量限制性毒性反应 24。
● 伊立替康常会引起中性粒细胞减少、白细胞减少(包括淋巴细胞减少)和贫血 1。
● 在伊立替康单药治疗中, 78.7%的患者出现过中性粒细胞减少,严重者(中性粒细胞计数<500 /mm 3) 占 22.6%。在伊立替康联合治疗中, 82.5%的患者出现中性粒细胞减少, 严重者占 9.8% 3。
● 中性粒细胞减少是可逆的、无蓄积性,到最低点的中位时间为8天,单药治疗通常在第 22 天完全恢复正常, 联合治疗通常在 7-8天中完全恢复正常 3,25。中性粒细胞减少并发发热的发生率约5%,并发感染的发生率约1% 13。
● Crigler-Najjar 综合征(I 型及 II 型)或具有 UGT1A1*28 纯合子的患者(Gilbert 综合征)在使用中、高剂量的伊立替康(>150mg/m 2)后,发生3-4级血液毒性的风险增大 1。
● 先前接受盆腔/腹部放疗的患者,伊立替康治疗后发生严重骨髓抑制的风险增加 2。按照单药每周给药方案,总血清胆红素浓度为1.0-2.0 mg/dL的患者出现3-4级中性粒细胞减少的可能性更大 2。
▍分级及剂量调整:中性粒细胞减少分级 1,12
(点击下列分级按钮进行选择)
≥1000-<1500/mm 3
中性粒细胞减少分级:1级
定义
≥1.0-<1.5×10 9/L
≥1000-<1500/mm 3
◆盐酸伊立替康/5-FU/LV 联合方案
| 在治疗周期中 | 下一疗程开始时 |
| 维持剂量水平 | 维持剂量水平 |
◆盐酸伊立替康单药方案
| 在某一治疗周期中 | 下一疗程开始时 | |
| 每周一次 | 每周一次 | 每3周一次 |
| 维持剂量水平 | 维持剂量水平 | 维持剂量水平 |
≥500-<1000/mm 3
中性粒细胞减少分级:2级
定义
≥0.5-<1.0×10 9/L
≥500-<1000/mm 3
◆盐酸伊立替康/5-FU/LV 联合方案
| 在治疗周期中 | 下一疗程开始时 |
| 减少1个剂量水平 | 维持剂量水平 |
◆盐酸伊立替康单药方案
| 在某一治疗周期中 | 下一疗程开始时 | |
| 每周一次 | 每周一次 | 每3周一次 |
| 减少1个剂量水平 | 维持剂量水平 | 维持剂量水平 |
≥100-<500/mm 3
中性粒细胞减少分级:3级
定义
≥0.1-<0.5×10 9/L
≥100-<500/mm 3
◆盐酸伊立替康/5-FU/LV 联合方案
| 在治疗周期中 | 下一疗程开始时 |
| 停药直到恢复至≤2级,然后减少1个剂量水平 | 减少1个剂量水平 |
◆盐酸伊立替康单药方案
| 在某一治疗周期中 | 下一疗程开始时 | |
| 每周一次 | 每周一次 | 每3周一次 |
| 停药直到恢复至≤2级,然后减少1个剂量水平 | 减少1个剂量水平 | 减少1个剂量水平 |
<100/mm 3
中性粒细胞减少分级:4级
定义
<0.1×10 9/L
<100/mm 3
◆盐酸伊立替康/5-FU/LV 联合方案
| 在治疗周期中 | 下一疗程开始时 |
| 停药直到恢复至≤2级,然后减少2个剂量水平 | 减少2个剂量水平 |
◆盐酸伊立替康单药方案
| 在某一治疗周期中 | 下一疗程开始时 | |
| 每周一次 | 每周一次 | 每3周一次 |
| 停药直到恢复至≤2级,然后减少2个剂量水平 | 减少2个剂量水平 | 减少1个剂量水平 |
▍分级及剂量调整:中性粒细胞减少性发热分级 1,12
(点击下列分级按钮进行选择)
中性粒细胞减少性发热分级:1级
定义
-
◆盐酸伊立替康/5-FU/LV 联合方案
| 在治疗周期中 | 下一疗程开始时 |
◆盐酸伊立替康单药方案
| 在某一治疗周期中 | 下一疗程开始时 | |
| 每周一次 | 每周一次 | 每3周一次 |
中性粒细胞减少性发热分级:2级
定义
-
◆盐酸伊立替康/5-FU/LV 联合方案
| 在治疗周期中 | 下一疗程开始时 |
◆盐酸伊立替康单药方案
| 在某一治疗周期中 | 下一疗程开始时 | |
| 每周一次 | 每周一次 | 每3周一次 |
中性粒细胞减少性发热分级:3级
定义
中性粒细胞绝对值<1.0×10 9/L,且体温≥38.5°C
◆盐酸伊立替康/5-FU/LV 联合方案
| 在治疗周期中 | 下一疗程开始时 |
| 停药直到恢复,然后减少2个剂量水平 | 停药直到恢复,然后减少2个剂量水平 |
◆盐酸伊立替康单药方案
| 在某一治疗周期中 | 下一疗程开始时 | |
| 每周一次 | 每周一次 | 每3周一次 |
| 停药直到恢复,然后减少2 个剂量浓度 | 减少2个剂量水平 | 减少1个剂量水平 |
中性粒细胞减少性发热分级:4级
定义
致命性败血症(如败血性休克)
◆盐酸伊立替康/5-FU/LV 联合方案
| 在治疗周期中 | 下一疗程开始时 |
| 停药直到恢复,然后减少2个剂量水平 | 停药直到恢复,然后减少2个剂量水平 |
◆盐酸伊立替康单药方案
| 在某一治疗周期中 | 下一疗程开始时 | |
| 每周一次 | 每周一次 | 每3周一次 |
| 停药直到恢复,然后减少2 个剂量浓度 | 减少2个剂量水平 | 减少1个剂量水平 |
注:短横线(-)意味着不存在该分级
▍分级及剂量调整:白细胞减少分级 1,12
(点击下列分级按钮进行选择)
≥2000-<3000/mm 3
白细胞减少分级:1级
定义
≥2.0-<3.0×10 9/L
≥2000-<3000/mm 3
◆盐酸伊立替康/5-FU/LV 联合方案
| 在治疗周期中 | 下一疗程开始时 |
| 维持剂量水平 | 维持剂量水平 |
◆盐酸伊立替康单药方案
| 在某一治疗周期中 | 下一疗程开始时 | |
| 每周一次 | 每周一次 | 每3周一次 |
| 维持剂量水平 | 维持剂量水平 | 维持剂量水平 |
≥1000-<2000/mm 3
白细胞减少分级:2级
定义
≥1.0-<2.0×10 9/L
≥1000-<2000/mm 3
◆盐酸伊立替康/5-FU/LV 联合方案
| 在治疗周期中 | 下一疗程开始时 |
| 减少1个剂量水平 | 维持剂量水平 |
◆盐酸伊立替康单药方案
| 在某一治疗周期中 | 下一疗程开始时 | |
| 每周一次 | 每周一次 | 每3周一次 |
| 减少1个剂量水平 | 维持剂量水平 | 维持剂量水平 |
≥500-<1000/mm 3
白细胞减少分级:3级
定义
≥0.5-<1.0×10 9/L
≥500-<1000/mm 3
◆盐酸伊立替康/5-FU/LV 联合方案
| 在治疗周期中 | 下一疗程开始时 |
| 停药直到恢复至≤2级,然后减少1个剂量水平 | 减少1个剂量水平 |
◆盐酸伊立替康单药方案
| 在某一治疗周期中 | 下一疗程开始时 | |
| 每周一次 | 每周一次 | 每3周一次 |
| 停药直到恢复至≤2级,然后减少1个剂量水平 | 减少1个剂量水平 | 减少1个剂量水平 |
<500/mm 3
白细胞减少分级:4级
定义
<0.5×10 9/L
<500/mm 3
◆盐酸伊立替康/5-FU/LV 联合方案
| 在治疗周期中 | 下一疗程开始时 |
| 停药直到恢复至≤2级,然后减少2个剂量水平 | 减少2个剂量水平 |
◆盐酸伊立替康单药方案
| 在某一治疗周期中 | 下一疗程开始时 | |
| 每周一次 | 每周一次 | 每3周一次 |
| 停药直到恢复至≤2级,然后减少2个剂量水平 | 减少2个剂量水平 | 减少1个剂量水平 |
▍血液学毒性的管理
-
中性粒细胞减少是骨髓抑制性化疗最严重的血液学毒性,中性粒细胞减少伴发热(FN)是最主要的临床并发症。对于中性粒细胞减少的患者,伊立替康化疗方案的调整如下 1,26。
注意:化疗期间,患者应每周复查1-2次血常规,检测白细胞与中性粒细胞水平;应告知患者在化疗后7-14d自行测量体温进行监测,如发现FN症状需在当地门诊或入院进行治疗 26。
-
药物治疗:使用盐酸伊立替康化疗的患者,出现中性粒细胞减少的并发症时应及时给予抗生素治疗,并不需要常规给予粒细胞集落刺激因子(G-CSF)治疗,但是医师可以考虑给予中性粒细胞减少患者使用CSF,方案如下26:
【治疗药物:G-CSF】

【治疗药物:抗生素】


▍概况
● 是患者接受伊立替康治疗后临床最显著的不良事件之一,发生率约为11%-59% 1,27。
● 一般在治疗开始后3-4周发生, 可影响眉毛 、睫毛等体毛,治疗结束后可完全恢复 18。
● 在治疗前应告知患者有脱发的可能性,并告知患者停药后会恢复 1,13。
▍分级及剂量调整:脱发分级 1,12
(点击下列分级按钮进行选择)
脱发分级:1级
定义
轻度脱发
◆盐酸伊立替康/5-FU/LV 联合方案
| 在治疗周期中 | 下一疗程开始时 |
| 维持剂量水平 | 维持剂量水平 |
◆盐酸伊立替康单药方案
| 在某一治疗周期中 | 下一疗程开始时 | |
| 每周一次 | 每周一次 | 每3周一次 |
| 维持剂量水平 | 维持剂量水平 | 维持剂量水平 |
脱发分级:2级
定义
明显脱发
◆盐酸伊立替康/5-FU/LV 联合方案
| 在治疗周期中 | 下一疗程开始时 |
| 停药直到恢复至≤1级,然后减少1个剂量水平 | 维持剂量水平 |
◆盐酸伊立替康单药方案
| 在某一治疗周期中 | 下一疗程开始时 | |
| 每周一次 | 每周一次 | 每3周一次 |
| 减少1个剂量水平 | 减少1个剂量水平 | 减少1个剂量水平 |
脱发分级:3级
定义
—
◆盐酸伊立替康/5-FU/LV 联合方案
| 在治疗周期中 | 下一疗程开始时 |
◆盐酸伊立替康单药方案
| 在某一治疗周期中 | 下一疗程开始时 | |
| 每周一次 | 每周一次 | 每3周一次 |
脱发分级:4级
定义
—
◆盐酸伊立替康/5-FU/LV 联合方案
| 在治疗周期中 | 下一疗程开始时 |
◆盐酸伊立替康单药方案
| 在某一治疗周期中 | 下一疗程开始时 | |
| 每周一次 | 每周一次 | 每3周一次 |
注:短横线(—)意味着不存在该分级
▍脱发的管理 28
● 如果认为脱发不可能变得更严重或威胁生命,可以原剂量使用化疗药物。
● 化疗前10分钟可给患者戴上冰帽,使头皮血管收缩,减少药物到达毛囊,减轻脱发。
● 停药后1-2个月毛发开始再生。化疗期间也可配合服用一些养血、补气、滋补肝肾的中药,可以使脱发减少并帮助头发再生。
● 化疗前做好患者的心理护理,消除顾虑,降低负面情绪。
▍概况
● 乏力是结直肠癌患者中常见的症状,尤其是在接受治疗的患者中 29。
● 乏力会对患者的日常生活产生明显的影响,并直接影响患者的生活质量;而且有持续乏力症状的结直肠癌患者死亡风险更高(较无乏力患者死亡风险增加2.56倍) 29。
● 乏力也是伊立替康常见的不良反应,无论是单药还是联合治疗发生率均≥30% 2。
▍分级及剂量调整:乏力分级 1,12
(点击下列分级按钮进行选择)
乏力分级:1级
定义
与基线相比,乏力程度增加,但不影响正常活动
◆盐酸伊立替康/5-FU/LV 联合方案
| 在治疗周期中 | 下一疗程开始时 |
| 维持剂量水平 | 维持剂量水平 |
◆盐酸伊立替康单药方案
| 在某一治疗周期中 | 下一疗程开始时 | |
| 每周一次 | 每周一次 | 每3周一次 |
| 维持剂量水平 | 维持剂量水平 | 维持剂量水平 |
乏力分级:2级
定义
中等(如ECOG体能状态下降1个等级或Karnofsky或Lansky评分下降20%)或导致某些活动执行困难
◆盐酸伊立替康/5-FU/LV 联合方案
| 在治疗周期中 | 下一疗程开始时 |
| 停药直到恢复至≤1级,然后减少1个剂量水平 | 维持剂量水平 |
◆盐酸伊立替康单药方案
| 在某一治疗周期中 | 下一疗程开始时 | |
| 每周一次 | 每周一次 | 每3周一次 |
| 减少1个剂量水平 | 减少1个剂量水平 | 减少1个剂量水平 |
乏力分级:3级
定义
严重(如ECOG体能状态下降2个等级或Karnofsky或Lansky评分下降40%)或丧失进行某些活动的能力
◆盐酸伊立替康/5-FU/LV 联合方案
| 在治疗周期中 | 下一疗程开始时 |
| 停药直到恢复至≤2级,然后减少1个剂量水平 | 减少1个剂量水平 |
◆盐酸伊立替康单药方案
| 在某一治疗周期中 | 下一疗程开始时 | |
| 每周一次 | 每周一次 | 每3周一次 |
| 停药直到恢复至≤2级,然后减少1个剂量水平 | 减少1个剂量水平 | 减少1个剂量水平 |
乏力分级:4级
定义
卧床或致残
◆盐酸伊立替康/5-FU/LV 联合方案
| 在治疗周期中 | 下一疗程开始时 |
| 停药直到恢复至≤2级,然后减少2个剂量水平 | 减少2个剂量水平 |
◆盐酸伊立替康单药方案
| 在某一治疗周期中 | 下一疗程开始时 | |
| 每周一次 | 每周一次 | 每3周一次 |
| 停药直到恢复至≤2级,然后减少1个剂量水平 | 减少2个剂量水平 | 减少1个剂量水平 |
▍乏力的管理
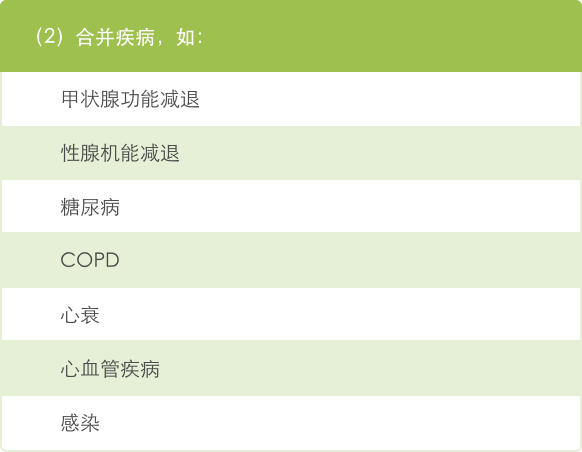
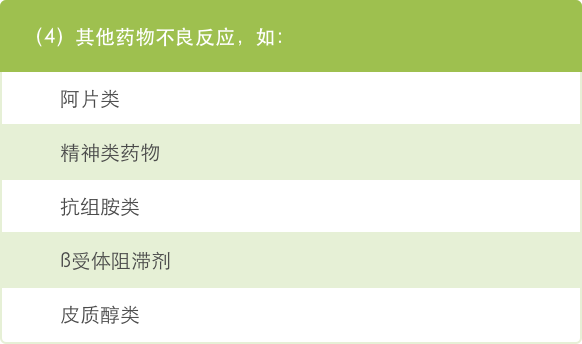
● 许多与癌症和治疗相关的因素可能导致乏力,因此在降低治疗剂量之前应分析导致乏力的可能原因 29。
癌症相关乏力的原因 29:



乏力的管理 29:
- 很少有药物被证明可以减轻疲劳,锻炼可以改善体能指标,有助于消除各种原因所致的乏力。NCCN指南中推荐0-10数字等级量表,0-3分为没有乏力或者轻度乏力,4-6分为中度乏力,7-10分为重度乏力。不同程度的乏力采取的管理方法如下:
(1)对于轻度乏力患者(0-3分):开展如何预防乏力的患者教育;
(2)中度和重度乏力(4-10分):根据肿瘤治疗阶段考虑处理方法,如下:

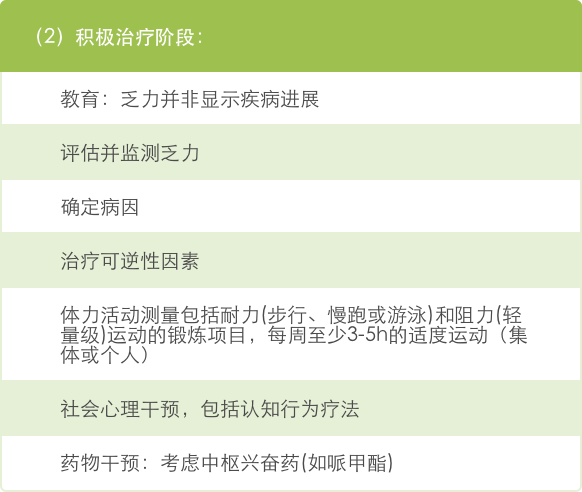

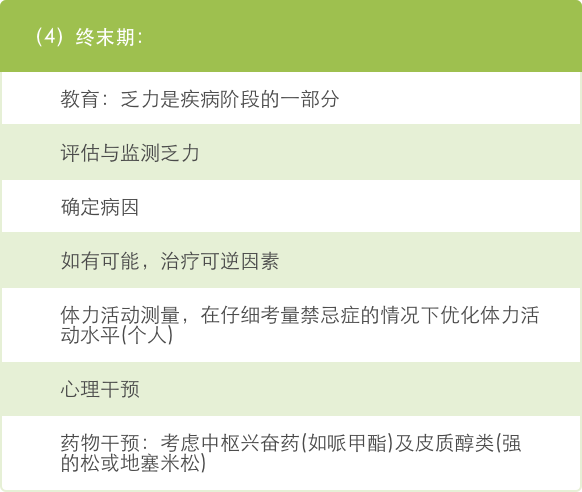
伊立替康用药指南旨在帮助您评估患者出现的不良反应的分级,并提供伊立替康说明书及医学文献中描述的处理策略。辉瑞公司无法对患者的治疗做出任何建议,应由医生根据特定患者的病史和临床状况做出临床判断,以采取合适的治疗措施。
针对如下常见不良反应,患者的应对措施:
调整饮食 20
● 进食高蛋白、高热能的地残渣食物。
● 避免对胃肠道有刺激的饮食,如饮酒、辛辣、过热、过凉等食物。
● 如果出现无力、疲劳或化验检查表明血钾下降,则宜进食高钾食物,如目鱼、芦笋等,也可口服氯化钾液体等药物。
● 少食多餐,每天至少进3000ml流质,如鸡汤、鱼汤等,保持电解质的平衡。
● 如果有蔗糖不耐受现象,则避免牛奶及其他奶制品。
● 食物中加入肉豆蔻,能降低胃肠道的活动性。
● 严重腹泻时,应首先进流质饮食,逐渐改为半流质,直至普通饮食。
直肠区黏膜和皮肤的护理 20
● 每次排便后用温水及软性皂清洗肛门,并用软纸轻轻吸干。
● 表面涂用软膏,促使皲裂皮肤愈合。
● 以软膏或喷雾方式局部用麻醉药,以接触肛门区疼痛不适。
● 应用高猛软甲液经常性坐浴。
出现以下情况时,及时告知医生或护士 30
● 治疗期间第一次腹泻。
● 大便或肛门周围有血。
● 剧烈腹痛或绞痛。
● 脱水的迹象或症状(如头晕、低血压、少尿、心理状态变化等)。
● 因恶心或呕吐而不能喝水。
● 发烧或感染的迹象。
● 持续腹泻,尽管24小时的洛哌丁胺治疗。
● 治疗当天避免进食含乳糖、咖啡因、油炸食物或含大豆成分的药物 17。
● 用药前遵医嘱预防性使用阿托品,肌注阿托品后要卧床,防止坠床或摔倒 17。
● 在出现出汗、流涎、视力模糊等症状时,及时报告医生及护士 17。
● 及时更换潮湿的衣裤、床单,保证患者的舒适度 3。
● 必要时监测血压,以防血压过低产生休克、虚脱的症状 3。
恶心 20,28
● 少食多餐(每天5-6次),如果不吃任何东西,恶心的现象会更严重 20,28。
● 早上起床时感到恶心,可吃少量苏打饼干 28。
● 改善进食方法,缓缓吃,慢慢喝,细细地咀嚼 28。
● 可尝试低酸性食物,如果没有口炎或食管炎,可用柠檬汁加入水中轻轻漱口 20。
● 含气的饮料对减轻恶心有帮助,但有腹胀者避免饮用 28。
● 可选用冷食或生的新鲜蔬菜,熟食有时可增加恶心的感觉 28。
● 尽可能避免油炸、油腻、过咸和辛辣的食物 20,28。
● 避免气味强烈的食物或者煮食的气味 28。
● 化疗前及化疗后1-2小时,避免进食 20。
● 保持环境安静,采取舒适的体位休息。经常变换体位有益于减少恶心的感觉,如果仰卧时出现恶心,建议采取坐位 20。
● 敞开房间窗户或们,接触新鲜空气,保持房间空气流畅 20。
● 分散注意力,如听音乐、看电视,或与他人聊天等 20。
● 如果在恶心期间睡着,但醒后仍恶心,则在起床前服用抗呕吐药物,并休息30-60分钟 20。
● 记录恶心发生的时间、原因、找出规律,改变饮食习惯 28。
呕吐 28
● 遵医嘱定时服用止吐药物。
● 尽量避免可能造成恶心的情况。

中性粒细胞作为白细胞的一种,能够抵抗感染,当患者中性粒细胞的数量减少时容易感染,即使像感冒一样的轻微感染也容易引起威胁生命的严重疾病 26,28。
● 患者治疗期间白细胞数会降低,此时需要到医院采血化验,当出现发热或者以下任何感染症状时,应及时告知医生:咳嗽、伴或不伴有白色泡沫痰;排尿有烧灼感;静脉导管留置部位疼痛;口疮;任何部位表现出红肿。
● 体温超过38.5℃,通常表明发生了感染,患者体温超过38℃,需按医嘱用药,并在医院做全面体检,包括验血、胸部X线片和其他化验,如尿液和痰液化验,每4h监测一次体温,体温上升时通知医生。
● 如果出现发热或感染症状,立即告诉医生或护士,说明以下情况:最后一次治疗时间;24h内最高体温;是否发生寒战;任何感染症状。
● 对于白细胞水平过低的患者,需要预防性隔离,每日对房间进行空气消毒。注意室内通风,注意房间、地面和加剧家具的消毒卫生。
● 限制探视人员数量,特别要控制感染(尤其上呼吸道感染)人员的探视;尽量不去人群聚集的公共场所,外出时应当佩戴口罩。
● 保持口腔卫生及皮肤清洁,避免皮肤破损。
● 鼓励进食高蛋白、高能量、高维生素的清淡饮食, 必要时静脉补充营养以增强抵抗力。
心理护理 28
● 化疗导致的脱发尤其对女性患者会造成极大的心理负担,影响化疗开展。做好解释工作,化疗所引发的脱发可以再生,且往往比以前更黑、更有光泽 。
调整饮食 28
● 饮食清淡,少食刺激性食物,避免过量进食糖类和脂肪类食物。多食用有益食物如芝麻、核桃、黑豆、动物肝脏、瘦肉、鸡蛋、乳类、菠菜、卷心菜、芹菜等。
局部护理 28
● 在脱发开始时,及时剪发,保持个人卫生的同时减轻脱发带来的心理压力;脱发后,头皮敏感,应使用中性洗发水,且水温不宜过高;避免烫发染发、高温吹风机吹发;如果头部会暴露在强烈的阳光或寒冷的空气中,应使用头巾或帽子遮挡。
调整生活习惯 28
● 不用易产生静电的尼龙梳子,在空气粉尘污染严重的环境佩戴防护帽并及时洗头。外出佩戴帽子避免紫外线照射。多梳头和多剃头帮助改善头皮循环。
锻炼可以改善体能指标,有助于消除各种原因所致的乏力 28
● 告知患者及家属乏力出现的可能性。
● 出院前教会患者用日记的形式在适当的时候记录自身关于乏力的感受,包括发生时间、持续状态、乏力的程度、缓解的方法等,有助于医护人员和患者确定改善乏力的方式,并制定相应措施。
● 优化睡眠质量,养成良好的、规律的休息与睡眠习惯,避免长时间的午睡,睡前避免进食刺激性饮食或进行剧烈运动,建议睡前可通过喝热牛奶、温热水泡脚或听舒缓音乐辅助入眠。
● 适当进行有氧运动,以缓解乏力,建议每天运动3-5次,累积时间 >30分钟,每周运动至少3天。
● 进行简单的娱乐,如听音乐、看电视,以减轻精神迟钝和注意力分散,从而减轻乏力。
● 日常活动注意能量储存,不要直接提起重物,有乏力感觉时马上停止劳动,进行休息。
● 采用中医保健疗法,如按摩足三里、天柱、气海、关元、膻中等穴位缓解乏力。
1.盐酸伊立替康注射液说明书.
2.CAMPTOSAR® (Irinotecan) Injection, intravenous infusion. Prescribing information.
3.张怡等. 伊立替康的不良反应及处理. 中国药物警戒. 2006; 3(5):271-273.
4.国家卫生计生委合理用药专家委员会. 消化道恶性肿瘤合理用药指南. 中国合理用药探索. 2017;14(9):5-54.
5.Bossi P, et al. Diarrhoea in adult cancer patients: ESMO Clinical Practice Guidelines. Ann Oncol. 2018 Oct 1;29(Suppl 4):iv126-iv142.
6.蒋婷等. 1例伊立替康所致严重腹泻伴粒细胞缺乏患者的治疗分析与药学监护中国药物应用与监测.2018;15(4):211-214.
7.徐素珍. 结直肠癌患者化疗相关性腹泻的临床研究. 浙江大学, 2014.
8.梅丹等. 伊立替康化疗相关性腹泻发生的特点与危险因素分析. 中国医院药学杂志. 2019;39(2):191-195.
9.张晓光等. 25例伊立替康治疗晚期肠癌致不良反应的分析. 中国药物警戒.2013;10(3):168-171.
10.王伟兰等. 伊立替康临床应用的安全性研究. 中国药业. 2011;20(3):41-42.
11.Deng C, et al. Preventive Effects of a Chinese Herbal Formula, Shengjiang Xiexin Decoction, on Irinotecan-Induced Delayed-Onset Diarrhea in Rats. Evid Based Complement Alternat Med. 2017;2017:7350251.
12.National Cancer Institute. CTCAE v.2.0. Available at: https://ctep.cancer.gov/protocolDevelopment/electronic_applications/docs/ctcv20_4-30-992.pdf. Accessed Aug 2019.
13.刘加葳等. 盐酸伊立替康的不良反应及其预防处理.中国新药杂志. 2007;16(17):1355-1360.
14.Kanbayashi Y, et al. Predictive factors for the development of irinotecan-related cholinergic syndrome using ordered logistic regression analysis. Med Oncol. 2018 Apr 28;35(6):82.
15.刘慧龙等. 伊立替康治疗结直肠癌相关胆碱能综合征89例. 世界华人消化杂志. 2012(11):975-979.
16.Iihara H, et al. Prophylactic effect of scopolamine butylbromide, a competitive antagonist of muscarinic acetylcholine receptor, on irinotecan-related cholinergic syndrome. Cancer Chemother Pharmacol. 2019 Mar;83(3):393-398.
17.杨敏等. FOLFIRI方案治疗转移性结直肠癌的护理. 肿瘤预防与治疗, 2012, 25(3):191-193.
18.孙祎等. 伊立替康不良反应及其临床干预进展. 中国药房. 2007;18(35):2781-2783.
19.上海市抗癌协会癌症康复与姑息专业委员会. 化疗所致恶心呕吐全程管理上海专家共识(2018年版). 中国癌症杂志. 2018;28(11):946-960.
20.王哲海等编著. 肿瘤化疗不良反应与对策. 济南:山东科学技术出版社, 2002.04.
21.Grabenbauer GG, et al. Management of Radiation and Chemotherapy Related Acute Toxicity in Gastrointestinal Cancer. Best Pract Res Clin Gastroenterol. 2016 Aug;30(4):655-64.
22.中国抗癌协会癌症康复与姑息治疗专业委员会, 等. 肿瘤治疗相关呕吐防治指南(2014版).临床肿瘤学杂志, 2014;19(3):263-273.
23.NCCN Guidelines®. Antiemesis. Version 1.2019. available at www.nccn.org.
24.Saltz LB. Clinical Use of Irinotecan: Current Status and Future Considerations. Oncologist. 1997;2(6):402-409.
25.卢惠明等. 开普拓治疗晚期大肠癌的护理. 南方护理学报. 2002;9(2):51-52.
26.中国临床肿瘤学会指南工作委员会. 肿瘤放化疗相关中性粒细胞减少症规范化管理指南. 中华肿瘤杂志.2017;39(11): 868-878.
27.Jansman FG, et al. Management of chemotherapy-induced adverse effects in the treatment of colorectal cancer. Drug Saf. 2001;24(5):353-67.
28.强万敏,姜永亲著. 肿瘤护理学. 天津:天津科技翻译出版公司, 2016.07.
29.Aapro M, et al. A Practical Approach to Fatigue Management in Colorectal Cancer. Clin Colorectal Cancer. 2017 Dec;16(4):275-285.
30.Richardson G, et al. Chemotherapy induced diarrhea. J Oncol Pharm Pract. 2007 Dec;13(4):181-98.


