1. 不能手术的晚期肾细胞癌(RCC) 1
2. 甲磺酸伊马替尼治疗失败或不能耐受的胃肠间质瘤(GIST) 1
3. 不可切除的,转移性高分化进展期胰腺神经内分泌瘤(pNET)成年患者 1
▍推荐剂量
舒尼替尼治疗胃肠间质瘤和晚期肾细胞癌的推荐剂量是50mg,每日一次,口服,服药4周,停药2周(4/2给药方案),直至疾病进展或出现不能耐受的毒性 1。
对于胰腺神经内分泌瘤,舒尼替尼推荐剂量为37.5 mg,口服,每日一次,直至疾病进展或出现不能耐受的毒性 1。
与食物同服或不同服均可 1。
▍剂量调整方案
安全性和耐受性
对于胃肠间质瘤和转移性肾细胞癌,根据患者个体的安全性和耐受性,以12.5mg为梯度单位逐步调整剂量。每日最高剂量不超过 75mg,最低剂量为25mg 1。
对于胰腺神经内分泌瘤,根据患者个体的安全性和耐受性,以 12.5mg为梯度单位逐步调整剂量。在3期临床试验中使用的最大剂量为每日50mg 1。
根据患者个体的安全性和耐受性情况可能需要中断治疗 1。
终末期肾病 (ESRD) 血液透析患者的剂量调整
终末期肾病 (ESRD) 血液透析患者无需调整起始剂量。但考虑到与肾功能正常的患者相比暴露量有所下降,可根据安全性和耐受性将维持剂量逐渐增加至 2倍 1。

CYP3A4 抑制剂
与CYP3A4强抑制剂合用可能会增加舒尼替尼的血浆浓度。应选择对此类酶没有或抑制作用最小的合并用药。在与 CYP3A4 强抑制剂合用时,应考虑减少本品剂量。如果无法避免本品与CYP3A4 强抑制剂合用,应考虑降低本品剂量至下述最小剂量 1。
胃肠道间质瘤(GIST)和晚期肾细胞癌(RCC):37.5 mg,口服,每日一次,治疗方案为给药4周,停药2周(4/2给药方案)。
胰腺神经内分泌瘤:25 mg,口服,每日一次 1。
CYP3A4 诱导剂
与 CYP3A4 强诱导剂合用可能会降低舒尼替尼的血浆浓度。应选择对此类酶没有或诱导作用最小的合并用药。必须与 CYP3A4 诱导剂合用时,应考虑增加本品剂量。如果无法避免与CYP3A4强诱导剂合用,应考虑增加本品剂量至下述最大剂量 1:
胃肠道间质瘤(GIST)和晚期肾细胞癌(RCC):87.5mg,口服,每日一次,治疗方案为给药4周,停药2周(4/2给药方案)。
胰腺神经内分泌瘤:62.5 mg,口服,每日一次。
如果增加本品剂量,应仔细监测患者的不良反应 1。
乳腺癌耐药相关蛋白(BCRP)抑制剂
有关舒尼替尼与BCRP抑制剂相互作用的临床数据有限,无法排除舒尼替尼与其他BCRP抑制剂相互作用的可能性 1。
药物相互作用研究
临床研究
CYP3A4 强抑制剂对舒尼替尼的影响:在健康受试者中,舒尼替尼单剂量与酮康唑(CYP3A4 强抑制剂)合用使舒尼替尼及其活性代谢物两者合并的 Cmax和AUC0-inf分别增加 49% 和 51% 1。
CYP3A4 强诱导剂对舒尼替尼的影响:在健康受试者中,舒尼替尼单剂量与利福平(CYP3A4 强诱导剂)合用使舒尼替尼及其活性代谢物两者合并的 Cmax和AUC0-inf分别减少 23% 和 46% 1。
体外研究
体外人肝细胞和肝微粒体研究显示,临床相关浓度的舒尼替尼及其主要活性代谢物不诱导CYP1A2、CYP2E1和CYP3A4/5,也不抑制CYP1A2、CYP2A6、CYP2B6、CYP2C8、CYP2C9、CYP2C19、CYP2D6、CYP2E1、CYP3A4/5 和 CYP4A9/11 1。
对本品或药物的非活性成份严重过敏者禁用 1。
没有观察到舒尼替尼或其主要活性代谢物的药代动力学因以下因素而出现具有临床意义的差异:年龄(18至84岁)、体重(34至168 kg)、种族(白人、黑人、亚洲人)、性别、美国东部肿瘤协作组 (ECOG) 评分、轻度(Child-Pugh A 级)或中度(Child-Pugh B级)肝损伤 1。
肝功能损害患者
与肝功能正常的患者相比,在轻度外分泌肝功能损害(Child-Pugh A级)或中度肝功能损害(Child-Pugh B级)的患者中,没有预测或观察到舒尼替尼或其活性代谢物的药代动力学出现具有临床意义的差异。轻度(Child-Pugh A级)或中度(Child-Pugh B级)肝功能损害的患者接受舒尼替尼治疗无需调整初始剂量。未在重度(Child-Pugh C级)肝功能损害患者进行研究 1。
肾功能损害患者
与肾功能正常 (CLcr >80 mL/min) 的患者相比,在患有轻度(CLcr 50至80 mL/min)、中度(CLcr 30至<50 mL/min)或重度(CLcr <30 mL/min)肾损伤且没有在接受透析治疗的患者中,没有预测或观察到舒尼替尼或其活性代谢物的药代动力学出现具有临床意义的差异。
轻度(CLcr 50-80 mL/min)、中度(CLcr 30-<50 mL/min)或重度(CLcr <30 mL/min)肾功能损害且未接受透析的患者接受舒尼替尼治疗不推荐调整初始剂量。后续剂量调整应基于患者安全性及耐受性。血液透析的末期肾病患者(ESRD)不推荐调整初始剂量。虽然舒尼替尼不是通过血液透析来清除,但与肾功能正常的患者相比,接受血液透析治疗的终末期肾病(ESRD)患者的舒尼替尼系统总暴露量降低47% 1。
种族
PK研究RTKC-0511-009在新加坡进行,患者为14例亚裔(包括11例中国人)和13 例西方人的健康男性志愿者。舒尼替尼单独或者联合酮康唑给药后,亚洲人平均的舒尼替尼和其主要代谢产物的暴露(Cmax、AUC0-last 和 AUC0-∞)高于西方人,但是酮康唑对两组PK 参数的影响程度相似,提示亚洲人和西方人代谢相似。药物暴露较高与体重有关,对体重标准化后的CLPO数值进行比较的结果表明,在同一治疗期间,两个种族之间平均CLPO数值没有显著性差异(舒尼替尼单药治疗,P=0.091;联合酮康唑治疗 P=0.353) 1。
孕妇及哺乳期妇女用药
妊娠
基于动物生殖研究及其作用机制,孕妇接受舒尼替尼治疗可能会伤害胎儿(详见说明书)。尚无妊娠女性使用本品报告药物相关风险的可用数据。在动物发育和生殖毒性研究中,分别在患者50mg的每日推荐剂量(RDD)合并AUC(舒尼替尼加其活性代谢物的合并系统暴露量)的5.5和0.3倍剂量下,于器官形成期间向妊娠大鼠和家兔经口给予舒尼替尼后可见致畸性(胚胎死亡、颅面部和骨骼畸形)(详见说明书)。应告知有生育能力的女性药物对胎儿的潜在危险 1。
对于育龄用药人群,重大出生缺陷和流产的估计背景风险未知。所有妊娠均有发生出生缺陷、流产或其他不良结果的背景风险。美国普通人群,在临床可识别妊娠中发生重大出生缺陷和流产的估计背景风险分别为2%-4%和15%-20%。 1。
哺乳
没有关于舒尼替尼及其代谢物存在于人乳汁中的信息。当浓度高达 12 倍血浆水平时,舒尼替尼及其代谢物可分泌至大鼠乳汁中(详见说明书)。由于乳儿中可能发生潜在严重不良反应,故建议哺乳女性在治疗期间和末次用药后至少 4 周内不得哺乳 1。
具有生殖能力的女性和男性
妊娠女性使用本品可能对胎儿造成危害(详见说明书) 1。
● 妊娠试验
目前尚无关于舒尼替尼及其代谢物存在于人乳汁中的信息 1。
● 避孕
女性:应告知具有生殖能力的女性在舒尼替尼治疗期间及最后一次给药后至少 4 周内采取有效的避孕措施 1。
男性:基于动物生殖研究结果,建议有生育能力女性伴侣的男性患者在接受本品治疗期间及最后一次给药后至少 7 周内采取有效避孕措施 1。
● 不育
根据动物研究相关发现,舒尼替尼可损害男性和女性的生育能力(详见说明书) 1。
儿童用药
本品用于儿童患者的安全性和有效性尚未明确 1。
根据目前已有的数据,尚不推荐本品应用于该人群(详见说明书) 1。
老人
接受本品治疗的825例胃肠间质瘤(GIST)或转移性肾细胞癌(RCC)患者中有277例(34%)年龄在65岁或65岁以上。在胰腺神经内分泌瘤研究中,22例(27%)接受舒尼替尼治疗的患者为65岁及65岁以上。未发现这些患者与年轻患者在安全性或有效性方面存在差异 1。
胃肠间质瘤(GIST)、晚期肾细胞癌(RCC)或胰腺神经内分泌瘤(pNET)患者最常见的不良反应(≥20%)是疲劳、乏力、发热、腹泻、恶心、粘膜炎/口腔炎、呕吐、消化不良、腹痛、便秘、高血压、外周水肿、皮疹、手足综合征、皮肤褪色、皮肤干燥、毛发颜色改变、味觉改变、头痛、背痛、关节疼痛、肢端疼痛、咳嗽、呼吸困难、厌食和出血等 1。
胃肠间质瘤(GIST)患者≥10%的不良反应有腹泻、粘膜炎/口腔炎、便秘、高血压、皮肤褪色、皮疹、手足综合征、味觉改变、肌痛/肢痛、厌食、乏力等 1。
晚期肾细胞癌(RCC)≥10%的不良反应有疲劳、乏力、发热、体重减轻、寒战、胸痛、流感样疾病、腹泻、恶心、粘膜炎/口腔炎、呕吐、消化不良、腹痛、便秘、口干、GERD/返流性食道炎、胃肠胀气、口痛、舌痛、痔疮、高血压、外周水肿、射血分数降低、皮疹、手足综合征、皮肤褪色/皮肤发黄、皮肤干燥、发色改变、脱发、红斑、瘙痒、味觉改变、头痛、头晕、背痛、关节痛、肢端疼痛/肢体不适、甲状腺功能减退、咳嗽、呼吸困难、鼻咽炎、口咽痛、上呼吸道感染、厌食、出血(所有部位)、失眠、抑郁等 1。
胰腺神经内分泌瘤(pNET)患者≥10%的不良反应有乏力、疲劳、体重减轻、腹泻、口腔炎/口腔综合征、恶心、呕吐、消化不良、腹痛、高血压、发色改变、手足综合征、皮疹、皮肤干燥、味觉障碍、头痛、关节痛、失眠、出血事件、鼻衄等 1。
其他实验检查异常及不良反应详见说明书 1。
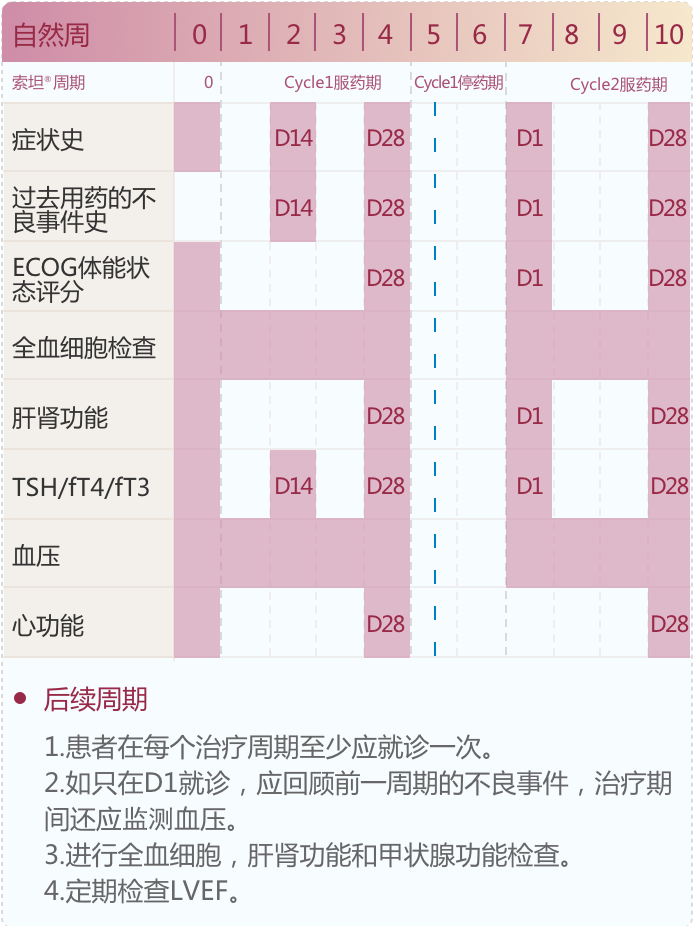
舒尼替尼不良反应发生大体开始时间 2-5

安全性评估时间表 6
皮肤或毛发颜色改变
- 皮肤黄染:由于舒尼替尼药物的颜色是黄色,其代谢可导致皮肤变黄 7。
- 毛发脱色:常发生于治疗后5-6周(男性毛发脱色常见于治疗后2~3周)。停药后2~3周左右发色变淡常可恢复,可能会对部分患者造成心理冲击并影响其生活质量 7。
- 在舒尼替尼治疗中,头发(所有级别)的颜色褪色发病率为15.2%-18.9%,皮肤褪色为26.5%-33.2% 8。
- 应事先告知患者可能出现的变化,减少对其心理的冲击 7。
甲状腺功能不全
- 已有病例报道和回顾性研究明确显示,舒尼替尼可导致甲状腺功能减退,可见于4%-35%的患者,其机制尚未明了 9,10,11。
- 在临床试验和舒尼替尼上市后经验中,已报告了甲状腺功能亢进症(部分继发甲状腺功能减退症) 1。
- 在基线时,在治疗期间及出现临床指征时,应监测甲状腺功能。应在接受本品治疗时密切监测甲状腺功能不全的症状和体征,包含甲状腺功能减退、甲状腺功能亢进和甲状腺炎。视情况开始和/或调整甲状腺功能异常的治疗 1。
乏力
- 乏力是舒尼替尼治疗中最常见的不良事件,通常出现在治疗后2~3周,3~4周后可加重,在治疗间期可消失,重新用药又出现,但不同的治疗周期情况可能不同 4。
- 在使用舒尼替尼治疗期间,患者乏力和疲劳潜在原因的评估是必不可少的 8。
- 一项在GIST患者中进行的随机、双盲、安慰剂对照的国际多中心III期临床研究结果显示,舒尼替尼组所有级别不良反应发生率为22%,3/4级不良反应发生率为5% 1。
手足综合征
- 手足综合征(HFS)在第一个疗程即可出现,但更常见于多个疗程后。国外报告发生率为13%~20%,国内小样本研究中观察到的发生率甚至高达68% 10,12,13。
- 施国海等的小样本研究(N=25)显示,手足皮肤反应为最常见的不良事件,反应发生率1~2级为56%(14/25),3级为12%(3/25)。总发生率为68%(17/25),呈现明显的周期性改变 13。
- 手足综合征通常为在手掌和足底呈现的红斑,一般为双侧。可先于感觉异常或与感觉异常同时出现。HFS红斑部位皮肤剥脱和疼痛,导致正常活动和行走障碍。HFS区域性皮肤过度角化,尤其是在足底部,可伴有结茧。HFS是舒尼替尼用药剂量调整最常见的原因 6,7。
手足综合征是舒尼替尼疗效的预测因子
对5项采用舒尼替尼一线或二线治疗mRCC的临床研究进行回顾性分析,发现与未发生HFS的患者相比,服用舒尼替尼后发生HFS的患者具有更好的客观缓解率(ORR)、无进展生存期(PFS ,P < 0.0001 )和总生存期(OS,P < 0.0001)。多因素分析显示,HFS是PFS和OS的独立预测因子 14。
皮肤毒性
- 皮肤毒性的种类、发生时间、持续时间和治疗干预的效果变异很大 6,7,15。通常出现于舒尼替尼治疗开始后4 ~ 5周,且与过敏难以区分 2。包括干皮、皮疹、瘙痒、水泡、蜕皮和皮肤角质局部增厚等 6,7,15。
高血压
- 既往未经治疗的晚期肾细胞癌研究中,舒尼替尼组和 IFN-a组分别有127/375例(34%)和13/360例(4%)的患者出现了高血压;其中3级高血压分别为50/375 例(13%)和1/360例(<1%)。6%患者因高血压导致本品剂量降低或暂时延迟给药。4例因高血压导致中断治疗,其中1例是恶性高血压患者 1。
- 胃肠间质瘤研究中,舒尼替尼组和安慰剂组各个级别高血压的发生情况相似。舒尼替尼组3级高血压为9/202例(4%);安慰剂组未察到3级高血压。无患者因高血压而中断治疗 1。
- 在胰腺神经内分泌瘤3期研究中,22/83例(27%)舒尼替尼组患者和4/82例(5%)安慰剂组患者发生高血压。其中83例舒尼替尼组胰腺神经内分泌瘤患者中有8例(10%)报告3级高血压,而82例安慰剂组患者为1例(1%)。7/83例(8%)胰腺神经内分泌瘤患者因高血压导致本品剂量降低或暂时延迟给药。1例因高血压导致中断治疗 1。
- 无4级高血压报告 1。
- 既往未经治疗的晚期肾细胞癌(RCC)研究中,舒尼替尼组32/375例(9%)和干扰素-a组3/360例(1%)患者发生了严重高血压(收缩压>200 mmHg或舒张压>110 mmHg)。胃肠间质瘤(GIST)研究中,舒尼替尼组8/202例(4%)和安慰剂组1/102例(1%)的患者发生了严重高血压。胰腺神经内分泌瘤研究中,舒尼替尼组8/80例(10%)和安慰剂组2/76例(3%)发生严重高血压 1。
- 应在基线时和有临床指征时监测血压。根据病情开始和/或调整降压治疗。在高血压病例中,应停用本品,直至高血压得到控制 1。
- 所有抑制VEGF的药物均可导致高血压。高血压可见于治疗过程中任何时间。其发生机制尚不明确,既往有高血压史的患者用药后可迅速上升 6,7,15。
- 舒尼替尼治疗患者中高血压发生率为11%~24%,3级以上高血压发生率约为3%~8%。血压在治疗休息期可缓解 10,12。
舒尼替尼引起的高血压是其疗效的预测因子 16。
对4项采用舒尼替尼一线或二线治疗转移性肾癌的临床研究进行回顾性分析,结果显示,与未发生高血压(收缩压≥140 mmHg或舒张压≥ 90 mmHg)的患者相比,服用舒尼替尼 后发生高血压的患者具有更好的ORR、PFS和OS,且差异有统计学意义(P < 0.001)。多因素分析显示,收缩压升高是PFS、OS的预测因子,而舒张压则是OS的预测因子 16。
血液学毒性
- 血液学毒性在第一个治疗周期即可发生,建议早期发现早期干预,避免后期恢复延迟需长时间用药,影响疗效。血液毒性可在治疗间期缓解,随治疗周期增加而进行性加重的情况很罕见 4,5。
- 常见的血液毒性包括:中性粒细胞减少、血小板减少和贫血 1。贫血可见于舒尼替尼治疗过程中,但多认为与肿瘤相关,而非舒尼替尼治疗相关 4。
- 研究A6181177是在中国开展的一项单臂、开放、多中心、4 期研究,目的在于评估苹果酸舒尼替尼作为二线治疗中国甲磺酸伊马替尼治疗后疾病进展或对甲磺酸伊马替尼不耐受的中国胃肠间质瘤(GIST)患者的疗效和安全性。该研究中,舒尼替尼治疗组中性粒细胞减少症所有等级发病率为49.2%,3/4级发病率为18.7%;A6181004 为舒尼替尼GIST 全球注册研究,为3 期、随机、双盲、安慰剂对照研究,比较了舒尼替尼治疗甲磺酸伊马替尼耐药或不能耐受的恶性胃肠间质瘤患者。该研究在美国,澳大利亚,意大利,英国,法国,新加坡,西班牙,加拿大,荷兰,比利时和瑞典进行。研究A6181004中,舒尼替尼治疗组西方患者中性粒细胞减少症所有等级发病率为51%,3/4级发病率为5% 1。
- 舒尼替尼胰腺神经内分泌瘤的研究结果显示,舒尼替尼治疗组中性粒细胞减少所有等级发病率为71%,3/4级发病率为16% 1。
- 一项舒尼替尼治疗甲磺酸伊马替尼治疗失败或不能耐受的胃肠间质瘤患者的研究结果显示,舒尼替尼治疗组,所有等级血小板异常发生率为38%,3/4级发生率为5% 1。
- 一项晚期肾细胞癌研究结果显示,舒尼替尼治疗组,所有等级血小板异常发生率为68%,3/4级发生率为9% 1。
- 研究A6181177中,舒尼替尼治疗组中国患者血小板减少所有等级发病率为25.4%,3/4级发病率为8.5%;研究A6181004中,舒尼替尼治疗组西方患者血小板减少所有等级发病率为40%,3/4级发病率为5% 1。
心脏毒性
- 上市后曾报告心血管事件,包括心衰、心肌病、心肌缺血和心肌梗死,部分为致死性 1。
- 接受舒尼替尼治疗的胃肠间质瘤和肾细胞癌患者中出现左心室射血分数下降的人数多于安慰剂组或干扰素-α组。 在胃肠间质瘤(GIST)的研究1的双盲期,舒尼替尼组和安慰剂组分别有22/209例(11%)患者和3/102例(3%)患者出现了治疗相关的左心室射血分数(LVEF)低于正常值下限(LLN)。 舒尼替尼组22例LVEF改变的患者中有9例未经处理自行恢复;5例患者经处理后恢复正常(1例患者减低剂量;4例患者另给予抗高血压药或利尿剂治疗); 6例患者结束研究但没有恢复情况的记录。此外,舒尼替尼组有3例(1%)患者出现3级左心室收缩功能下降至LVEF<40%,其中2例患者未接受研究药物进一步治疗即死亡。 安慰剂组无患者出现3级LVEF下降。在胃肠间质瘤(GIST)研究1的双盲期,两组各有1例患者(舒尼替尼组<1%;安慰剂组为1%)死于心力衰竭;两组各有2例患者(舒尼替尼组为1%;安慰剂组为2%)治疗后死于心脏骤停 1。
- 在既往未经治疗的晚期肾细胞癌(RCC)患者的研究中,舒尼替尼组和干扰素-a组分别有103/375例(27%)和54/360例(15%)的患者出现LVEF值低于正常值下限(LLN); 分别有26例(7%)和7例(2%)的患者出现LVEF值低于50%,且较基线值下降20%以上。舒尼替尼组4例(1%)患者出现左心室功能障碍,2例(<1%)患者诊断为充血性心衰(CHF) 1。
- 在胰腺神经内分泌瘤3期研究中,舒尼替尼组83例患者中有2例(2%)报告发生心脏衰竭且导致死亡,而安慰剂组患者无 1。
- 左室射血分数下降是左室功能不全的主要表现,舒尼替尼治疗mRCC患者的Ⅲ期临床研究中显示,其发生率为10%,但仅2%的患者为3度LVEF 12。
- 本品临床研究中排除了治疗前12个月内发生心脏事件的患者, 如心肌梗死(包括严重/不稳定性心绞痛)、冠状动脉/外周动脉旁路移植术、 有症状的充血性心力衰竭、脑血管意外或短暂性脑缺血发作或肺栓塞的患者。 某些研究还排除了既往接受过蒽环类药物或心脏放射治疗的患者。目前尚不能明确伴随上述症状的患者发展为左心室功能障碍的风险是否会增高 1。
- 考虑在基线时及治疗期间根据临床指征定期监测LVEF。仔细监测充血性心力衰竭患者的临床症状和体征。在出现充血性心力衰竭(CHF)临床表现的患者中停用本品。如果未获得基线射血分数,在无CHF临床证据的患者中,射血分数高于基线值20%但低于50%或低于正常值下限,则中断本品治疗和/或减少剂量 1。
胃肠道毒性
- 腹泻、恶心和呕吐是舒尼替尼治疗常见的不良事件。通常不需要减低剂量或中断治疗,给予合适的合并药物即可控制并逆转上述不良事件 6,7。
- 舒尼替尼治疗mRCC腹泻总发生率约为53%,3~4级腹泻仅为3%~5% 10,12。
- 恶心发生率为24%~44%,≥3级恶心发生率约为1%~3%,呕吐的发生率为16%~24%,≥3级呕吐发生率约为1%~4% 10,12。
口腔改变
- 口腔改变包括味觉改变、口干和口腔炎 1。
- 各临床症状的发生率差异较大,如口干的发生率约为6%~16%,口腔炎的发生率为13%~25% 10,12,17,18。
舒尼替尼用药指南旨在帮助您评估患者出现的不良反应的分级,并提供舒尼替尼说明书及医学文献中描述的处理策略。辉瑞公司无法对患者的治疗做出任何建议,应由医生根据特定患者的病史和临床状况做出临床判断,以采取合适的治疗措施。
▍剂量调整方案
不需要调整剂量 6。
▍处理措施
- 不需要特殊治疗 6。
- 不需要调整剂量。应事先告知患者和家属可能会出现的变化,减少对患者的心理冲击 6。
▍甲状腺功能减退分级及剂量调整方案 6,19
(点击下列分级按钮进行选择)
甲状腺功能减退分级:1级
定义
无临床症状;无需治疗
剂量调整方案
维持原剂量
甲状腺功能减退分级:2级
定义
有症状;不妨碍日常生活活动,需甲状腺替代治疗
剂量调整方案
维持原剂量
甲状腺功能减退分级:3级
定义
有症状;妨碍日常生活活动,需住院治疗
剂量调整方案
暂停服药,直至不良事件降低至1级以下或恢复至基线水平,随后减少12.5 mg重新开始治疗
甲状腺功能减退分级:4级
定义
危及生命,出现粘液性水肿昏迷
剂量调整方案
暂停服药,直至不良事件降低至1级以下或恢复至基线水平,随后减少12.5 mg重新开始治疗
▍处理措施
- 在开始舒尼替尼治疗前告知患者和家属可能会出现甲状腺功能减退 6。
- 在基线时对所有患者进行甲状腺功能检查(TSH/fT4/fT3) 6。
- 每个周期治疗开始前和治疗结束时进行甲状腺功能检查 6。
- 乏力等一般症状也可见于甲状腺功能减退早期,应引起警惕并注意鉴别 6。
- 对发生甲状腺功能减退的患者应给予甲状腺激素替代治疗,建议咨询内分泌科医生 6。
- 甲状腺激素替代治疗有效的患者无需调整舒尼替尼剂量 6。
▍疲乏分级及剂量调整方案 6,19
(点击下列分级按钮进行选择)
疲乏分级:1级
定义
超过基线的轻度乏力
剂量调整方案
维持原剂量
疲乏分级:2级
定义
部分日常生活受限
剂量调整方案
维持原剂量
疲乏分级:3级
定义
明显妨碍日常活动
剂量调整方案
暂停服药,直至不良事件降低至1级以下或恢复至基线水平,随后减少12.5 mg重新开始治疗
疲乏分级:4级
定义
危及生命
剂量调整方案
暂停服药,直至不良事件降低至1级以下或恢复至基线水平,随后减少12.5 mg重新开始治疗
▍处理措施
- 在治疗开始前应告知患者和家属可能出现乏力 4。舒尼替尼治疗期间患者应适当休息、摄入足够的营养和液体、短距离步行或轻体力劳动、放松身心、感觉乏力时勿开车或进行机械操作 7。
- 了解是否存在药物以外的导致乏力的原因,必要时进行实验室检查和给予治疗 7。
- 评估患者的甲状腺功能是否正常,是否需要进行正规治疗 4,7。通常不需要减少剂量 15。
- 在开始治疗的第1~3周期,常规监测患者乏力对生活质量的影响,鼓励患者在随后的周期中进行自我监测 4。
▍手足综合征分级及剂量调整方案 6,19
(点击下列分级按钮进行选择)
手足综合征分级:1级
定义
无痛性皮肤改变或皮炎(例如红斑)
剂量调整方案
维持原剂量
手足综合征分级:2级
定义
皮肤改变(例如脱屑、大水疱、出血、水肿)或疼痛,但无功能影响
剂量调整方案
剂量调整至原来的50%,持续7~28天。再次开始治疗时,以25 mg/d的低剂量开始。如果在低剂量治疗至少7天后HFS维持在0~1级,可将剂量上调至50 mg/d
手足综合征分级:3级
定义
溃疡性、湿性皮炎或伴随疼痛的皮肤改变;对患者日常生活造成严重干扰
剂量调整方案
中断治疗直至症状改善至0~1级。再次开始治疗时剂量减少12.5 mg
▍处理措施
- 对于1级手足综合征患者,维持当前剂量,监测严重程度是否发生改变 6。避免接触热水,使用保湿性的乳霜以减轻症状,穿着较厚的棉质手套及(或)袜子,穿软底鞋,防止足部受压,勿长时间站立。使用硫酸镁湿热敷或浸泡,尿素软管或芦荟汁涂于患处,每日2~3次 7,20,21。2周后评估症状,如进一步恶化,则往下一步 6,7。
- 对于2级手足综合征患者,将剂量调整至原来的50%,持续7~28天。再次开始治疗时,以25mg/d 低剂量开始(周期仍为服药4周、停药2周) 6。如果在低剂量治疗至少7天后HFS维持在0~1级,可将剂量上调至50mg/d。添加下列药物以治疗1级毒性反应;0.05%氯倍他索软膏,2%利多卡因、可待因或普瑞巴林镇痛 15。2周后评估症状。如恶化,则往下一步 6,7。
- 对于3级手足综合征患者,应中断治疗直至症状改善至0~1级;再次开始治疗时,将剂量减少12.5mg 6。对症处理方法参见1级和2级。可局部涂抹角质溶解软膏,减轻过度角化,或将这些皮肤尽量暴露在空气中,有利于症状的预防和缓解 21。
▍注意与过敏进行鉴别
- 基本治疗:含有5% ~ 10%尿素成分的护肤液 7,8。
- 抗炎治疗:甾体类药物,若有瘙痒则可用抗组胺药 20。
- 一般建议:若症状严重,则建议咨询皮肤科医生 4,8。
- 如发生严重皮疹可能需要中断治疗,可能需要口服皮质激素来治疗 15。
▍高血压分级及剂量调整方案 6,19
(点击下列分级按钮进行选择)
高血压分级:1级
定义
无症状的一过性(<24h)血压升高>20mmHg(舒张压),或>150/100mmHg,无需处理
剂量调整方案
维持原剂量
高血压分级:2级
定义
舒张压升高超过20 mmHg,或血压>150/100 mmHg而之前血压正常;重复出现,或持续(>24h),或伴有症状;需要单药抗高血压治疗
剂量调整方案
维持原剂量
高血压分级:3级
定义
需要使用不止一种降压药物,或需要比之前更强的降压治疗
剂量调整方案
暂停服药,直至不良事件降低至1级以下或恢复至基线水平,随后减少12.5 mg重新开始治疗
高血压分级:4级
定义
危及生命(如高血压危象)
剂量调整方案
暂停服药,直至不良事件降低至1级以下或恢复至基线水平,随后减少12.5 mg重新开始治疗
▍处理措施
◆ 非药物治疗
- 基线血压监测 6。
- 有高血压史者应密切监测血压变化,接受治疗前的一周每日测血压(为必要时调整或增加降压药物) 6,7。
- 治疗期间常规监测血压 6。
- 建议患者在家中自行监测血压 6。
◆ 药物治疗
- 治疗期间目标血压控制在140/90mmHg以下 7。
- 治疗期间若收缩压>200mmHg或舒张压>110mmHg时应立即停药 7。
- 降压治疗最好选用ACE抑制剂(如卡托普利、依那普利、贝那普利及西拉普利等) 22。
- 应尽量避免应用抑制CYP3A4代谢通路的钙离子拮抗剂(如地尔琉卓、维拉帕米、尼群地平、硝苯地平等)治疗舒尼替尼引起的高血压,以免与舒尼替尼产生药物间的相互作用 22。苯磺酸氨氯地平虽然为钙离子拮抗剂,可以与舒尼替尼同时使用 22。
- 严重病例需暂停舒尼替尼治疗直至血压恢复正常 6。
▍分级及剂量调整方案 6,19,23
(点击下列分级按钮进行选择)
中性粒细胞减少分级:1级
定义
<LLN–1.5x10 9/L
剂量调整方案
维持原剂量
中性粒细胞减少分级:2级
定义
<1.5–1.0x10 9/L
剂量调整方案
维持原剂量
中性粒细胞减少分级:3级
定义
<1.0–0.5x10 9/L
剂量调整方案
暂停服药,直至不良事件降低至2级以下或恢复至基线水平,随后原剂量重新开始治疗
中性粒细胞减少分级:4级
定义
<0.5x10 9/L
剂量调整方案
暂停服药,直至不良事件降低至2级以下或恢复至基线水平 ,随后减少12.5mg重新开始治疗。
血小板减少分级:1级
定义
<LLN–75.0x10 9/L
剂量调整方案
维持原剂量
血小板减少分级:2级
定义
<75.0–50.0x10 9/L
剂量调整方案
维持原剂量
血小板减少分级:3级
定义
<50.0–25.0x10 9/L
剂量调整方案
暂停服药,直至不良事件降低至2级以下或恢复至基线水平,随后原剂量重新开始治疗
血小板减少分级:4级
定义
<25.0x10 9/L
剂量调整方案
暂停服药,直至不良事件降低至2级以下或恢复至基线水平 ,随后减少12.5mg重新开始治疗。
<LLN -100 g/L
贫血分级:1级
定义
Hgb<LLN-6.2mmol/L; <LLN -100 g/L
剂量调整方案
维持原剂量
<100 - 80g/L
贫血分级:2级
定义
Hgb<6.2-4.9mmol/L; <100 - 80g/L
剂量调整方案
维持原剂量
需要输血
贫血分级:3级
定义
Hgb <4.9 mmol/L; <80 g/L; 需要输血
剂量调整方案
暂停服药,直至不良事件降低至2级以下或恢复至基线水平,随后原剂量重新开始治疗
贫血分级:4级
定义
危及生命,需要立即干预
剂量调整方案
暂停服药,直至不良事件降低至2级以下或恢复至基线水平 ,随后减少12.5mg重新开始治疗。
▍处理措施
◆ 中性粒细胞减少
治疗中应注意检测和报告感染征象(如体温>38摄氏度) 7。3级中性粒细胞减少无需减少舒尼替尼用量 6。3级或4级伴发热或感染应停药直至中性粒细胞减少恢复至2级以下或基线水平,随后用药剂量减少12.5mg后重新开始治疗 6。若白细胞减少2级及以上给予升白药物皮上注射,每日一次,至白细胞升至正常为止 20。
◆ 血小板减少
如出现3级血小板减少,应停药直至血小板减少恢复至2级以下或基线水平 6。如再次出现3级血小板减少,用药剂量减去12.5mg 7。常规升血小板治疗至血小板恢复正常为止 20。
◆ 贫血
患者出现头晕眼花、气短或其他贫血症状时应予以重视。需排除甲状腺功能减退可能。必要时给予维生素B12、铁剂支持治疗 4。3级贫血患者应暂停用药,直至恢复至2级以下或基线水平,然后以同样剂量水平重新开始治疗 6。如再次出现3级贫血,用药剂量减去12.5mg;对症改善贫血支持治疗 7。
◆ 需要抗凝治疗的患者
舒尼替尼禁用于服用治疗剂量华法林的患者 6。
舒尼替尼治疗期间,如需抗凝治疗可选用低分子肝素 6。
▍左心室收缩功能不全分级及剂量调整方案 6,7,19
(点击下列分级按钮进行选择)
左心室收缩功能不全分级:1级
定义
静息时射血分数(ejection fraction, EF)<60-50%,短轴缩短率(SF)<30~24%
剂量调整方案
维持原剂量
左心室收缩功能不全分级:2级
定义
静息时EF<50~ 40%;SF <24~15%
剂量调整方案
维持原给药剂量继续治疗,除非发生下列情况:
- LVEF无症状下降20%,或降至正常低限以下
- 需要干预的发作性心室节律异常(非紧急事件)
暂停给药直至毒性降至1级以下,随后减少12.5 mg继续治疗
左心室收缩功能不全分级:3级
定义
出现充血性心力衰竭 (CHF) 症状,且对干预治疗有应答; 静息EF <40~20%,SF <15%
剂量调整方案
暂停服药,直至不良事件降低至1级以下或恢复至基线水平,随后减少12.5 mg重新开始治疗。如出现充血性心力衰竭症状立即停药
左心室收缩功能不全分级:4级
定义
难治性或控制较差的CHF; EF <20%;需安装心室辅助装置、外科心室减容术或心脏移植干预
剂量调整方案
终止给药
▍处理措施
- 考虑在基线时及治疗期间根据临床指征定期监测LVEF。仔细监测充血性心力衰竭患者的临床症状和体征。在出现充血性心力衰竭(CHF)临床表现的患者中停用本品。如果未获得基线射血分数,在无CHF临床证据的患者中,射血分数高于基线值20%但低于50%或低于正常值下限,则中断本品治疗和/或减少剂量。舒尼替尼对QT间期延长存在剂量依赖效应,可导致室性心律失常 1,6。
- 有QT间期延长病史、服用抗心律失常药物、既往有心脏病、心动过缓和电解质异常的患者,应定期进行ECG检查和检测血钾、血镁 1,6。
- 当舒尼替尼与CYP3A4强抑制剂或已知延长QT间期的药物合用时,应更频繁地监测QT间期。应考虑减少本品剂量 1。
- 若出现充血性心力衰竭(CHF)的临床表现,应停止使用舒尼替尼 7。
- 无充血性心力衰竭临床证据但射血分数>20%且<50%基线值或者低于正常下限(如果未获得基线射血分数)的患者也应中断舒尼替尼治疗和/或减低剂量 7。
▍分级及剂量调整方案 6,19
(点击下列分级按钮进行选择)
腹泻分级:1级
定义
与基线相比,每日排便次数增加<4次,肠道造瘘排出量轻度增加
剂量调整方案
维持原剂量
腹泻分级:2级
定义
与基线相比,每日排便次数增加4~6次;静脉补液<24h;肠道造瘘排出量中度增加,不影响日常活动
剂量调整方案
维持原剂量
腹泻分级:3级
定义
每日排便次数比基线增加≥7次;静脉补液≥24h;需住院;肠道造瘘排出量显著增加;影响日常活动
剂量调整方案
暂停服药,考虑减量;必要时静脉补液
腹泻分级:4级
定义
危及生命
剂量调整方案
暂停服药,考虑减量;必要时静脉补液
恶心分级:1级
定义
食欲下降,而饮食习惯无改变
剂量调整方案
维持原剂量
恶心分级:2级
定义
摄入量减少,体重无明显下降,无脱水或营养不良;静脉补液时间<24小时
剂量调整方案
维持原剂量
恶心分级:3级
定义
营养不良或脱水;静脉营养、补液时间≥24小时
剂量调整方案
停药,症状控制不佳时考虑减量12.5 mg
恶心分级:4级
定义
危及生命
剂量调整方案
停药,症状控制不佳时考虑减量12.5 mg
呕吐分级:1级
定义
24内发生1次
剂量调整方案
维持原剂量
呕吐分级:2级
定义
24小时内发生2-5次;静脉补液时间<24小时
剂量调整方案
维持原剂量
呕吐分级:3级
定义
24小时内发生≥6次;静脉营养、补液时间≥24小时
剂量调整方案
停药,症状控制不佳时考虑减量12.5 mg
呕吐分级:4级
定义
危及生命
剂量调整方案
停药,症状控制不佳时考虑减量12.5 mg
▍处理措施
◆ 腹泻
- 少量多餐,规律进食 7
- 规律应用少量液体预防脱水 7
- 避免辛辣、刺激、油炸食物 7
- 重视排便次数改变症状 15,20
- 避免餐时和餐后1小时饮水 7
- 增加米饭和香蕉 15
- 如可能为乳糖不耐受,尝试饮用豆奶或低乳糖牛奶 24
- 对于1/2级腹泻患者,通常不需要减少剂量或中断治疗。给予口服补液以预防脱水。根据病情给予止泻药(如洛哌丁胺)止泻。嘱患者减少或停用大便软化剂或润滑剂 6,7
- 对于3/4级腹泻患者,中断治疗直至降低至1级以下或恢复至基线水平。腹泻通常可于2周治疗间期迅速缓解。如发生3~4级腹泻,下一个治疗周期中舒尼替尼的给药剂量应减少12.5mg 6,7
◆ 恶心、呕吐
如果预期会出现恶心或呕吐,可以在服用本品前预防性服用抗吐药,以限制与治疗相关的恶心和呕吐 7
▍粘膜炎/口腔炎分级及剂量调整方案 6,19
(点击下列分级按钮进行选择)
粘膜炎/口腔炎分级:1级
定义
粘膜红斑
剂量调整方案
维持原剂量
粘膜炎/口腔炎分级:2级
定义
斑块状溃疡或假膜
剂量调整方案
维持原剂量
粘膜炎/口腔炎分级:3级
定义
溃疡或假膜融合,轻微损伤即导致出血
剂量调整方案
暂停服药,直至不良事件降低至1级以下或恢复至基线水平,随后减少12.5 mg重新开始治疗
粘膜炎/口腔炎分级:4级
定义
组织坏死,明显自发性出血,危及生命
剂量调整方案
暂停服药,直至不良事件降低至1级以下或恢复至基线水平,随后减少12.5 mg重新开始治疗
▍处理措施
- 一般不需要调整剂量或停药 7。
- 如发生溃疡,暂停2~3天治疗有利于愈合 4。
- 针对口腔溃疡和口角炎进行缓解治疗(漱口水、止痛剂及支持疗法) 4。
舒尼替尼用药指南旨在帮助您评估患者出现的不良反应的分级,并提供舒尼替尼说明书及医学文献中描述的处理策略。辉瑞公司无法对患者的治疗做出任何建议,应由医生根据特定患者的病史和临床状况做出临床判断,以采取合适的治疗措施。
针对如下常见不良反应,患者的应对措施:
- 教育患者认识HFS,以便早期发现早期处理 6。
- 告知患者HFS缓解后不会造成永久性并发症 6。
- 建议患者在治疗前将指甲/趾甲剪除并除去先前存在的任何过度角化部位或老茧 6。
- 避免穿过紧的鞋子 7。
- 避免进行可能摩擦手足的重体力运动 7。
- 避免佩戴手饰 7。
- 避免剪去水泡,应咨询皮肤科医生 7。
- 穿着宽松的棉质服装 7。
- 短距离步行或做轻体力活 7。
- 温水清洁手足(避免用热水),动作轻柔,然后轻轻拍干 7。
- 外出时使用SPF指数30以上的防晒霜 7。
- 告知患者可能会出现皮肤毒性,以及皮肤毒性不良反应的症状和表现 6,15。
- 减少皮肤与化学品的接触,使用无除臭剂或香料的肥皂 15。
- 使用淋浴啫喱代替肥皂洗澡 15。
- 选择有止痒成分的润肤露 15。
- 多用润肤露涂抹手脚 15。
- 穿着宽松 7。
- 避免直接日晒 7。
- 事先告知患者可能会出现的变化及原理,减少对其的心理冲击 15。
- 告知患者皮肤或毛发颜色改变在停药期间有可能恢复正常 15。
- 告知患者舒尼替尼治疗过程中血压可能会升高,嘱患者定期监测血压并记录 7,15。
- 高血压症状包括头痛、头晕眼花、心悸及晕厥等。也可能没有症状 7,15。
- 服用舒尼替尼期间,患者应告知医生同时伴随使用的其他药物 7,15。
- 因其他药物可能也有血压升高的不良反应,血压升高可能是因为伴随用药引起,如临床常用的保肝药物复方甘草酸苷注射液 22。
- 嘱患者服药期间注意休息 7,15。
- 摄入足够的营养和足量液体 7。
- 短距离步行或做轻体力活 7。
- 通过听音乐或阅读等方式放松身心 7。
- 感觉乏力时勿开车或进行机械操作 7。
- 非发热性中性粒细胞减少患者:应保持良好的个人卫生习惯,并遵循膳食指导 4。中性粒细胞减少期间,加强护理;减少会客,减少感染机会 20。
- 血小板减少患者:应注意避免剧烈咳嗽和牵拉肠道的运动以降低出血风险 4,21。
- 贫血患者:应最大限度地减少感染的机会,包括便后洗手、避免与患病的人相处。避免擦伤、割伤或烧伤。清理鼻腔需轻柔。如有便秘,需及时治疗。使用柔软的牙刷刷牙,避免刺激牙龈,保持良好的口腔卫生很重要。对于轻微的疼痛,建议服用扑热息痛。避免使用阿司匹林、布洛芬或其他非甾体抗炎药 7。
腹泻
- 在治疗开始前咨询营养师 4。
- 重视排便次数改变的症状 15,20。
- 有规律少量饮水以预防脱水 7。
- 少量多餐,规律进食 7。
- 避免在餐时和餐后1小时内饮水 7。
- 避免食用刺激性或油炸食物、含咖啡因食物以及高纤维食物 7。
- 可在餐点中加入米饭及香蕉 15。
- 告知患者一些人的腹泻是由于对牛奶中的乳糖不耐受所致,如患者认为牛奶可能是问题的来源,建议他们尝试饮用豆奶或低乳糖牛奶 24。
恶心、呕吐
- 少量多餐,规律饮用少量液体预防脱水 7。
- 减慢饮食速度,细嚼慢咽 7。
- 尝试食用小点心,如饼干或面包片 7。
- 避免辛辣、过甜、油炸或过油的食物 7。
- 避免有强烈气味或烹调时会产生气味的食物 15。
- 同时应用抗多巴胺能止吐药或5HT3拮抗剂时应谨慎,这些药物与QT/QTc间隔延长或尖端扭转型室速有关 7。
- 不要进食刺激性食物 7。
- 治疗前告知患者可能会发生口腔炎 4。
- 治疗期间使用儿童牙刷 4。
- 使用不含酒精的漱口液漱口,保持口腔清洁 4。
- 不要使用含有漂白剂(如过氧化氢)的牙膏 7。
- 饭后及睡前用细毛牙刷刷牙;如果牙龈出血,应当用纱布代替牙刷,用苏打水代替牙膏,并用吸管饮用液体 7。
口腔改变——针对味觉及食欲改变
- 鼓励患者多食用自已喜欢的食物 21。
- 清淡,易消化食物为宜,忌辛辣食物,以免引起口腔炎,加重口腔疼痛 21。
- 勤漱口,注意口腔卫生 21。
- 必要时使用镇痛药物 21。
- 告知患者停药后口腔症状会自行缓解 21。
1.索坦®说明书.
2.Faivre S, et al. Safety, pharmacokinetic, and antitumor activity of SU11248, a novel oral multitarget tyrosine kinase inhibitor, in patients with cancer. J Clin Onco. 2006;24(1):25-35.
3.Schoeffski P, et al. Sunitinib-related thyroid dysfunction: A single-center retrospective and prospective evaluation. J Clin Onco. 2006;24(Suppl 20):3029.
4.Nēgrier S, et al. Optimisation of sunitinib therapy in metastatic renal cell carcinoma: adverse-event management. EJC 2007;suppl 5:12-19.
5.Bellmunt Joaquim. The Oncologist’s View: Targeted Therapies in Advanced Renal Cell Carcinoma. Eau Urology. 2008;suppl 7:55-62.
6.Desai Jayesh, et al. Sunitinib malate in the treatment of renal cell carcinoma and gastrointestinal stromal tumor: Recommendations for patient management*. Asia-Pacific J Clin Onco 2007;3:167-176.
7.Kollmannsberger C, et al. Sunitinib therapy for metastatic renal cell carcinoma: recommendations for management of side effects. Can Urol Assoc J. 2007 Jun;1(2 Suppl):S41-54.
8.Grünwald V, et al. Management of sunitinib-related adverse events: an evidence- and expert-based consensus approach. World J Urol. 2010 Jun;28(3):343-351.
9.Hershman JM, et al. How does sunitinib cause hypothyroidism?. Thyroid 2010;20(3):243-244.
10.Demetri GD, et al. Efficacy and safety of sunitinib in patients with advanced gastrointestinal stromal tumour after failure of imatinib: a randomised controlled trial. Lancet 2006;368(9544):1329-38.
11.Desal J, et al. Hypothyroidism after sunitinib treatment for patients with gastrointestinal stromal tumors. Ann Intern Med. 2006;145(9):660-664.
12.Motzer RJ, et al. Sunitinib versus interferon alfa in metastatic renal-cell carcinoma. N Engl J Med 2007:356(2):115-24.
13.施国海等. 索坦治疗晚期肾癌的毒副反应及防治措施. 现代泌尿生殖肿瘤杂志. 2009;1(6):334-337.
14.Michaelson MD, et al. 2011 Genitourinary Cancers Symposium. Abstract 320.
15.Wood L S. Managing the side effects of sorafenib and sunitinib. Commun Oncol 2006;3:558-562.
16.Rini BI, et al. Hypertension as a biomarker of efficacy in patients with metastatic renal cell carcinoma treated with sunitinib. J Natl Cancer Inst.2011;103;763-7732.
17.Motzer RJ, et al. Sunitinib in patients with metastatic renal cell carcinoma. JAMA. 2006;295(21):2516-2524.
18.Motzer RJ, et al. Activity of SU11248, a multitargeted inhibitor of vascular endothelial growth factor receptor and platelet-derived growth factor receptor, in patients with metastatic renal cell carcinoma. J Clin Oncol. 24(1):16-24.
19.U.S.DEPARTMENT OF HEALTH AND HUMAN SERVICES. Common Terminology Criteria for Adverse Events v3.0 (CTCAE).
20.何鹏等, 苹果酸舒尼替尼治疗晚期肾癌不良反应的观察及护理. 现代泌尿生殖肿瘤杂志. 2011;3(1):39-41.
21.豆艳等, 苹果酸舒尼替尼治疗晚期肾细胞癌不良反应的护理. 中国实用神经疾病杂志. 2011;14(6):53-54.
22.王伟兰等, 临床药师对1例服用分子靶向药物舒尼替尼的肿瘤患者的药学监护. 中国药物应用与检测. 2009;6(3):181-183.
23.U.S.DEPARTMENT OF HEALTH AND HUMAN SERVICES. Common Terminology Criteria for Adverse Events v4.0 (CTCAE).
24.侯安存. 乳糖不耐受的诊治进展. 临床和实验医学杂志. 2017;16(2):204-207.


