
研究背景
HER2是乳腺癌和其他瘤种中的一个关键致癌基因,同时也是被广泛认可的治疗靶点。过去20年,抗HER2治疗(如曲妥珠单抗等)革命性地改变了HER2过表达转移性乳腺癌(MBC)的治疗。目前,HER2过表达乳腺癌的中位总生存期(OS)已经提高到5年左右。
尽管治疗方案有了显著改进,但抗HER2治疗的获益仅限于HER2过表达的特定肿瘤群体(IHC3+或ISH+)。传统的抗HER2靶向治疗并没有在HER2 0表达及HER2低表达(IHC1+或IHC2+/ISH-)的乳腺癌中取得类似的成功。
近年来,几种新的HER2靶向抗体偶联药物(ADC)在HER2低表达乳腺癌的早期临床试验中显示出有希望的抗肿瘤活性。DESTINY-Breast04研究随后证实T-DXd是既往经治HER2低表达乳腺癌的治疗新标准,其在无进展生存期(PFS)和OS方面均有显著改善。
尽管HER2低表达肿瘤受到的关注日益增加,但HER2低表达MBC的临床结局仍缺乏高质量证据。一些单中心或区域性观察性研究得出了相互矛盾的结果,这些研究仅包括一部分MBC患者。因此,本研究设计了基于2010-2017年美国国家癌症数据库(NCDB)的回顾性队列研究,旨在比较总体HER2低表达和HER2 0表达新发MBC接受全身治疗后的存活率。
研究方法
共确定43,154名在2010年1月1日至2017年12月31日新诊断的乳腺癌女性。如果患者具有完整的年龄、生存状况、TNM分期、激素受体状态(ER+或PR+)、HER2表达水平(IHC评分,如果是IHC2+则包括ISH状态)和接受系统治疗(包括化疗或内分泌治疗)的信息,则纳入研究。如果患者的肿瘤为HER2− IHC3+、IHC2+/ISH阳性或未确定或者其生存状况缺失,则被排除在外(图1)。
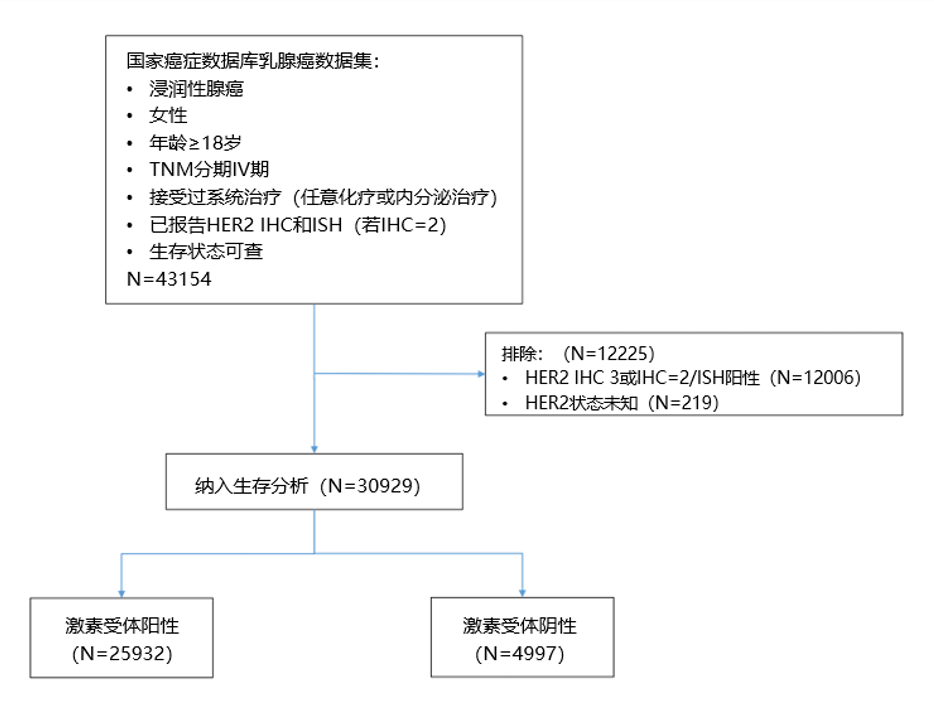
图1. 研究设计(NCDB国家癌症数据库)
研究结果
患者特征
共30,929名女性乳腺癌患者满足入组标准并纳入最终分析,其中10293名(33.3%)HER2 0表达,20,636名(66.7%)HER2低表达。根据激素受体状态分层后,有18,066名HER2低表达HR+/HER2-患者,2,570名HER2低表达HR-/HER2-患者。在不同种族中HER2低表达流行率非常相似,西班牙裔人群的发病率略低(图2)。本研究中位随访38.2个月(IQR:25.5个月,58.2个月),不同HER2表达状态患者的基线特征如表1所示。
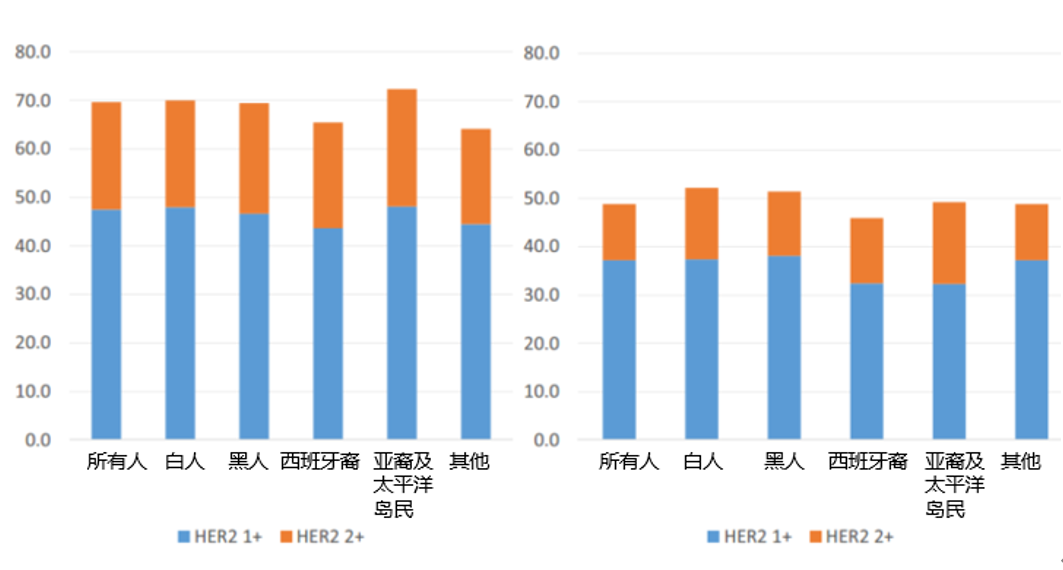
图2. HER2低表达乳腺癌的流行率(根据种族和肿瘤激素受体状态分组)
A(左图):激素受体阳性,P<0.001。B(右图):激素受体阴性,P=0.27。采用卡方检验比较不同种族HER2低表达乳腺癌的流行率。
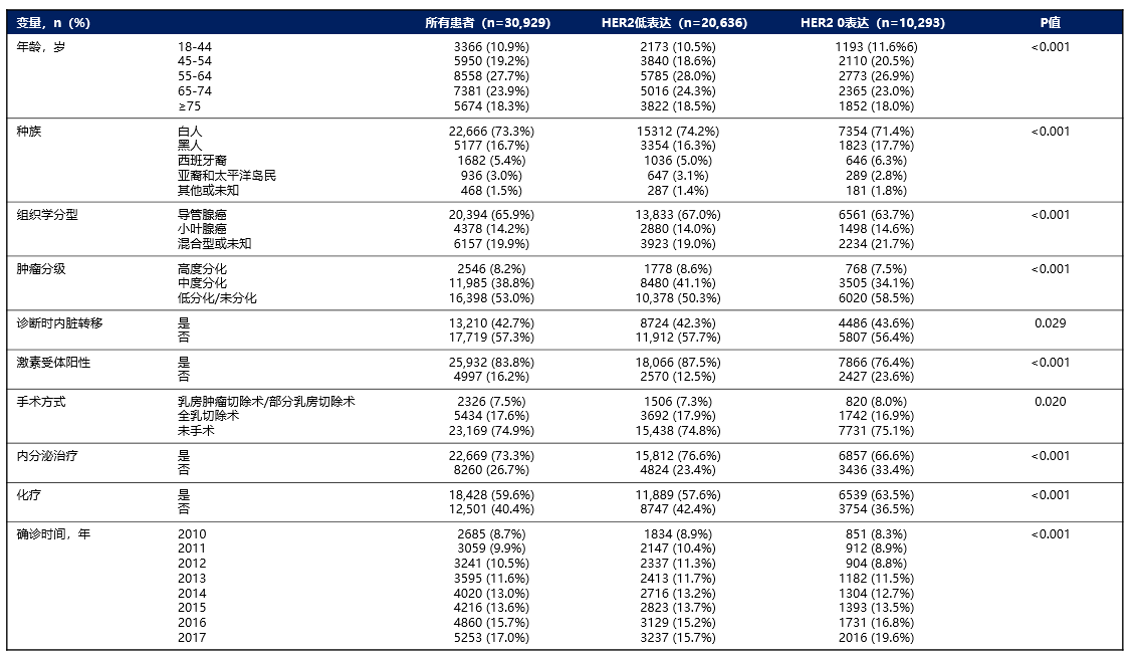
表1. 患者特征
生存结局
中位随访38.2个月后,HER2低表达乳腺癌患者较HER2 0表达患者显示出更长的中位OS(37.1个月 vs 31.7个月,P<0.001),尤其是HER2 2+/ISH阴性患者较HER2 1+和HER2 0表达患者OS更长(39.1个月 vs 36.0个月 vs 31.7个月,P<0.001)(图3)。
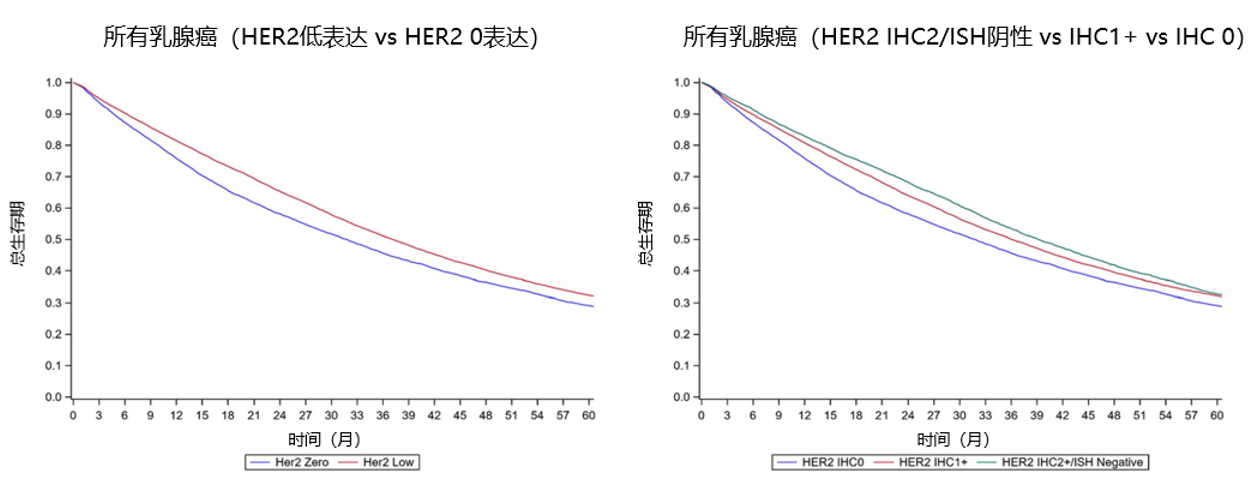
图3. 不同HER2表达水平患者的生存曲线
A(左图):所有乳腺癌(HER2低表达 vs HER2 0表达),P<0.001;B(右图):所有乳腺癌(HER2 IHC2/ISH阴性 vs IHC1+ vs IHC 0),P<0.001。采用Log-rank检验比较不同HER2表达患者的生存率。
亚组分析显示,HR+和HR-亚组显示出相似的OS结局,如图4A所示,HR+亚组HER2低表达和HER2 0表达OS分别为40.9个月 vs 39.2个月,P=0.003; HR-亚组HER2低表达和HER2 0表达OS分别为16.0个月 vs 14.1个月,P=0.007。在白人和非白人患者中, HER2低表达肿瘤均显示出生存优势;如图4B所示,在白人亚组中,HER2低表达和HER2 0表达OS分别为38.4个月 vs 33.3个月,P<0.001;非白人亚组中,HER2低表达和HER2 0表达OS分别为32.8个月 vs 27.5个月,P<0.001。然而,HER2低表达肿瘤的生存优势存在于接受一线化疗(HER2低表达:36.7个月 vs HER2 0表达:28.4个月,P<0.001)而非仅接受内分泌治疗的患者(HER2低表达:37.5个月 vs HER2 0表达:36.5个月,P=0.43)(图4C)。
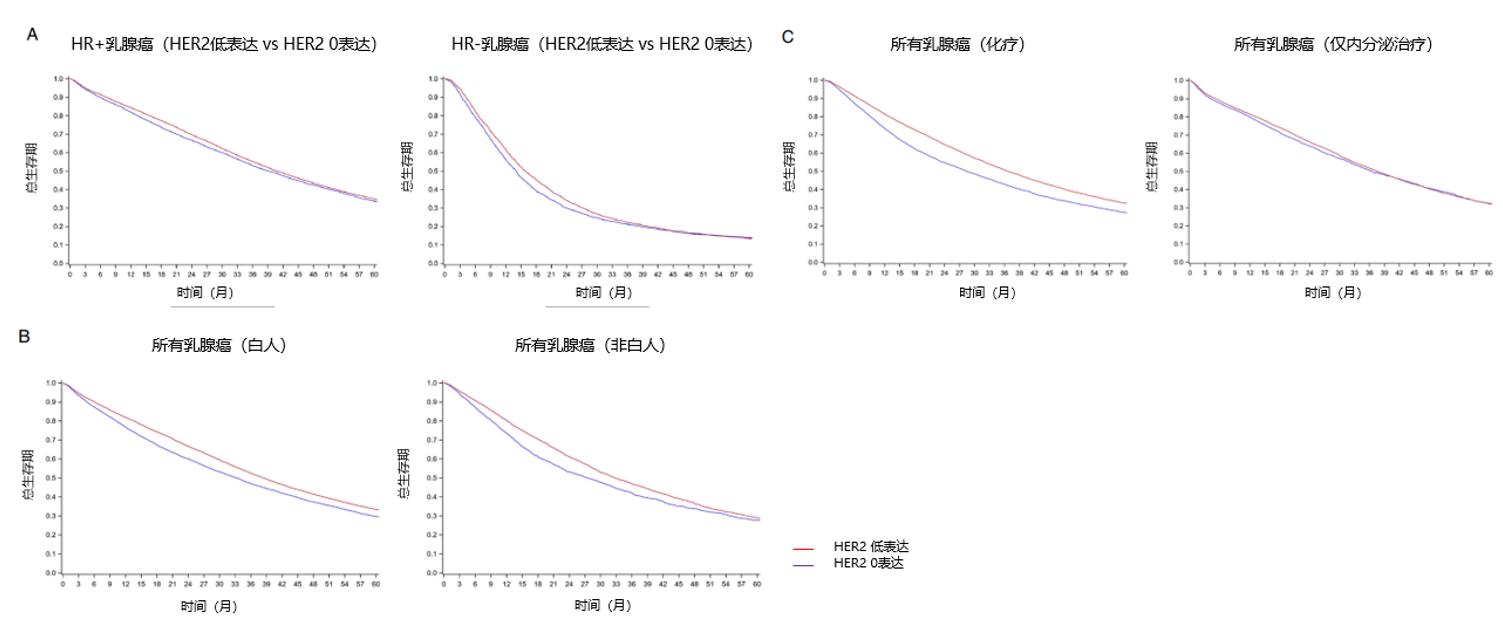
图4. 不同HER2表达水平与社会临床因素患者的生存曲线
A 按激素受体状态分类:左图为HR+乳腺癌(HER2低表达 vs HER2 0表达),P=0.003;右图为HR-乳腺癌(HER2低表达 vs HER2 0表达),P=0.007。B 按患者种族分类:左图为HR+乳腺癌(白人),P<0.001;右图为HR-乳腺癌(非白人),P<0.001。C 按治疗类型分类:左图为接受化疗的所有乳腺癌,P<0.001;右图为仅接受内分泌治疗的所有乳腺癌,P=0.43。采用Log-rank检验比较不同HER2表达患者的生存率。
多因素生存分析
在调整协变量后,HER2低表达肿瘤仍与更长的OS相关(HR=0.95,95% CI: 0.92-0.98,P<0.001)。在HR阳性(HR=0.95,95% CI: 0.91-0.98,P=0.002)和HR阴性(HR=0.92,95% CI: 0.86-0.98,P=0.01)亚组中观察到类似的相关性。此外,与HER2 1+乳腺癌相比,HER2 2+/ISH阴性乳腺癌具有较小但显著的生存优势(HR=0.95,95% CI: 0.92-0.99,P=0.01)。
进一步的亚组分析显示,HER2低表达肿瘤的生存优势与年龄(<55岁:HR=1.03 vs ≥55岁:HR=0.92,P =0.01)、种族(白人:HR=0.92 vs 非白人:HR=1.00,P <0.01)、接受化疗(化疗:HR=0.92 vs 仅接受内分泌治疗:HR=0.99,P =0.04)显著相关。这种优势与其他社会人口学和临床因素无关(P >0.05)(图5A)。在HR阳性人群中,HER2低表达肿瘤的生存优势在导管腺癌(P <0.01)和接受任何化疗(P =0.02)的女性患者中更显著(图5B)。在HR阴性人群中,该优势在白人(P =0.01)和≥55岁(P <0.01)患者中更显著(图5C)。

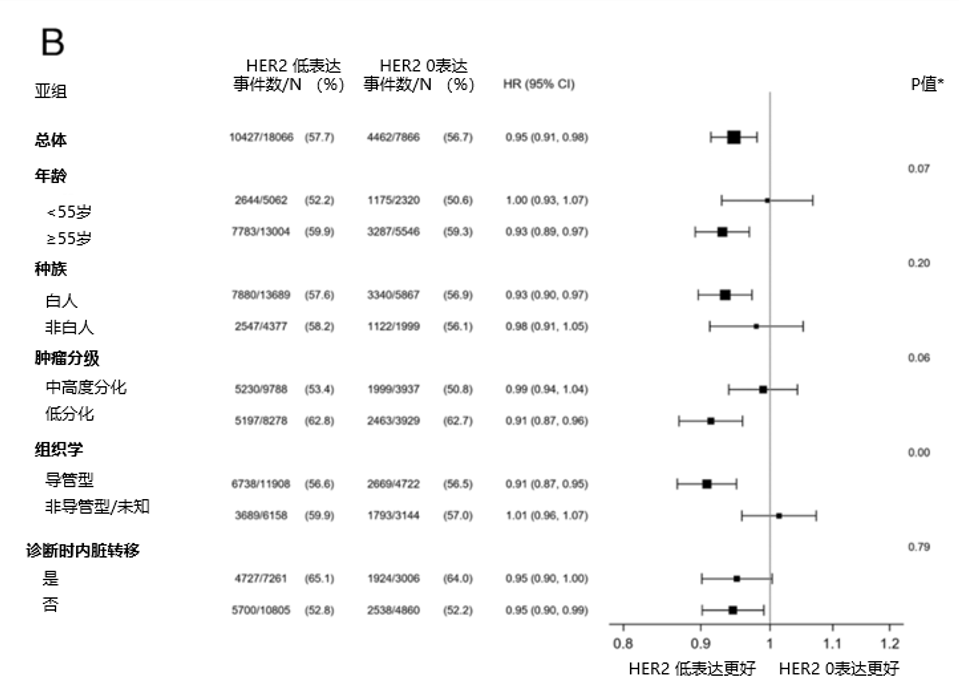
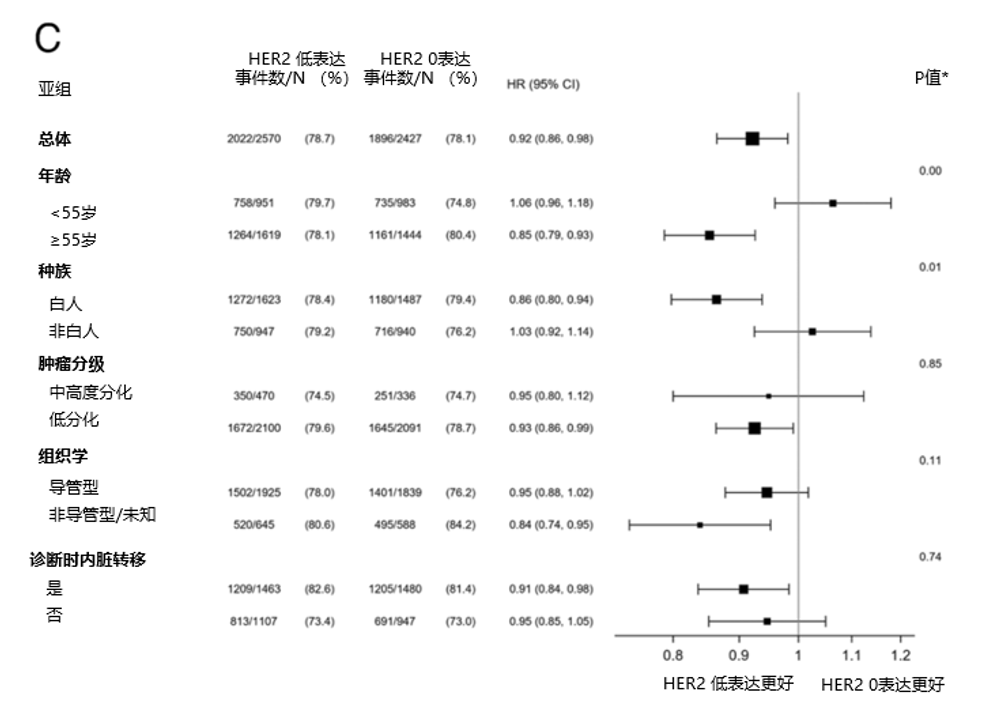
图5. 总生存多变量Cox回归分析中调整的风险比(HER2低表达 vs HER2 0表达)
A 所有乳腺癌;B HR+乳腺癌;C HR-乳腺癌。基于多变量Cox回归,计算HER2表达水平与各亚组间的相互作用P值。误差线表示HER2低表达与HER2 0表达乳腺癌OS风险比的置信区间。
结论
该研究发现,近70%的HR+/HER2- MBC和50%的HR-/HER2- MBC患者为HER2低表达,不同种族间存在微小差异。HER2低表达乳腺癌的OS优于HER2 0表达患者,且OS获益不依赖于激素受体状态。生存优势主要在一线接受化疗的患者中观察到。
参考文献
1. Jiang C, Perimbeti S, Deng L, et al. Clinical outcomes of de novo metastatic HER2-low breast cancer: a National Cancer Database Analysis[J]. npj Breast Cancer, 2022, 8(1): 135.
GRACE审批号:DOC-0105479,有效期至2025-3-5
GCMA审批号:PP-UNP-CHN-0347 到期日:2025-3-5


