
前言
内分泌治疗 (ET)和化疗 (CT)被用于激素受体阳性 (HR+)、人表皮生长因子受体2阴性(HER2-)转移性乳腺癌 (MBC)患者的全身性治疗,但何种治疗选择能够取得更优的无进展生存期 (PFS)和总体生存期 (OS)获益尚未可知。本项真实世界研究利用中国临床肿瘤学会乳腺癌 (CSCO BC)数据库,对ET和CT一线治疗HR+/HER2- MBC中国患者的疗效和临床结局进行评估。
方法
研究设计与入组患者
患者信息来源于CSCO BC数据库中记录的1996年1月1日至2018年9月30日之间的确诊患者。主要入组标准为雌激素受体(ER)和/或孕激素受体(PR)表达≥10%且HER2表达阴性,接受一线全身性治疗。排除标准为一线治疗数据缺乏,局部复发或转移经手术或放疗切除。
数据收集
生存数据来自医疗记录和对患者或其家属的电话随访。初始治疗是指首次诊断为转移性疾病后采取的治疗,维持治疗是指在初始治疗≥3个月后无疾病进展时采取的治疗。无疾病进展的临床状态包括完全缓解 (CR)和部分缓解 (PR)和疾病稳定 (SD)。远端无复发间隔 (DRFI)定义为从诊断至远端部位复发的时间,既往(新)辅助ET无病间隔定义为(新)辅助ET结束至复发的时间。(新)辅助ET进展定义为(新)辅助ET期间或既往(新)辅助无病间隔≤12个月。
评估
- 主要终点:初始一线治疗为CT和ET的患者PFS (初始CT组和初始ET组)。PFS为起始一线治疗至任何原因导致疾病进展或死亡首次发生的时间。
- 次要终点:初始CT疗法和初始ET疗法 (不包括维持治疗疗法)的客观缓解率 (ORR)和临床获益率 (CBR),影响患者从初始CT和初始ET治疗中达到PFS和OS获益的相关因素,基于四种初始一线治疗方案 (紫杉烷依赖治疗,非紫杉烷依赖化疗,ET和ET+靶向药物)的 PFS和OS、基于三种治疗模式 (CT组:初始CT治疗后序贯CT维持治疗;CT-ET组:初始CT治疗后转换ET维持治疗;ET组:初始ET治疗后序贯ET维持治疗)的PFS和OS。OS定义为起始一线治疗至任何原因引起死亡的时间。
统计分析
分类变量组间差异比较采用卡方检验。Kaplan-Meier方法用于评估中位PFS和OS;采用单因素和多因素Cox回归估计风险比 (HR)和相应的95%置信区间 (CIs)。组间生存分析采用对数秩检验。以基线特征和潜在预后因素分析亚组PFS和OS。
为了评估一线治疗选择对临床结局的影响,采用多变量Cox回归和倾向评分匹配来平衡基线时患者组间的复杂因素。SAS 9.4进行数据的统计分析, p<0.05视为存在统计学差异。
结果
患者基线特征
本研究纳入1877例HR+/HER2- MBC患者,中位随访时间36.0个月 (范围: 12.0-220.0)。CT一线治疗1215例 (64.7%),ET一线治疗662例 (35.3%) (图1)。初次诊断为MBC的中位年龄为48岁,最常见转移部位为骨 (52.9%,993/1877),其次是肺 (32.6%,611/1877)和肝 (20.2%, 379/1877)。最常用的初始ET和CT治疗方案分别是芳香化酶抑制剂 (69.0%, 457/662)和紫杉烷类 (661.%, 803/1215)。
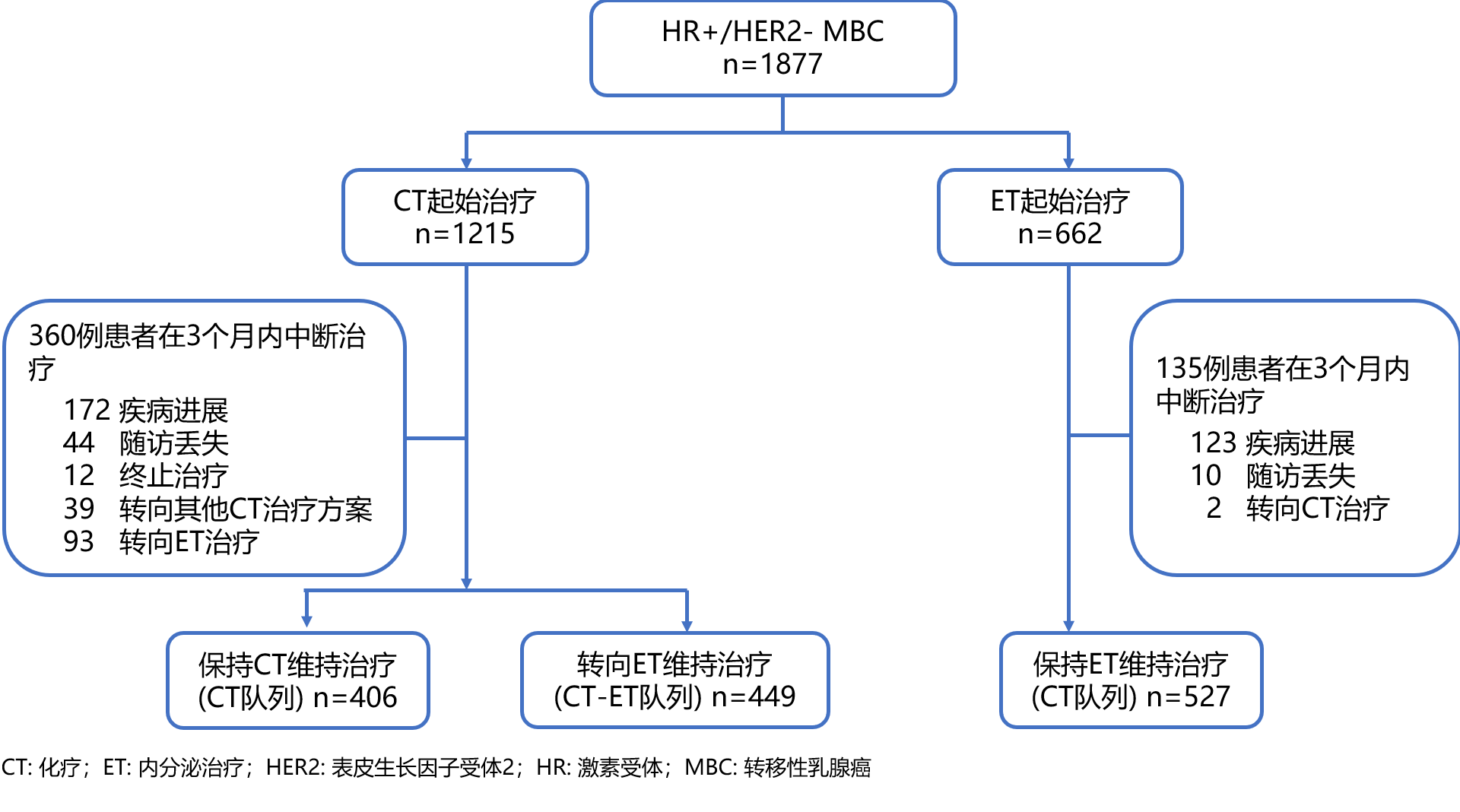
图1 研究概述和患者治疗
一线治疗的疗效和临床结局:基于初始治疗方案
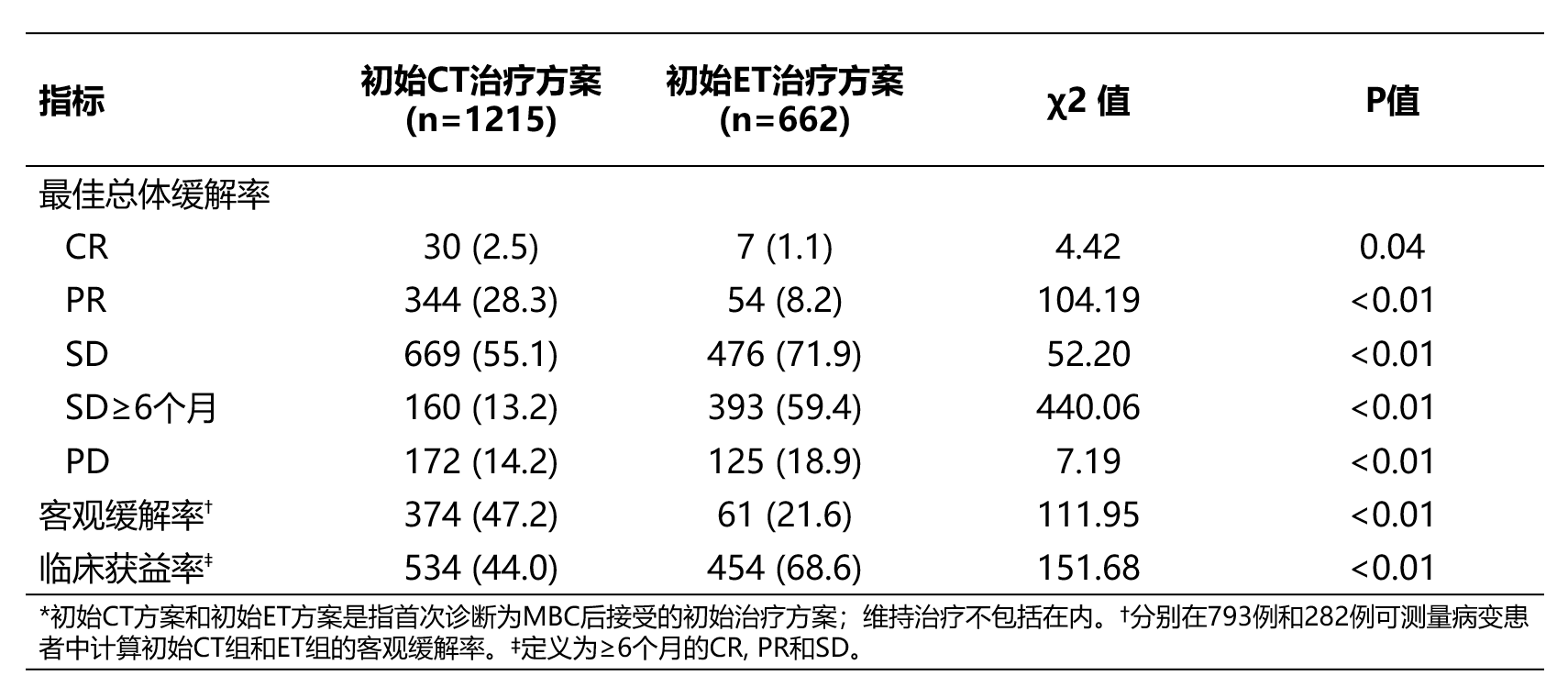
可测量病灶患者中,初始CT治疗的ORR高于初始ET治疗 (47.2% [374/793] vs 21.6% [61/282],p<0.01)。就所有患者而言,初始ET治疗的CBR高于初始CT治疗 (68.6% [454/662] vs. 44.0% [534/1215], P <0.01) (表1)。
表1 初始CT疗法和初始ET*疗法的最佳总体缓解率
初始ET治疗组和初始CT治疗组的PFS分别是12个月和11个月 (HR 0.94,95%CI,0.85-1.04,p=0.22) (图2A),OS分别是54个月和49个月 (HR 0.90; 95% CI, 0.79–1.02; P = 0.09)。在倾向评分匹配人群中,两组间PFS和OS均无统计学差异。

图2 HR+/HER2 - MBC患者一线治疗的PFS和OS分析
采用临床病理因素进行亚组PFS分析发现,既往(新)辅助ET无病间隔>12个月的患者更可能从初始ET治疗中获益 (HR 0.72; 95% CI, 0.57–0.92; P = 0.01) (图3A)。此外,初次诊断为M0的患者可从初始ET治疗中取得边际PFS获益 (HR 0.90; 95% CI, 0.81–1.00; P = 0.05),相同患者人群中,初始ET组的OS获益优于初始CT组 (HR 0.86; 95% CI, 0.76–0.99; P = 0.03)。初始ET治疗在无内脏转移患者中有OS获益趋势。在初始CT治疗中未发现与OS获益相关的因素 (图3B)。

图3 基于初始一线治疗方案进行HR+/HER2 - MBC患者亚组PFS和OS分析
ET+靶向治疗组与ET组间 (15个月 vs 11个月,HR 0.71,p=0.05)以及紫杉烷依赖治疗组和ET组间 (12个月 vs 11个月,HR 0.93,p=0.20) 的PFS均无统计差异 (图2C)。非紫杉烷依赖治疗组的PFS明显短于ET组 (8个月 vs 11个月,HR 1.25,p<0.01)。同样的,ET+靶向治疗组与ET组间 (52个月 vs 55个月,HR 1.16,p=0.51)以及紫杉烷依赖治疗组和ET组间 (55个月 vs 55个月,HR 0.94,p=0.39) 的OS均无统计差异。非紫杉烷依赖治疗组的OS明显短于ET组 (38个月 vs 55个月,HR 1.26,p<0.01) (图2D)。
一线治疗临床结局:基于治疗模式
初始CT和初始ET治疗组中分别有360例 (29.6%, 360/1215)和135例 (20.4%, 135/662)患者在治疗的前三个月疾病进展或中止治疗,且没有接受维持治疗 (图1)。剩余患者中有449例 (37.0%, 449/1215)在初始CT治疗后转换ET维持治疗 (CT-ET组),406例患者 (33.4%, 406/1215)继续以CT维持治疗直至疾病进展 (CT组),557例患者 (79.6%, 527/662)继续ET维持治疗直至疾病进展 (ET组)。
CT-ET组中,ET维持治疗药物包括芳香化酶抑制剂 (75.7%, 340/449),氟维司群 (4.0%, 18/449),ET+靶向治疗 (2.0%, 9/449)以及其他 (18.3%, 82/449)。初始CT治疗的中位时间是5个月 (将近6个治疗周期),CT-ET组中的ET维持治疗的中位时间是10个月。
CT-ET组的中位PFS是17个月 (95%CI, 15.5-19.0),ET组是14个月 (95%CI, 13.0-16.0),CT组是8.5个月 (95%CI, 8.0-9.0) (CT-ET组 vs. CT组, HR 0.43, P <0.01; ET组 vs. CT组, HR 0.49; P <0.01) (图4A)。倾向评分匹配后,CT-ET组和CT组之间以及ET组和CT组之间均存在显著差异。
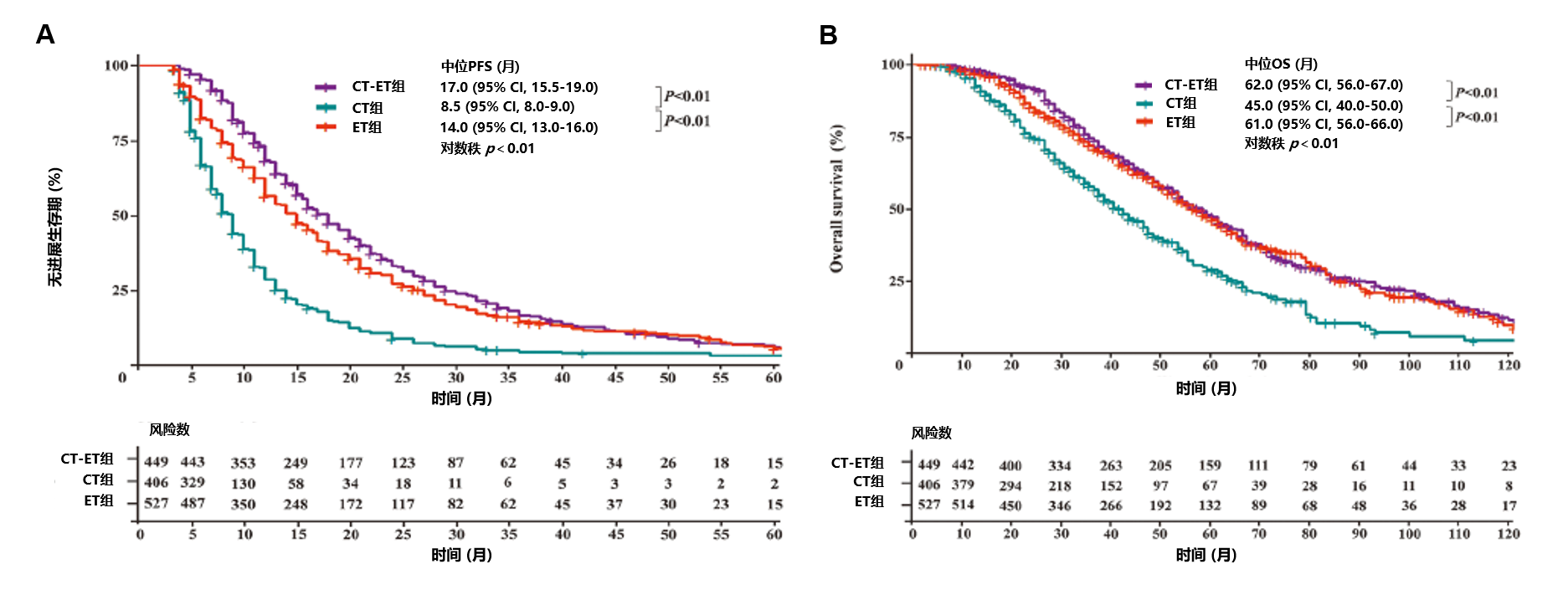
图4 基于一线治疗模式的PFS和OS分析
CT-ET组的中位OS是62个月 (95%CI, 56.0-67.0),ET组是61个月 (95%CI, 56.0-66.0),CT组是45个月 (95%CI, 40.0-50.0) (CT-ET组 vs. CT组, HR 0.66, P <0.01; ET组 vs. CT组, HR 0.74; P <0.01) (图4B)。倾向评分匹配后,CT-ET组和CT组之间以及ET组和CT组之间也存在显著差异。
后线治疗
在1877例患者中,1329例 (70.8%, 1329/1877)在一线治疗疾病进展后接受二线全身性治疗,796例 (42.4%, 796/1877)接受三线全身性治疗 (图5)。在初始CT和初始ET治疗组中,有接近1/3的患者接受ET二线治疗,而且有1/2的患者接受ET三线治疗。在二线和三线治疗时,CT和ET疗法中最常用的药物分别是紫衫烷和芳香化酶抑制剂。
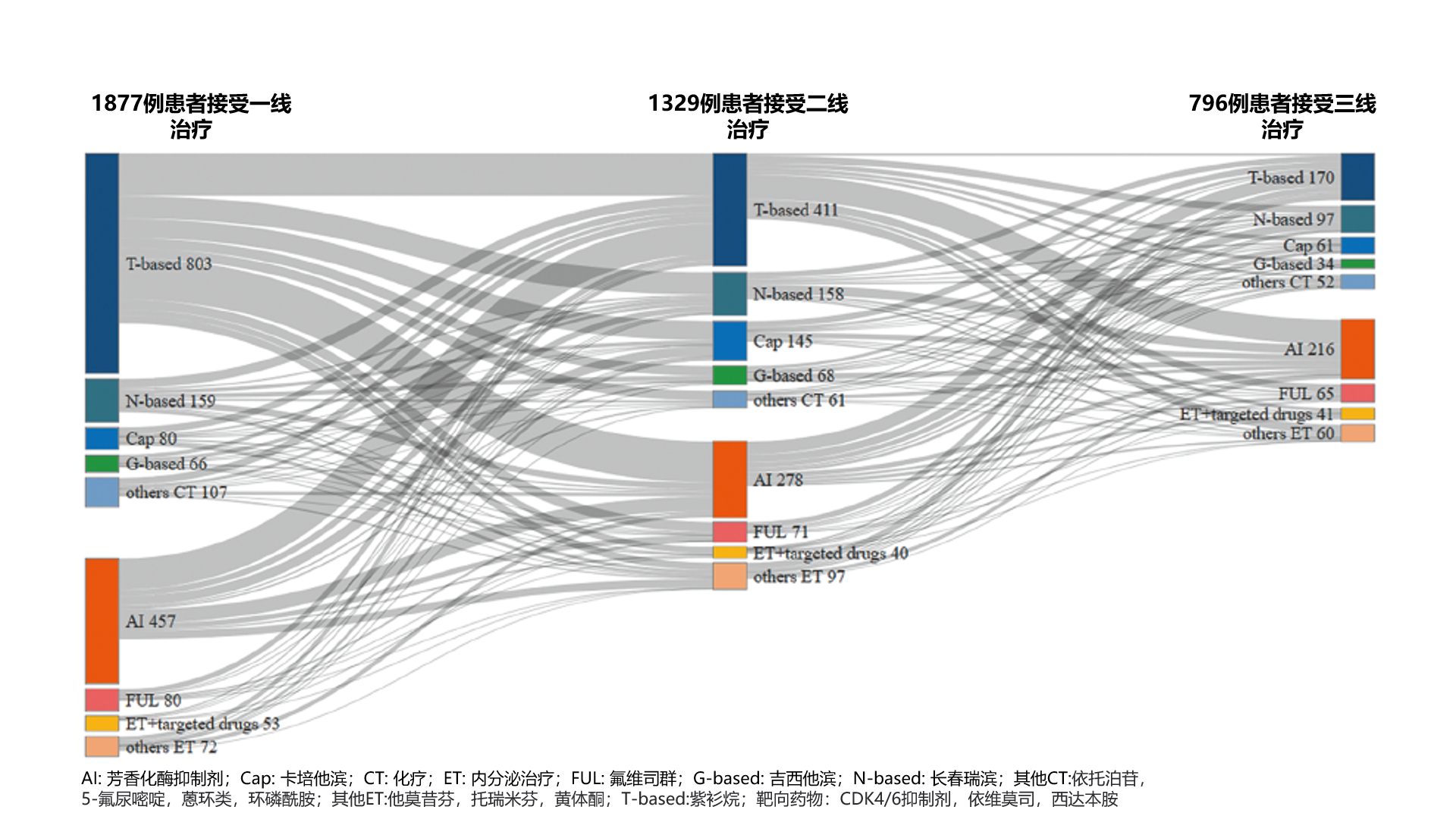
图5 HR+/HER2 - MBC患者的治疗顺序
讨论
本项多中心真实世界研究发现,初始ET和CT一线治疗患者的PFS和OS均无显著差异。但与连续性CT治疗相比,初始CT后转换ET维持治疗以及连续性ET治疗则与更长时间的PFS和OS相关。初始ET和CT一线治疗患者的临床结局无显著差异的原因可能有两个:初始CT治疗组中有将近一半患者转换ET维持治疗;作为ET治疗组中最有效的治疗方案,ET+靶向药物的治疗患者数偏小。与其他亚型乳腺癌相比,HR+/HER2-乳腺癌对CT的敏感性较低。虽然初始CT有更高的ORR,但这种优势并没有转化为PFS获益。雌激素受体信号通路是HR+/HER2 -乳腺癌中癌细胞生长和存活的主要驱动因素,因此ET有机会为这些患者提供足够的疾病控制。
亚组分析表明,既往(新)辅助ET无病间期>12个月和首次诊断为M0等反映内分泌敏感和疾病进展缓慢的因素是初始ET达到PFS获益的预测因素,而首次诊断时M0是初始ET取得OS获益的唯一预测因素。令人惊讶的是,包括多发性转移和内脏疾病在内的所有受测因素都没有与初始CT带来的OS获益相关。这些结果表明,ET和基于ET的治疗方案应被推荐为首选一线治疗方案,尤其对于激素敏感和疾病进展缓慢的患者而言。
一般来说,CT与起效迅速和不良反应频率增加有关,而ET与毒性更小、治疗满意度更高和生活质量更好有关。因此,CT和ET初始一线治疗时无显著差异的结果表明,应适当扩大ET及以ET为基础的方案在一线治疗中的临床应用。
ET +靶向药物组和ET组的PFS差异不显著,可能是接受ET +靶向药物治疗的患者数量太少。值得注意的是,靶向药物包括CDK4/6抑制剂、依维莫司和西达本胺,在53例接受ET +靶向药物治疗的患者中,有39例患者在既往辅助ET治疗时疾病进展。在四种方案中,非紫杉烷依赖CT方案与最短的PFS和OS相关。根据指南,推荐以紫杉烷依赖方案作为MBC患者的首选CT。但本研究显示,在2010年之后,仍有相当多的患者接受非紫杉烷依赖的CT作为一线治疗,即使无紫杉烷耐药证据。这些不恰当的治疗方案与指南不一致,导致了更糟糕的临床结果。
在一线治疗模式的疗效分析中,排除了病情快速进展和3个月内停药的患者后,在总体人群和倾向评分匹配的人群中,CT-ET组和ET组的中位PFS均长于CT组,PFS获益转化为OS的显著延长。HR+/HER2 - MBC对ET的固有敏感性以及排除疾病快速进展的患者可能使ET的疗效得到更清楚的证明,这可能解释了本研究所观察到的生存率提高。
初始CT后如何维持治疗的证据很少。患者是否应该切换到另一种方案或从初始治疗中选择一种药物作为维持治疗尚不清楚。III期AROBASE试验显示,与一线紫杉烷和贝伐珠单抗联合治疗后继续紫杉烷和贝伐珠单抗治疗的患者相比,接受依西美坦加贝伐珠单抗维持治疗的患者无PFS改善。随机对照OVERSTEP试验表明,在一线CT治疗后,ET维持治疗的PFS优于CT维持治疗 (17.7个月vs 12.2个月,P = 0.01),特别是在内分泌敏感和非内脏转移人群中。单臂研究FANCY显示,HR+/HER2 - MBC患者在一线CT后给予氟维司汀维持治疗是有效且耐受性良好的。初始CT后序贯使用ET维持治疗是一种常用的治疗方式,它结合了初始CT反应快的优势和ET维持治疗耐受性好、疗效可观等优点,达到更好的临床结局。本研究有超过一半的非进展性疾病患者在中位数为6个周期的CT治疗后转换ET维持治疗,CT- ET的PFS获益转化为OS的延长。
CT是需要快速缓解患者的一种治疗选择,例如那些新发IV期疾病和一些有内脏危象的紧急病例。如果在初始CT时最佳总体缓解达到客观缓解或病情稳定,切换到ET维持治疗可能比继续CT提供更有利的临床结果。
本研究受到回顾性和观察性研究固有的局限性影响。本研究的时间跨度大,临床特征和治疗方案多年来有所不同。虽然在评估两组间PFS和OS差异时使用倾向评分匹配来最小化偏差,但结果应须谨慎解释。此外,可能显示ET优势的生活质量和健康经济学数据也无法获得,且本研究只有53例患者接受了ET +靶向药物治疗。然而,由于缺乏比较ET与CT作为初始和维持治疗疗效的随机对照研究,本项真实世界研究为CT和ET一线治疗 HR+/HER2- MBC患者的临床结果提供了重要信息。
参考文献
Yang Yuan, et al. Efficacy and clinical outcome of chemotherapy and endocrine therapy as first-line treatment in patients with hormone receptor-positive HER2-negative metastatic breast cancer. Chin Med J (Engl). 2023 Jun 20;136(12):1459-1467. PMID: 37101355.


