
简要介绍
前列腺癌
1. Eur Urol:寡转移性前列腺癌的持续雄激素剥夺治疗联合或不联合转移灶定向治疗:多中心2期随机EXTEND试验
2. Lancet Oncol:基线PSMA-PET总肿瘤体积和SUVmean在ENZA-p试验(ANZUP1901)转移性去势抵抗性前列腺癌中的预后和预测价值:一项多中心、开放标签、随机2期试验的亚研究
3. Ann Oncol:¹⁷⁷Lu-PSMA-617对比更换雄激素受体通路抑制剂治疗紫杉类未暴露转移性去势抵抗性前列腺癌的3期PSMAfore试验最终总生存期和安全性分析
4. J Clin Oncol:纳武利尤单抗联合伊匹木单抗治疗具有免疫原性特征的转移性去势抵抗性前列腺癌:多中心、两队列2期NEPTUNES研究
5. Lancet:他拉唑帕利联合恩扎卢胺治疗HRR缺陷型转移性去势抵抗性前列腺癌的3期TALAPRO-2试验最终总生存期结果
肾癌
6. Eur Urol:肾癌流行病学:发病率、死亡率、生存率、遗传易感性及危险因素
7. Eur Urol:帕博利珠单抗联合仑伐替尼一线治疗晚期非透明细胞肾癌:2期KEYNOTE-B61试验更新结果
膀胱癌
8. J Clin Oncol:肌层浸润性膀胱癌:一个关键转折点
前列腺癌
1. 寡转移性前列腺癌的持续雄激素剥夺治疗联合或不联合转移灶定向治疗:多中心2期随机EXTEND试验
发表期刊:Eur Urol
背景与目的:寡转移性前列腺癌(omPC)的特点是转移灶数量有限。本研究假设,对omPC所有病灶进行转移灶定向治疗(MDT)联合雄激素剥夺治疗(ADT)可改善临床结局。
方法:在多中心2期EXTEND试验中,寡转移性前列腺癌患者按1:1随机分配至ADT组或MDT+ADT组,试验分为两个独立设效且随机的亚组,一个采用间歇性ADT,另一个采用持续性ADT。主要终点为无进展生存期(PFS),次要终点包括影像学无进展生存期(rPFS)和无去势抵抗生存期(CRFS)。本文报告持续性ADT亚组的主要结果、两亚组合并分析结果及转化免疫相关性分析。
主要发现与局限性:2018年9月至2022年8月,共174例患者被随机分配并符合主要分析条件。在持续性ADT亚组(n=87)中,MDT+ADT组的中位PFS为47个月,ADT组为22个月(风险比[HR]=0.50;单侧P=0.036)。合并分析显示,MDT+ADT组中位PFS为36个月,ADT组为17个月(HR=0.45;P<0.001)(见图1)。MDT+ADT组的影像学无进展生存期和无去势抵抗生存期亦更优。MDT+ADT后的持久临床应答与全身性Th1极化细胞因子上调及CD8⁺T细胞增殖相关。与ADT相比,MDT+ADT可诱导更强的全身性免疫激活,包括T细胞受体的扩增/收缩,这在独立的转移灶定向治疗ORIOLE试验中亦有观察。在MDT+ADT治疗后,出现全身性T细胞受体扩增/收缩的患者获得了最大的PFS获益。
结论与临床意义:在寡转移性前列腺癌患者中,MDT+ADT较ADT可改善PFS,值得3期试验进一步验证。具有假设生成意义的免疫应答需机制验证,未来应开展T细胞靶向免疫治疗的相关试验。
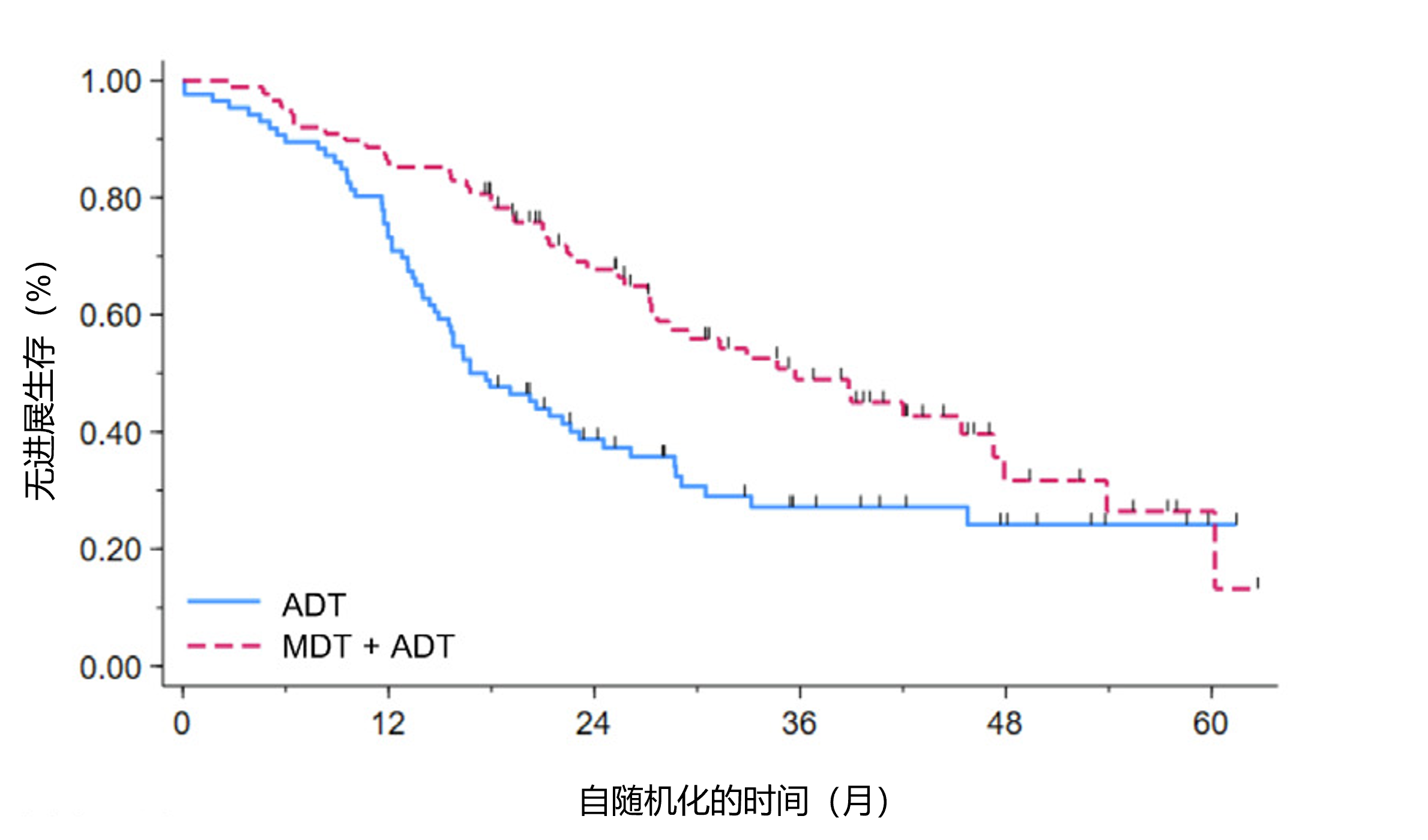
图1. 合并分析MDT+ADT组和ADT组的无进展生存率
2. 基线PSMA-PET总肿瘤体积和SUVmean在ENZA-p试验(ANZUP1901)转移性去势抵抗性前列腺癌中的预后和预测价值:一项多中心、开放标签、随机2期试验的亚研究
发表期刊:Lancet Oncol
背景:⁶⁸Ga标记的前列腺特异性膜抗原(PSMA)-11 PET-CT(PSMA-PET-CT)的定量参数(如全身平均标准化摄取值[SUVmean]和总肿瘤体积[PSMA-TTV])已被证实对前列腺癌患者接受¹⁷⁷Lu标记的PSMA-617(¹⁷⁷Lu-PSMA-617)单药治疗的应答具有预后价值。在ENZA-p试验中,将¹⁷⁷Lu-PSMA-617联合恩扎卢胺较恩扎卢胺单药可改善转移性去势抵抗性前列腺癌患者的总生存期。本ENZA-p预设亚研究旨在评估基线PSMA-PET定量参数作为恩扎卢胺联合¹⁷⁷Lu-PSMA-617及恩扎卢胺单药治疗的预测和预后生物标志物的价值。
方法:ENZA-p是一项在澳大利亚15家医院开展的开放标签、随机2期试验。入组患者为18岁及以上的进展性转移性去势抵抗性前列腺癌患者,既往未接受过多西他赛或雄激素受体通路抑制剂(允许接受阿比特龙)治疗转移性去势抵抗性前列腺癌,⁶⁸Ga-PSMA-PET-CT显示阳性病灶(单个部位SUVmax>15,所有较大肿瘤部位SUVmax>10),东部肿瘤协作组体能状态评分为0-2,且至少有2个恩扎卢胺早期进展风险因素。通过中央化网络系统采用含随机成分的最小化法将患者按1:1随机分配至恩扎卢胺160mg每日口服组或恩扎卢胺160mg每日口服联合¹⁷⁷Lu-PSMA-617(7.5GBq,每6-8周静脉给药1次,自适应剂量为2或4次)组。主要终点为前列腺特异性抗原(PSA)无进展生存期(已在既往报告)。所有参与者均接受基线⁶⁸Ga-PSMA-11 PET-CT评估。采用半自动软件量化PSMA-PET参数以获得PSMA-TTV和SUVmean,并在预设分析中与总生存期和PSA无进展生存期进行相关性分析,本亚研究的主要终点为总生存期。阈值基于基线SUVmean最高四分位数(Q4 vs Q1-3)和PSMA-TTV中位数。采用Kaplan-Meier法和Cox回归模型,按实际接受治疗情况分析患者。试验注册于ClinicalTrials.gov(NCT04419402),随访已完成。
结果:2020年8月17日至2022年7月26日,162例参与者被随机分配至恩扎卢胺组(n=79)或恩扎卢胺联合¹⁷⁷Lu-PSMA-617组(n=83)。本亚研究纳入162例随机分配患者中接受研究治疗的160例(恩扎卢胺组79例,恩扎卢胺联合¹⁷⁷Lu-PSMA-617组81例)。最终数据截止日(2024年7月31日)的中位随访时间为34个月(IQR 29-39),共发生96例死亡(恩扎卢胺组53例,联合治疗组43例)。基线中位SUVmean为7.7(IQR 6.5-9.8),中位PSMA-TTV为234mL(76-687)。如图2所示,恩扎卢胺组中,PSMA-TTV低于或高于中位数患者的中位总生存期分别为39个月(95%CI 31-未达到)和20个月(13-24)(HR=0.23[95%CI 0.13-0.42],log-rank P<0.0001)。如图3所示,恩扎卢胺联合¹⁷⁷Lu-PSMA-617组中,PSMA-TTV低于或高于中位数患者的中位总生存期分别为35个月(95%CI 32-37)和28个月(26-34)(HR=0.66[0.36-1.21],log-rank P=0.18)。PSMA-TTV与治疗组对总生存期的交互作用检验P=0.0078。恩扎卢胺组中,SUVmean Q4与Q1-3患者的中位总生存期分别为29个月(95%CI 17-39)和25个月(21-31)(HR=0.84[0.44-1.60],log-rank P=0.59)。恩扎卢胺联合¹⁷⁷Lu-PSMA-617组中,SUVmean Q4与Q1-3患者的中位总生存期分别为32个月(95%CI 21-未达到)和34个月(27-35)(HR=0.80[0.38-1.68],log-rank P=0.56)。SUVmean(Q4 vs Q1-3)与治疗组对总生存期的交互作用检验P=0.88。
解读:基线PSMA-TTV对高危转移性去势抵抗性前列腺癌患者接受恩扎卢胺联合¹⁷⁷Lu-PSMA-617一线治疗的总生存期具有预后价值和预测获益的价值。相比之下,当¹⁷⁷Lu-PSMA-617与恩扎卢胺联用时,PSMA SUVmean对PSA无进展生存期或总生存期无预后价值。
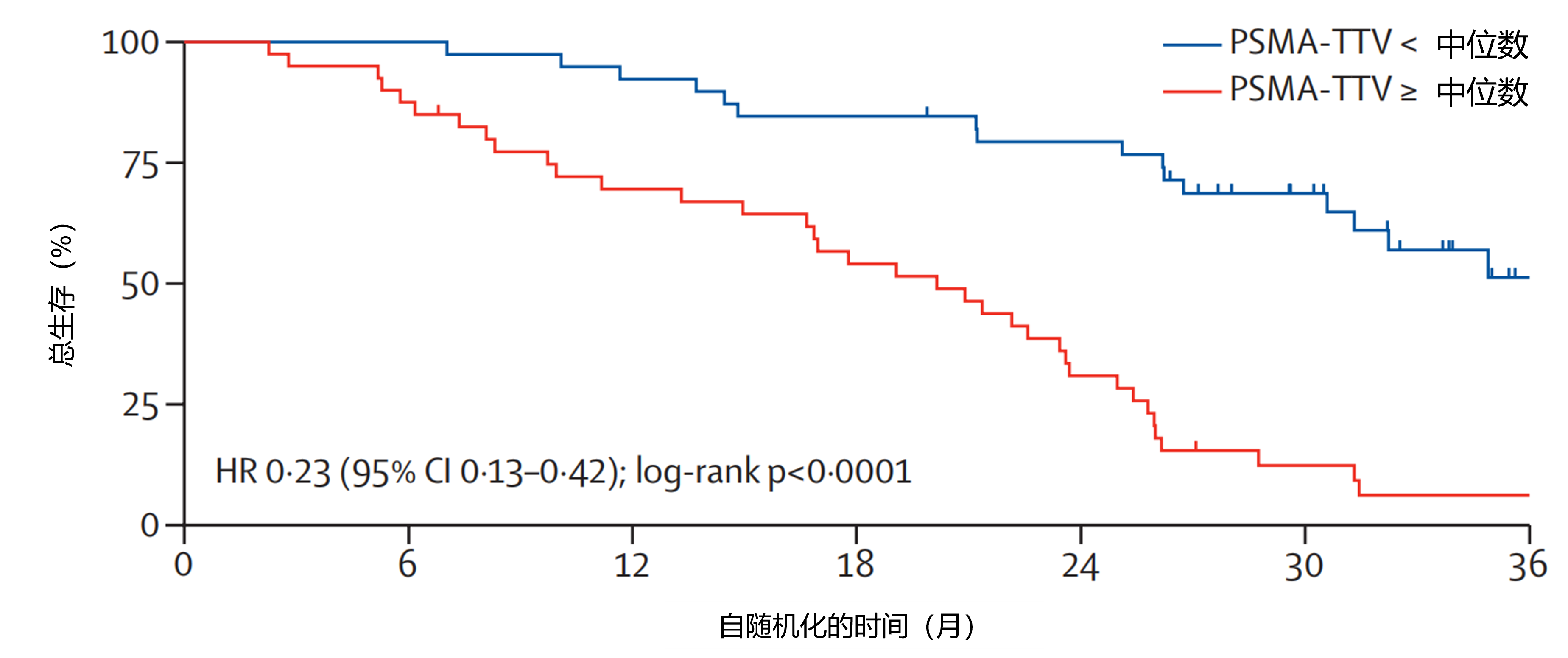
图2. 恩扎卢胺组中PSMA-TTV低于或高于中位数患者的总生存率
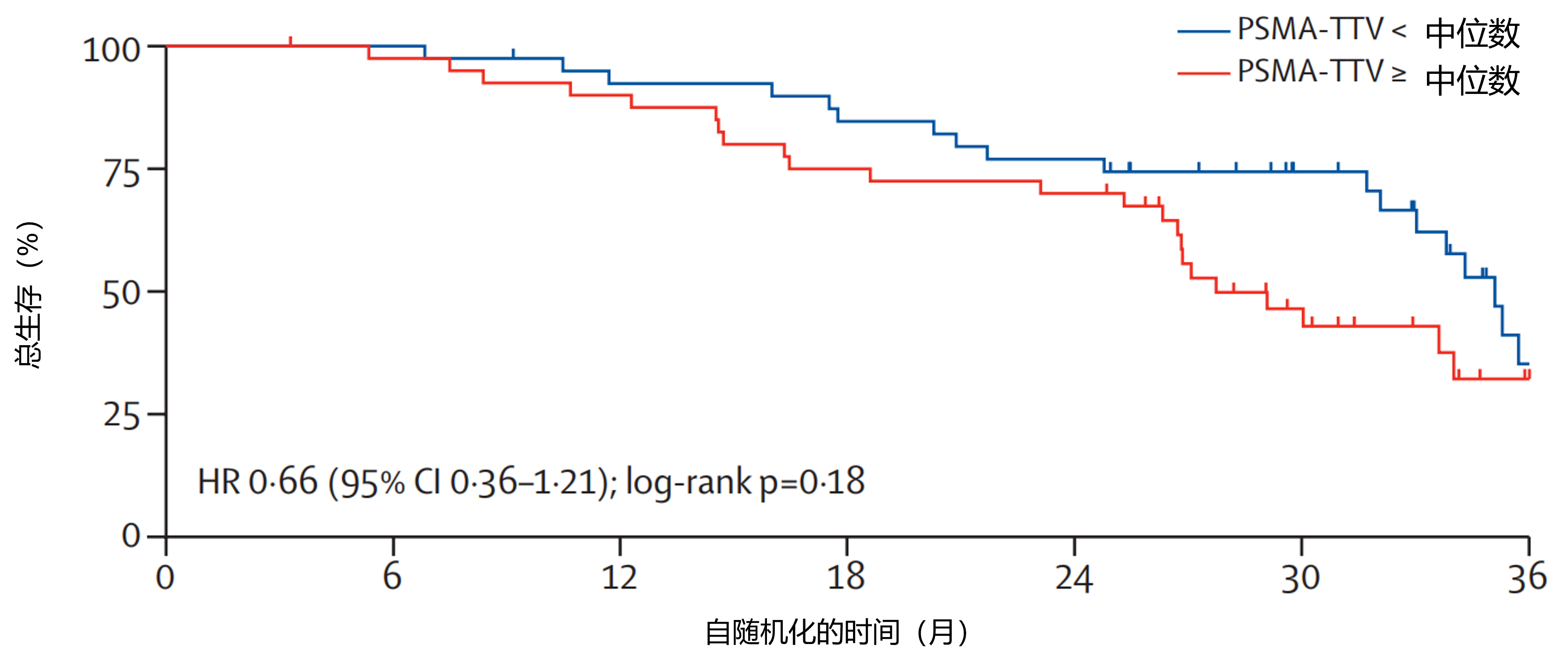
图3. 恩扎卢胺联合¹⁷⁷Lu-PSMA-617组中PSMA-TTV低于或高于中位数患者的总生存率
3. ¹⁷⁷Lu-PSMA-617对比更换雄激素受体通路抑制剂治疗紫杉类未暴露转移性去势抵抗性前列腺癌的3期PSMAfore试验最终总生存期和安全性分析
发表期刊:Ann Oncol
背景:在PSMAfore试验中,与更换雄激素受体通路抑制剂(ARPI)相比,¹⁷⁷Lu标记的PSMA-617(¹⁷⁷Lu-PSMA-617)可延长紫杉类未暴露的转移性去势抵抗性前列腺癌(mCRPC)患者的影像学无进展生存期(rPFS),且安全性良好。本文报告最终总生存期(OS)分析和更新的安全性数据。
患者与方法:PSMAfore(NCT04689828)是一项开放标签、国际多中心3期试验。入组患者为前列腺特异性膜抗原(PSMA)阳性的mCRPC,既往接受一种ARPI治疗后疾病进展,且适合更换ARPI治疗。患者按1:1随机分配至¹⁷⁷Lu-PSMA-617组或更换ARPI(阿比特龙或恩扎卢胺)组。经中央确认影像学进展后,允许从更换ARPI组交叉至¹⁷⁷Lu-PSMA-617组。终点包括rPFS(主要)、OS(关键次要)和安全性(次要)。
结果:共有468例患者分别随机分配至¹⁷⁷Lu-PSMA-617组和更换ARPI组(各234例):更换ARPI组中141/234例(60.3%)患者交叉至¹⁷⁷Lu-PSMA-617组(占中央确认影像学进展患者的75.4%)。基于意向性治疗(ITT)原则,¹⁷⁷Lu-PSMA-617组中位OS为24.48个月(95%CI 19.55-28.94),更换ARPI组为23.13个月(19.61-25.53)(风险比[HR]=0.91[95%CI 0.72-1.14];P=0.20);通过逆概率删失加权模型调整交叉后的OS HR为0.59(95%CI 0.38-0.91)。¹⁷⁷Lu-PSMA-617组与更换ARPI组的暴露调整3级及以上治疗期间出现的不良事件发生率分别为60.8 vs 85.1/100患者-治疗年,严重不良事件发生率分别为32.5 vs 49.9/100患者-治疗年。¹⁷⁷Lu-PSMA-617组中,227例患者中有135例(59.5%)出现口干(2例为3级及以上),62例(27.3%)出现贫血(14例为3级及以上)。
结论:基于ITT原则,¹⁷⁷Lu-PSMA-617组与ARPI组的OS无统计学显著差异,结果可能受高交叉率影响。¹⁷⁷Lu-PSMA-617安全性良好,未发现新的安全信号。
4. 纳武利尤单抗联合伊匹木单抗治疗具有免疫原性特征的转移性去势抵抗性前列腺癌:多中心、两队列2期NEPTUNES研究
发表期刊:J Clin Oncol
目的:免疫检查点抑制剂在未筛选的转移性去势抵抗性前列腺癌(mCRPC)患者中疗效有限。NEPTUNES研究评估纳武利尤单抗联合伊匹木单抗在免疫原性特征阳性(ImS+)mCRPC患者中的疗效。
材料与方法:这项开放标签、两队列2期试验纳入接受过至少1线治疗后进展的ImS1 mCRPC患者。ImS+定义为:(1)错配修复缺陷(MMRD);(2)DNA损伤修复基因缺失;和/或(3)高炎症浸润(HII)。患者接受4剂纳武利尤单抗1mg/kg联合伊匹木单抗3mg/kg(队列1)或纳武利尤单抗3mg/kg联合伊匹木单抗1mg/kg(队列2),随后接受纳武利尤单抗480mg每4周1次,最多10个周期。主要终点为结合影像学、生化学和循环肿瘤细胞减少评估的复合应答率(CRR)。次要终点包括毒性、无进展生存期、总生存期和应答持续时间。
结果:2018年5月至2022年6月,队列1(C1)35例、队列2(C2)36例患者开始治疗。C1的CRR为14/35(40%,90%CI 26%-55%),C2为9/36(25%,90%CI 14%-40%)。总CRR为23/71(32%,90%CI 23%-43%)。错配修复缺陷(7/10)、BRCA2缺失(4/8)及高炎症浸润合并其他ImS+特征(13/30)患者的应答率更高。高炎症浸润无其他ImS+特征、无错配修复缺陷的DNA修复基因缺失、错配修复缺陷患者的应答持续时间分别为2.6个月、17.3个月和10个月。C1中22/35例(63%)、C2中12/36例(33%)患者发生3-4级治疗相关不良事件。无治疗相关死亡。
结论:纳武利尤单抗1mg/kg联合伊匹木单抗3mg/kg在经治的ImS+ mCRPC中具有活性。纳武利尤单抗3mg/kg联合伊匹木单抗1mg/kg毒性较低,但疗效可能较弱。高炎症浸润是前列腺癌中经前瞻性验证的潜在预测生物标志物,可纳入未来试验。
5. 他拉唑帕利联合恩扎卢胺治疗HRR缺陷型转移性去势抵抗性前列腺癌的3期TALAPRO-2试验最终总生存期结果
发表期刊:Lancet
背景:转移性去势抵抗性前列腺癌仍无法治愈,且在存在直接或间接参与同源重组修复(HRR)的DNA损伤修复基因改变的患者中尤为侵袭性。TALAPRO-2试验初步分析显示,在携带HRR基因改变的转移性去势抵抗性前列腺癌患者中,他拉唑帕利联合恩扎卢胺较恩扎卢胺联合安慰剂显著改善影像学无进展生存期(rPFS)。初步分析时总生存期数据尚未成熟。本文报告TALAPRO-2试验HRR缺陷型队列的预设最终总生存期分析、更新的rPFS、安全性及患者报告结局。
方法:TALAPRO-2是一项正在进行的国际多中心、随机、双盲、安慰剂对照3期试验。HRR缺陷型队列纳入来自26个国家142家医院、癌症中心和医疗中心的随机分配患者;入组患者为18岁及以上(日本为20岁及以上)的无症状或轻度症状转移性去势抵抗性前列腺癌患者,入组时疾病进展,既往未接受过延长生存期的去势抵抗性前列腺癌全身治疗,但正在接受持续雄激素剥夺治疗。前瞻性评估患者肿瘤HRR基因改变状态,按1:1随机分配至他拉唑帕利0.5mg联合恩扎卢胺160mg每日口服1次组或恩扎卢胺联合安慰剂组,分层因素为既往去势敏感性疾病治疗史(是vs否)。申办方、患者和研究者对他拉唑帕利或安慰剂设盲,恩扎卢胺为开放标签。主要终点为盲态独立中心审查的rPFS(从随机化至影像学进展或死亡的时间,以先发生者为准),总生存期(从随机化至任何原因死亡的时间)是关键α保护次要终点,均在意向性治疗人群中评估。总生存期随访持续至计划的最终分析。基于采用O'Brien-Fleming消耗函数的成组序贯设计,最终总生存期分析的双侧P值需≤0.024才具有统计学显著性。安全性在至少接受1剂研究药物的患者中评估。试验注册于ClinicalTrials.gov(NCT03395197)。
结果:2018年12月18日至2022年1月20日,399例HRR缺陷型转移性去势抵抗性前列腺癌患者被随机分配(200例[50%]至他拉唑帕利联合恩扎卢胺组,199例[50%]至恩扎卢胺联合安慰剂组)。中位随访44.2个月(IQR 36.0-50.8)时,他拉唑帕利联合恩扎卢胺组的总生存期较恩扎卢胺组显著改善(风险比[HR]=0.62[95%CI 0.48-0.81];双侧P=0.0005);他拉唑帕利组中位总生存期为45.1个月(95%CI 35.4-未达到),对照组为31.1个月(27.3-35.4)。在BRCA1/2改变亚组(n=155[39%])中,他拉唑帕利联合恩扎卢胺组中位总生存期未达到,恩扎卢胺组为28.5个月(HR=0.50[95%CI 0.32-0.78];P=0.0017);4年总生存率分别为53%和23%。在无BRCA1/2改变的患者中(n=244[61%]),他拉唑帕利联合恩扎卢胺组中位总生存期为42.4个月,恩扎卢胺组为32.6个月(HR=0.73[95%CI 0.52-1.02];P=0.066)。如图5,更新的rPFS显示他拉唑帕利联合恩扎卢胺更优(HR=0.47[95%CI 0.36-0.61];P<0.0001;中位rPFS 30.7 vs 12.3个月)。未发现新的安全信号;他拉唑帕利联合恩扎卢胺组最常见的3级及以上不良事件为贫血(86例[43%])和中性粒细胞减少(39例[20%])。
解读:他拉唑帕利联合恩扎卢胺较恩扎卢胺联合安慰剂显著改善生存期且具有临床意义,进一步支持该联合方案作为HRR缺陷型转移性去势抵抗性前列腺癌的标准治疗。
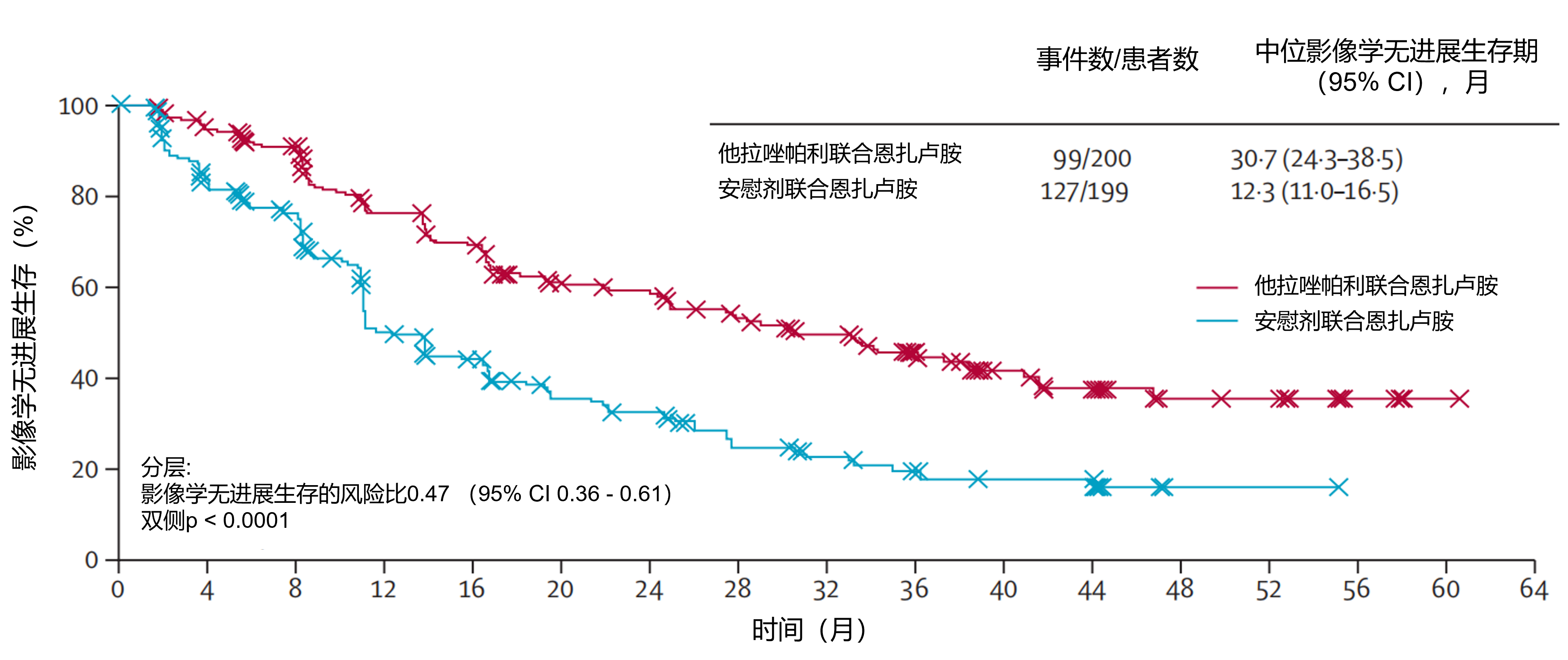
图4.他拉唑帕利联合恩扎卢胺和恩扎卢胺联合安慰剂的影像学无进展生存期
肾癌
6. 肾癌流行病学:发病率、死亡率、生存率、遗传易感性及危险因素
发表期刊:Eur Urol
背景与目的:肾癌(RC)是一种常见恶性肿瘤。其发病率和死亡率因地理区域和性别而异,且预计未来将上升。本综述旨在描述肾癌的全球流行病学特征,包括发病率、死亡率、生存率、遗传易感性及危险因素。
方法:从国际癌症研究机构的全球癌症观察站获取当前及预测的发病率和死亡率国家估算数据。发病率和死亡率分别定义为2022年的新发病例数和死亡数。2022至2050年的未来估算基于预测的人口增长和老龄化。评估所有全球指标,并按地理区域和性别分层分析数据。从国际或国家登记处、系统综述和荟萃分析或原始报告中评估生存率。此外,更新关于遗传易感性和危险因素的流行病学综述。
主要发现与局限性:2022年全球记录肾癌新发病例434,840例,死亡155,953例。发病率和死亡率因地理区域和性别而异。预计2050年将出现745,791例新发病例(增加72%)和304,861例死亡(增加96%)。不同地理区域的5年总生存率为40%-75%。VHL、ELOC、TSC1/2、MET、FLCN、PRDM10、SDHA/B/C/D、MiTF、CDC73、FH、PTEN、BAP1、SMARCB1、CHEK2、MUTYH、BRCA2、ATM和APC等位基因的致病性变异可增加肾癌易感性。非可改变危险因素包括性别、地理区域、种族/祖先和家族史。可改变危险因素包括肥胖、胰岛素抵抗/糖尿病、高血压、慢性肾病、吸烟、环境暴露和缺乏体育锻炼。
结论与临床意义:当前及预测的发病率和死亡率数据可为患者、临床医生和决策者提供参考。肾癌流行病学、遗传易感性和危险因素数据可能有助于早期检测、选择性基因检测及指导风险适应性预防和筛查策略。
7. 帕博利珠单抗联合仑伐替尼一线治疗晚期非透明细胞肾癌:2期KEYNOTE-B61试验更新结果
发表期刊:Eur Urol
背景与目的:KEYNOTE-B61试验初步结果显示,帕博利珠单抗联合仑伐替尼在既往未治疗的晚期非透明细胞肾癌(nccRCC)中具有良好的抗肿瘤活性。本文报告近2年随访后的更新疗效和安全性结果。
方法:单臂、多中心2期KEYNOTE-B61试验纳入18岁及以上的既往未治疗晚期nccRCC患者。所有参与者接受帕博利珠单抗400mg静脉给药(每6周1次,最多18个周期,约2年)联合仑伐替尼20mg每日口服1次。主要终点为根据实体瘤疗效评价标准1.1版由盲态独立中心审查评估的客观缓解率(ORR)。次要终点为缓解持续时间(DOR)和安全性。
主要发现与局限性:共158例患者接受至少1剂研究治疗。中位随访时间为22.8个月(范围16.6-27.6)。ORR为51%(95%CI 43%-59%);13例(8.2%)达到确认完全缓解,67例(42%)达到确认部分缓解。在确认缓解的亚组中,中位DOR为19.5个月(范围1.5+-23.5+)。各亚组ORR总体一致,包括不同组织学亚型(34%-67%)和存在肉瘤样特征的患者(47%)。92例(58%)患者报告3-4级治疗相关不良事件。无治疗相关死亡。
结论与临床意义:约2年随访后,KEYNOTE-B61试验显示帕博利珠单抗联合仑伐替尼具有持久的抗肿瘤活性,且无新的安全信号。这些结果支持帕博利珠单抗联合仑伐替尼作为晚期nccRCC的一线治疗选择。
膀胱癌
8. 肌层浸润性膀胱癌:一个关键转折点
发表期刊:J Clin Oncol
过去几十年,肌层浸润性膀胱癌(MIBC)的治疗取得了显著进展。肌层浸润性膀胱癌多见于老年患者,这类患者常合并基础疾病,且生理功能存在年龄相关改变。这在历史上导致MIBC临床试验中定义的治疗疗效与更广泛患者群体中实际治疗效果之间存在差异。根治性膀胱切除术联合围手术期全身治疗、放疗联合同步化疗是MIBC的标准治疗。免疫检查点抑制剂(ICB)现已纳入新辅助和辅助治疗场景。循环肿瘤DNA作为微小残留病的检测指标,用于指导辅助ICB的应用,目前正在多项临床试验中探索。抗体-药物偶联物联合ICB用于围手术期有望进一步改善结局。较历史方案具有更高病理完全缓解率的更有效全身治疗方案,为风险适应性个体化保膀胱治疗策略提供了可能。未来十年,强效治疗药物、精准生物标志物和风险适应性策略将前所未有的融合,成为重新定义MIBC治疗的关键转折点。
参考文献
- Sherry AD, Siddiqui BA, Haymaker C, et al. Continuous Androgen Deprivation Therapy with or Without Metastasis-directed Therapy for Oligometastatic Prostate Cancer: The Multicenter Phase 2 Randomized EXTEND Trial[J]. Eur Urol. 2025 Jul 31:S0302-2838(25)00396-3.
- Emmett L, Papa N, Subramaniam S, et al. ENZA-p Trial Investigators and the Australian and New Zealand Urogenital and Prostate Cancer Trials Group. Prognostic and predictive value of baseline PSMA-PET total tumour volume and SUVmean in metastatic castration-resistant prostate cancer in ENZA-p (ANZUP1901): a substudy from a multicentre, open-label, randomised, phase 2 trial[J]. Lancet Oncol. 2025 Jul 30:S1470-2045(25)00339-0.
- Fizazi K, Chi KN, Shore ND, et al. Final overall survival and safety analyses of the phase 3 PSMAfore trial of [177Lu]Lu-PSMA-617 versus change of androgen receptor pathway inhibitor in taxane-naive patients with metastatic castration-resistant prostate cancer[J]. Ann Oncol. 2025 Jul 16:S0923-7534(25)00852-X.
- Leone G, Wong YNS, Jones RJ, et al. Nivolumab and Ipilimumab for Metastatic Castration-Resistant Prostate Cancer With an Immunogenic Signature: The Multicenter, Two-Cohort, Phase II NEPTUNES Study[J]. J Clin Oncol. 2025 Jul 28:JCO2402637.
- Fizazi K, Azad AA, Matsubara N, et al. Talazoparib plus enzalutamide in men with HRR-deficient metastatic castration-resistant prostate cancer: final overall survival results from the randomised, placebo-controlled, phase 3 TALAPRO-2 trial[J]. Lancet. 2025 Aug 2;406(10502):461-474.
- Larcher A, Campi R, Bex A, et al. Epidemiology of Renal Cancer: Incidence, Mortality, Survival, Genetic Predisposition, and Risk Factors[J]. Eur Urol. 2025 Jul 31:S0302-2838(25)00345-8.
- Voss MH, Gurney H, Atduev V, et al. First-line Pembrolizumab Plus Lenvatinib for Advanced Non-clear-cell Renal Cell Carcinoma: Updated Results from the Phase 2 KEYNOTE-B61 Trial[J]. Eur Urol. 2025 Jul 23:S0302-2838(25)00297-0.
- Galsky MD, Ballas L, Kamat AM. Muscle-Invasive Bladder Cancer: A Watershed Moment[J]. J Clin Oncol. 2025 Aug 5:JCO2500718.



