本品适用于既往接受过至少三线治疗(包括一种蛋白酶体抑制剂、一种免疫调节剂和一种抗CD38 单克隆抗体)的复发或难治性多发性骨髓瘤成人患者的治疗。1
基于单臂研究的总体缓解率及缓解持续时间附条件批准上述适应症,本适应症的常规批准将取决于后期确证性随机对照临床试验的结果 。1
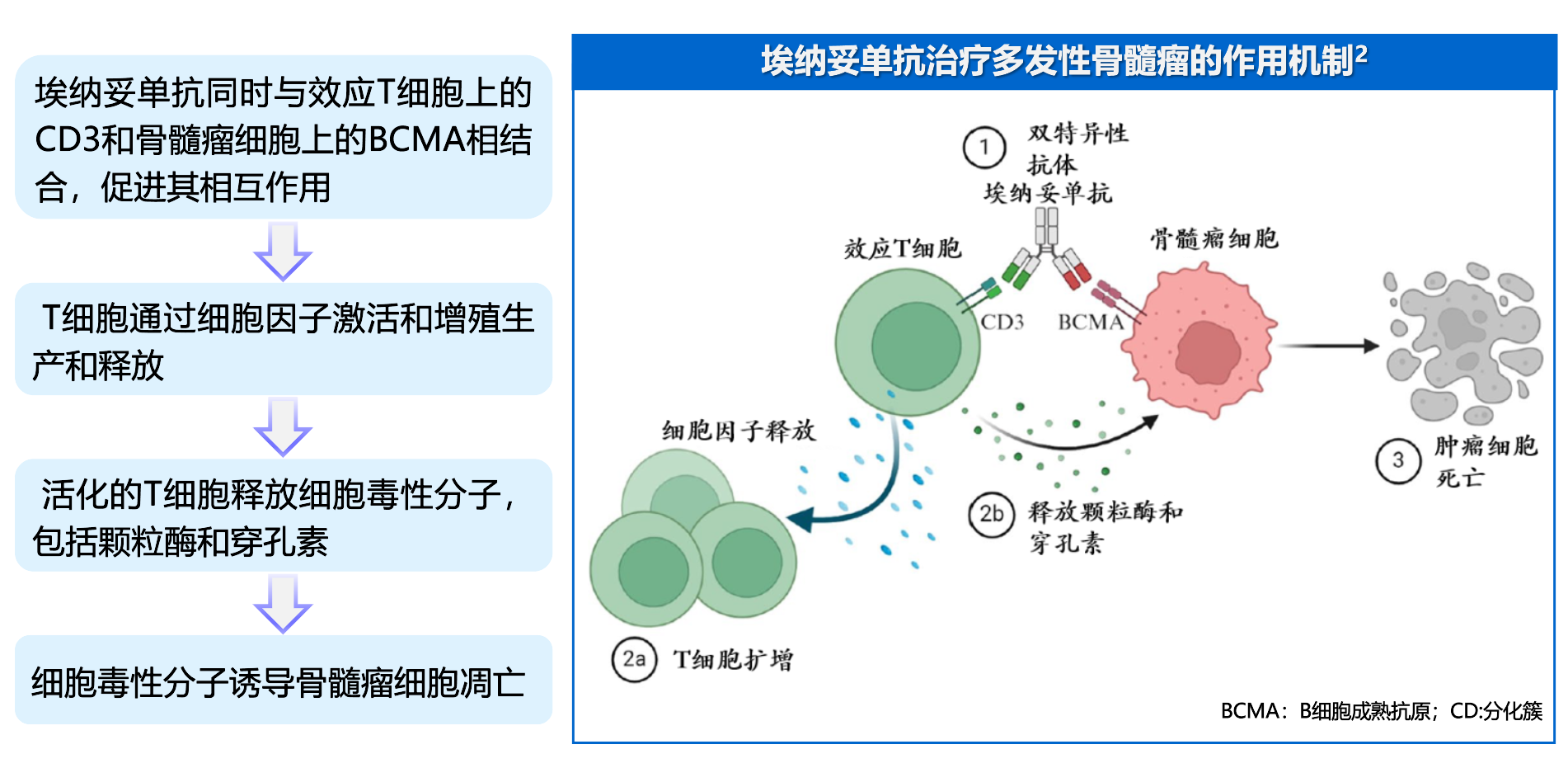
根据递增剂量给药方案通过皮下注射给予本品,以降低细胞因子释放综合征(CRS)的发生率和严重程度。
在本品递增剂量给药方案(包括递增剂量1 、递增剂量2 和推荐的首次治疗剂量)的每次给药之前,给予治疗前用药。
本品只能由具有资质的医疗保健专业人员在适当的医疗支持下使用,以降低潜在的严重反应风险,如CRS 和包括免疫效应细胞相关性神经毒性综合征(ICANS)在内的神经毒性。
由于存在发生CRS 的风险,患者在接受本品给药时,应在递增剂量1 给药后住院观察48 小时,以及递增剂量2 给药后住院观察24 小时。
仅限皮下注射。
本品皮下注射的推荐剂量为:第1 天12 mg 的递增剂量1、第4 天32 mg 的递增剂量2,第8 天首次治疗剂量76 mg ,随后每周76mg 至第24 周。
对于接受至少24 周本品治疗,且达到缓解(部分缓解或更好)维持至少2 个月的患者,给药间隔应转换为每两周一次。
继续进行本品治疗,直至出现疾病进展或不可接受的毒性。
在本品递增剂量给药方案(包括递增剂量1 、递增剂量2 和推荐的首次全治疗剂量)的每次给药之前,给予治疗前用药。
表1.埃纳妥单抗给药方案 (仅限皮下注射)1
| 给药方案 | 天 | 剂量 | |
|---|---|---|---|
| 递增剂量给药 | 第 1 天 a | 递增剂量 1 | 12 mg |
| 第 4 天 a,b | 递增剂量 2 | 32 mg | |
| 第 8 天 a,c | 首次治疗剂量 | 76 mg | |
| 每周一次给药方案 | 首次治疗剂量一周之后 至第 24 周每周一次 d | 首次和后续治疗剂量 | 76 mg |
两周一次给药方案 *缓解者仅从第25周开始 | 第 25 周以及 之后每两周一次 d | 后续治疗剂量 | 76 mg |
a.在本品递增剂量给药方案(包括递增剂量1 、递增剂量2 和首次全剂量治疗)的每次给药之前,给予治疗前用药。
b.在递增剂量1(12 mg)和递增剂量2(32 mg)之间,应至少间隔2 天。
c.在递增剂量2(32 mg)和首次全治疗(76 mg)剂量之间,应至少间隔3 天。
d.两次给药之间应间隔至少6 天。
推荐的治疗前用药
在表1 列示的本品递增剂量给药方案包含三次给药:包括递增剂量1 、递增剂量2 和首次治疗剂量每次给药前约1 小时给予以下治疗前用药,以降低CRS 风险:
- 对乙酰氨基酚(或等效药物)650 mg 口服
- 地塞米松(或等效药物)20 mg 口服或经静脉给药
- 苯海拉明(或等效药物)25 mg 口服
表2. 延迟给药后重新开始本品治疗的建议1
| 上一次给药 | 距离上一次给药的延迟持续时间 | 下次给药措施 |
|---|---|---|
递增剂量 1 (12 mg) | 2 周或以下(≤14 天) | 以递增剂量 2(32 mg)重新开始本品给药a。如果耐受,在 4 天后增加至 76 mg。 |
| 超过 2 周(>14 天) | 以递增剂量 1(12 mg)重新开始本品递增剂量给药方案a。 | |
递增剂量 2 (32 mg) | 2 周或以下(≤14 天) | 以 76 mg 重新开始本品给药a。 |
| 超过 2 周至小于或等于 4 周(15 天至≤28 天) | 以递增剂量 2(32 mg)重新开始本品给药a。如果耐受,在 1 周后增加至 76 mg。 | |
| 超过 4 周(>28 天) | 以递增剂量 1(12 mg)重新开始本品递增剂量给药方案a。 | |
任何治疗剂量 (76 mg) | 6 周或以下(≤42 天) | 以76 mg重新开始本品给药。 |
| 超过 6 周至小于或等于 12 周(43 天至≤84 天)b | 以递增剂量 2(32 mg)重新开始本品给药a。如果耐受,在 1 周后增加至 76 mg。 | |
| 超过 12 周 (>84 天)b | 以递增剂量 1(12 mg)重新开始本品递增剂量给药方案a。 |
a. 在本品给药前给予治疗前用药。
b. 对于因不良反应需要延迟给药超过42 天的患者,应评估重新开始本品治疗的获益和风险。
不建议减少本品的剂量。
可能需要延迟给药以管理与本品相关的毒性。延迟给药后重新开始本品给药的建议见表2。
应对CRS 和ICANS 不良反应的推荐措施分别见表3 和表4。给药后针对神经毒性(ICANS 除外)的推荐措施见表5,针对其他不良反应的推荐措施见表6。应根据现行实践指南考虑给予更多管理措施。
表3. CRS 管理建议1
| 分级a | 出现症状 | 措施 |
|---|---|---|
| 1 级 | 体温 ≥ 38°Cb | •暂停本品给药,直至 CRS 消退。c •在下次本品给药前,给予治疗前用药。 |
| 2 级 | 体温 ≥ 38°C,其中: •补液治疗有效且不需要血管加压药的低血压,和/或 •需要低流量鼻导管供氧d或吹氧疗法 | •暂停本品给药,直至 CRS 消退。c •在下次本品给药后 48 小时内,每日监测患者。告知患者留在医疗机构附近,并考虑住院监测。 |
| 3 级 (首次发生) | 体温 ≥ 38°C,其中: •需要使用一种血管加压药(含或不含血管加压素)的低血压,和/或 •需要高流量鼻导管d、氧气面罩、非重复呼吸面罩或文丘里面罩供氧 | •暂停本品给药,直至 CRS 消退。c •提供支持治疗,可能包括重症监护。 •在下次本品给药后患者应住院 48 小时。 •在下次本品给药前,给予治疗前用药。 |
| 3 级(复发) | 体温 ≥ 38°C,其中: •需要一种血管加压药(含或不含血管加压素)的低血压,和/或 •需要高流量鼻导管d、氧气面罩、非重复呼吸式面罩或文丘里面罩供氧 | •永久停止本品治疗。 •提供支持治疗,可能包括重症监护。 |
| 4 级 | 体温 ≥ 38°C,其中: •需要多种血管加压药(不包括血管加压素)的低血压,和/或 •需要正压通气(例如持续气道正压通气 [CPAP]、双向气道正压通气 [BiPAP]、插管和机械通气)供氧 | •永久停止本品给药。 •提供支持治疗,可能包括重症监护。 |
a. 基于美国移植和细胞治疗学会(ASTCT)2019 CRS 分级标准。
b. 归因于CRS。发热不一定伴随低血压或缺氧,因为退热剂或抗细胞因子疗法等干预措施可能会掩盖发热。
c. 延迟给药后重新开始本品给药的建议见表2。
d. 低流量鼻导管≤ 6 L/min,高流量鼻导管> 6 L/min。
表4. ICANS 管理建议1
| 分级a | 出现症状b | 措施 |
|---|---|---|
| 1 级 | ICE 评分 7-9分c 或意识水平下降d:可自然苏醒。 | •暂停本品给药,直至 ICANS 消退。e •监测神经系统症状,并考虑神经科医生和其他专家会诊,以进行进一步评估和管理。 •考虑使用非镇静类抗癫痫药物(例如左乙拉西坦)预防癫痫发作。 |
| 2 级 | ICE 评分 3-6分c 或意识水平下降d:声音唤醒。 | •暂停本品给药,直至 ICANS 消退。e •每 6 小时经静脉给予地塞米松f 10 mg。持续使用地塞米松,直至缓解至≤ 1 级,然后逐渐减量。 •监测神经系统症状,并考虑神经科医生和其他专家会诊,以进行进一步评估和管理。 •考虑使用非镇静类抗癫痫药物(例如左乙拉西坦)预防癫痫发作。 •在下次本品给药后 48 小时内,每日监测患者。告知患者留在医疗机构附近,并考虑住院。 |
| 3 级 (首次发生) | ICE 评分 0-2分c 或意识水平下降d:仅触觉刺激才能唤醒, 或癫痫发作d,表现为以下任一情况: •迅速消退的任何局灶性或全身性临床癫痫发作,或 •脑电图(EEG)显示非惊厥性癫痫发作,可在干预后消退, 或颅内压升高:神经影像学显示局灶性/局部水肿d | •暂停本品给药,直至 ICANS 消退。e •每 6 小时经静脉给予地塞米松f 10 mg。持续使用地塞米松,直至缓解至≤ 1 级,然后逐渐减量。 •监测神经系统症状,并考虑神经科医生和其他专家会诊,以进行进一步评估和管理。 •考虑使用非镇静类抗癫痫药物(例如左乙拉西坦)预防癫痫发作。 •提供支持治疗,可能包括重症监护。 •在下次本品给药后 48 小时内,患者应住院监测。 |
| 3 级 (复发) | ICE 评分 0-2分c 或意识水平下降d:只有触觉刺激才能唤醒, 或惊厥发作d,以下任一情况: •任何快速缓解的临床惊厥发作(局灶性或全身性),或 •脑电图(EEG)显示的干预后缓解的非惊厥性癫痫发作, 或颅内压升高:神经影像学显示局灶性/局部水肿d | •永久终止本品治疗。 •每 6 小时经静脉给予地塞米松f 10 mg。持续使用地塞米松,直至缓解至 ≤1 级,然后逐渐减量。 •监测神经系统症状,并考虑神经科医生和其他专家会诊,以进行进一步评估和管理。 •考虑使用非镇静类抗癫痫药物(例如左乙拉西坦)预防癫痫发作。 •提供支持治疗,可能包括重症监护。 |
| 4 级 | ICE 评分 0分c 或者以下任一情况的意识水平下降d: •患者无法唤醒或需要强烈或反复的触觉刺激才能唤醒,或 •木僵或昏迷, 或癫痫发作d,表现为以下任一情况: •危及生命的持续性癫痫发作(> 5 分钟),或 •反复临床或脑电图显示的癫痫发作,两次发作之间未恢复至基线水平, 或发现运动功能改变d: •深部局灶性运动无力,如轻偏瘫或下肢轻瘫, •或颅内压升高/脑水肿d,伴有以下体征/症状: •神经影像学检查显示弥漫性脑水肿,或 •去大脑或去皮质体位,或 •第 VI 颅神经麻痹,或 •视神经乳头水肿,或 •库欣三联征。 | •永久终止本品治疗。 •每 6 小时经静脉给予地塞米松f 10 mg。持续使用地塞米松,直至缓解至≤ 1 级,然后逐渐减量。 •或者,可考虑每天静脉给予甲泼尼龙 1000 mg,持续 3 天。 •监测神经系统症状,并考虑神经科医生和其他专家会诊,以进行进一步评估和管理。 •考虑使用非镇静类抗癫痫药物(例如左乙拉西坦)预防癫痫发作。 •提供支持治疗,可能包括重症监护。 |
a. 基于美国移植和细胞治疗学会(ASTCT)2019 ICANS 分级标准。
b. 管理措施由无法归因于任何其他原因的最严重的事件确定。
c. 如果患者可被唤醒且能够进行免疫效应细胞相关脑病(ICE)评估,评估:常识(确定年份、月份、城市、医院,得分为4 分);命名能力(命名3 个物体,例如钟表、钢笔、按钮,得分为3 分);遵从指令(例如,“伸出2 个手指”或“闭上眼睛并伸出舌头”,得分为1 分);书写能力(书写标准句子的能力,得分为1 分);和注意力(从100 开始倒数,每次减10,得分为1 分)。如果患者不可唤醒且无法进行ICE 评估(4 级ICANS),则得分为0 分。
d. 不可归因于任何其他原因。
e. 延迟给药后重新开始本品给药的建议见表2。f. 本表中提及的所有地塞米松给药均为地塞米松或等效药物。
表5. 神经毒性(ICANS 除外)的管理建议1
| 不良反应 | 严重程度 | 措施 |
|---|---|---|
神经毒性(ICANS除外) | 1级 | •暂停本品治疗,直至神经毒性症状消退或稳定。 |
2级 3级(首次发生) | • 暂停本品治疗,直至神经毒性症状改善至 ≤1 级。 • 提供支持治疗。 | |
3级(复发) 4级 | •永久终止本品治疗。 •提供支持治疗,可能包括重症监护。 |
表6. 针对其他不良反应的推荐剂量调整1
| 不良反应 | 严重程度 | 措施 |
|---|---|---|
| 血液学不良反应 | 中性粒细胞绝对计数低于 0.5 x 109/L | 暂停本品给药,直至中性粒细胞绝对计数≥ 0.5 x 109/L 。b |
| 发热性中性粒细胞减少症 | 暂停本品给药,直至中性粒细胞绝对计数 ≥1 x 109/L ,发热消退。b | |
| 血红蛋白低于 8 g/dL | 暂停本品给药,直至血红蛋白≥ 8 g/dL 。b | |
血小板计数小于 25,000/mcL 血小板计数在 25,000/mcL 和 50,000/mcL 之间,伴有出血 | 暂停本品给药,直至血小板计数≥ 25,000/mcL且无出血迹象。b | |
| 暂停本品给药,直至血小板计数≥ 25,000/mcL且无出血迹象。b | ||
| 感染和其他非血液学不良反应a | 3级 | 暂停本品给药,直至不良反应缓解至 ≤ 1 级或基线水平。b |
| 4级 | 考虑永久终止本品治疗。 如果未永久终止本品治疗,则暂停本品后续治疗剂量给药(例如,在本品递增剂量给药方案后的给药),直至不良反应缓解至 ≤1 级。 |
a. 基于美国国家癌症研究所不良事件通用术语标准(NCI-CTCAE)5.0 版而定。
b. 给药延迟后重新开始本品给药的建议见表2。
根据年龄(36-89岁)、性别、种族(白人、亚裔或黑人)、体重(37-160kg)、轻度或中度肾功能损害(根据调整肾病患者饮食[MDRD] 方法估计肾小球滤过率[eGFR] 为30至89 mL/min)或轻度肝功能损害(总胆红素1至≤ 1.5×ULN或任何大于ULN的AST)划分的特殊人群中,未观察到埃纳妥单抗的药代动力学存在临床显著差异。1
轻度肝功能损害患者(总胆红素> 1 至1.5 × ULN 和任何AST;或总胆红素≤ULN 且AST > ULN)无需调整剂量。1
轻度或中度肾功能损害患者(即估计肾小球滤过率[eGFR] > 30 mL/min/1.73 m2)不建议调整剂量,重度肾功能损害患者现有数据较少。1
老年患者无需调整剂量。 1
尚未在儿童患者中使用埃纳妥单抗治疗多发性骨髓瘤。 1
对活性成分或列出的任一辅料过敏者。1
对于某些CYP底物,浓度微小的变化也可能会导致严重不良反应。在与本品联合给药时,应监测这些CYP底物药物的浓度或毒性。
本品导致细胞因子释放,其可抑制细胞色素P450(CYP)酶的活性,从而导致CYP底物的暴露量增加。CYP底物暴露的增加更有可能发生在第1天首剂本品给药后和第4天32 mg 剂量给药后的14天内以及CRS 期间和之后 。1
本品仅供专业医护人员皮下使用。
本品应由具备足够医疗资格和适当医疗设备的专业医护人员给药,以管理重度反应,包括CRS 和神经毒性(包括ICANS)。
本品为76 mg (1.9 mL) /瓶和44 mg (1.1 mL) /瓶装即用型溶液,给药前无需稀释。
本品是澄清至轻微乳白色、无色至浅棕色的液体溶液。如果溶液和容器允许,在给药前应肉眼检查肠外药品有无不溶性微粒和变色。如果溶液变色或含有不溶性微粒,请勿给药。
采用无菌技术制备和注射本品。
【制备】1
本品小瓶供单个患者一次性使用,不含任何防腐剂。
根据所需剂量,按照以下说明(见表7)制备本品。递增剂量1 或递增剂量2 使用44 mg (1.1 mL) /瓶单次给药药瓶。
表7. 注射量1
| 总剂量(mg) | 注射量 |
|---|---|
| 12mg | 0.3ml |
| 32mg | 0.8ml |
| 76mg | 1.8ml |
将相应规格本品的小瓶从冷藏2°C-8°C 条件下取出。取出后,将本品平衡至室温(15°C-30°C)。请勿通过其他任何方式加热本品。
使用不锈钢注射针头(30 号或以上)和聚丙烯或聚碳酸酯材质注射器将所需的本品注射量从小瓶中抽取到适当大小的注射器中。丢弃未使用的部分。
【给药】1
在腹部皮下组织(首选注射部位)注射所需剂量的本品。或者,可将本品注射到其他部位(例如大腿)的皮下组织中。
不要注射到纹身、疤痕或皮肤发红、擦伤、触痛、坚硬或破损的部位。
【制备后注射器的储存】1
如果制备后的注射器不立即使用,应将注射器储存在2 °C 至30 °C 的温度下最多4 小时。
【贮藏】1
在原始包装中避光冷藏(2-8℃)储存。
不得冷冻或振摇药瓶或纸盒。
【有效期】1
44 mg (1.1 mL) /瓶:36 个月。
76 mg (1.9 mL) /瓶:36 个月。
MagnetisMM-3研究1
2023《Nat Med》杂志
Elranatamab in relapsed or refractory multiple myeloma: phase 2 MagnetisMM-3 trial results
2024《Br J Haematol》杂志
Impact of elranatamab on quality of life: Patient-reported outcomes from MagnetisMM-3
2024《Future Oncol》杂志
2025《BMC Cancer》杂志
2025《J Comp Eff Res》杂志
2025《BMC Cancer》杂志
如需核心研究原文,请您联系辉瑞医学信息部: [email protected], 或通过辉瑞医学信息网站在线提问获取。
2024 ASH会议
2025 EHA会议
2025 IMS会议
研究设计1
一项开放性、非随机、多中心、II 期研究(MagnetisMM-3)在复发或难治性多发性骨髓瘤患者中评估了埃纳妥单抗单药治疗的疗效。
该研究纳入了对至少一种蛋白酶体抑制剂(PI)、一种免疫调节剂(IMiD)和一种抗CD38 单克隆抗体难治的患者。
MagnetisMM-3 包括123 例既往未接受过BCMA 靶向治疗的初治患者(关键性队列A)和64 例既往接受过BCMA 靶向抗体偶联药物(ADC)或嵌合抗原受体(CAR)T 细胞治疗的患者(支持性队列B)。
根据国际骨髓瘤工作组(IMWG)标准, 患者在入组时确定有可测量疾病。
研究纳入的患者美国东部肿瘤协作组(ECOG)评分≤ 2 分,并且有充分的基线骨髓功能(中性粒细胞绝对计数≥ 1.0 x 109/L,血小板计数≥ 25 x 109/L,血红蛋白水平≥ 8 g/dL)、肾功能(CrCL ≥ 30 mL/min)、肝功能(天门冬氨酸氨基转移酶[AST] 和丙氨酸氨基转移酶[ALT] ≤ 2.5 ×正常上限[ULN],总胆红素≤ 2 × ULN)以及左心室射血分数≥ 40% 的患者。
研究排除了患有冒烟型多发性骨髓瘤、活动性浆细胞白血病、淀粉样变性、POEMS(多发神经病、脏器肿大、内分泌病、单克隆浆细胞异常、皮肤变化)综合征、在入组前12 周内接受干细胞移植、存在活动性感染、有临床意义的神经病变和心血管疾病的患者。
患者按照递增剂量方案接受本品皮下给药,即治疗第1 天接受12 mg 和第4 天接受32 mg,然后在治疗第8 天接受埃纳妥单抗(76 mg)首次完整治疗剂量。此后,患者接受76 mg 每周一次给药。24 周后,对于达到部分缓解或更好(IMWG定义)且缓解持续至少2 个月的患者,给药频率从每周一次改为每2 周一次。
基线特征1
在关键性队列A 中,接受治疗的123 例患者的中位年龄为68 岁(范围:36 - 89岁),其中19.5% 的患者年龄≥ 75 岁。
- 进入研究时的疾病分期(RISS)如下:22.8% 为I 期,55.3% 为II 期,15.4% 为III 期。
- 从多发性骨髓瘤初始诊断到入组的中位时间为72.9 个月(范围:16 - 228 个月)。
- 患者的中位既往治疗线数为5(范围:2 - 22),96.0% 的患者既往接受过≥ 3 线治疗。
- 96.7%的患者为三药难治,95.9% 的患者对末线治疗难治。
- 68.3% 的患者既往接受过自体干细胞移植,5.7% 的患者既往接受过异体干细胞移植。
- 25.2% 的患者存在高危细胞遗传学特征[存在t(4;14)、t(14;16) 或del(17p)]。
- 根据基线时的盲态独立中心审查委员会(BICR)审查结果,31.7% 的患者患有髓外疾病[存在任何浆细胞瘤(髓外和/或髓旁)伴软组织成分]
疗效数据1
疗效结果:由BICR 根据IMWG 标准评估的缓解率和持续缓解时间(DOR)确定,关键性队列A 的疗效结果详见下表。
- 缓解患者自首次给药的中位(范围)随访时间为15.2 (2.4, 24.2) 个月。
表8. MagnetisMM-3 中关键性队列A 的疗效结果1
| 未接受过 BCMA 靶向治疗的患者(关键性队列 A) | |
|---|---|
| 所有接受治疗的患者 (N = 123) | |
客观缓解率(ORR: sCR+CR+VGPR+PR) n (%) (95% CI) |
75 (61.0%) (51.8, 69.6) |
| 严格意义的完全缓解 (sCR) | 19 (15.4%) |
| 完全缓解 (CR) | 25 (20.3%) |
| 非常好的部分缓解 (VGPR) | 25 (20.3%) |
| 部分缓解 (PR) | 6 (4.9%) |
完全缓解率 (sCR + CR), n (%) (95% CI) | 44 (35.8%) (27.3, 44.9) |
至首次缓解时间(月) 缓解患者人数 中位数 范围 |
75 1.22 (0.9, 7.4) |
持续缓解时间 (DOR)(月) 缓解患者人数 中位数 (95% CI) 6 个月时比率 (95% CI) 9 个月时比率 (95% CI) 12 个月时比率 (95% CI) 15 个月时比率 (95% CI) |
75 NE (NE, NE) 89.1 (79.5, 94.4) 80.7 (69.5, 88.1) 74.3 (62.3, 83.0) 70.8 (58.2, 80.2) |
达到 CR 或 sCR 并可评估 MRD 的患者中 MRD 阴性率a (达到 CR/sCR 的 44 例患者中有 29 例可评估 MRD) n (%) 95% CI (%) |
26 (89.7%) (72.7, 97.8) |
缩略词:CI = 置信区间;NE = 不可估计;MRD = 微小残留病灶。
a.采用二代测序 clonoSEQ 测定法 (Adaptive Biotechnologies),阈值为 10-5。
最常见的不良反应包括CRS (57.9%)、贫血(54.1%)、中性粒细胞减少症(44.8%)、疲劳(44.3%)、上呼吸道感染(38.8%)、注射部位反应(38.3%)、腹泻(37.7%)、感染性肺炎(37.2%)、血小板减少症(36.1%)、淋巴细胞减少症(30.1%)、食欲减退(26.8%)、发热(27.3%)、皮疹(26.2%)、关节痛(25.1%)、低钾血症(23.0%)、恶心(21.3%) 和皮肤干燥(21.3%)。
严重不良反应包括感染性肺炎(30.6%)、脓毒症(15.3%)、CRS (12.6%)、贫血(5.5%)、上呼吸道感染(4.9%)、尿路感染(3.3%)、发热性中性粒细胞减少症(2.7%)、呼吸困难(2.2%) 和发热(2.2%) 。 1
警示语: 细胞因子释放综合征和包括免疫效应细胞相关性神经毒性综合征在内的神经毒性1
接受本品治疗的患者可能发生细胞因子释放综合征(CRS),包括危及生命或致死性反应。本品采用递增剂量给药方案开始治疗,以降低CRS 的发生风险。根据严重程度暂停本品给药,直至CRS 消退或永久停药。
接受本品治疗的患者可能发生神经毒性,包括免疫效应细胞相关性神经毒性综合征(ICANS)以及严重和危及生命的反应。治疗期间监测患者是否出现神经毒性(包括ICANS)体征和症状。根据严重程度暂停本品给药,直至神经毒性消退或永久停药。
分级是指不良事件的严重程度。CTCAE 基于下述的基础准则对每个不良事件的严重程度(1级至5级)作了特定的临床描述 :3
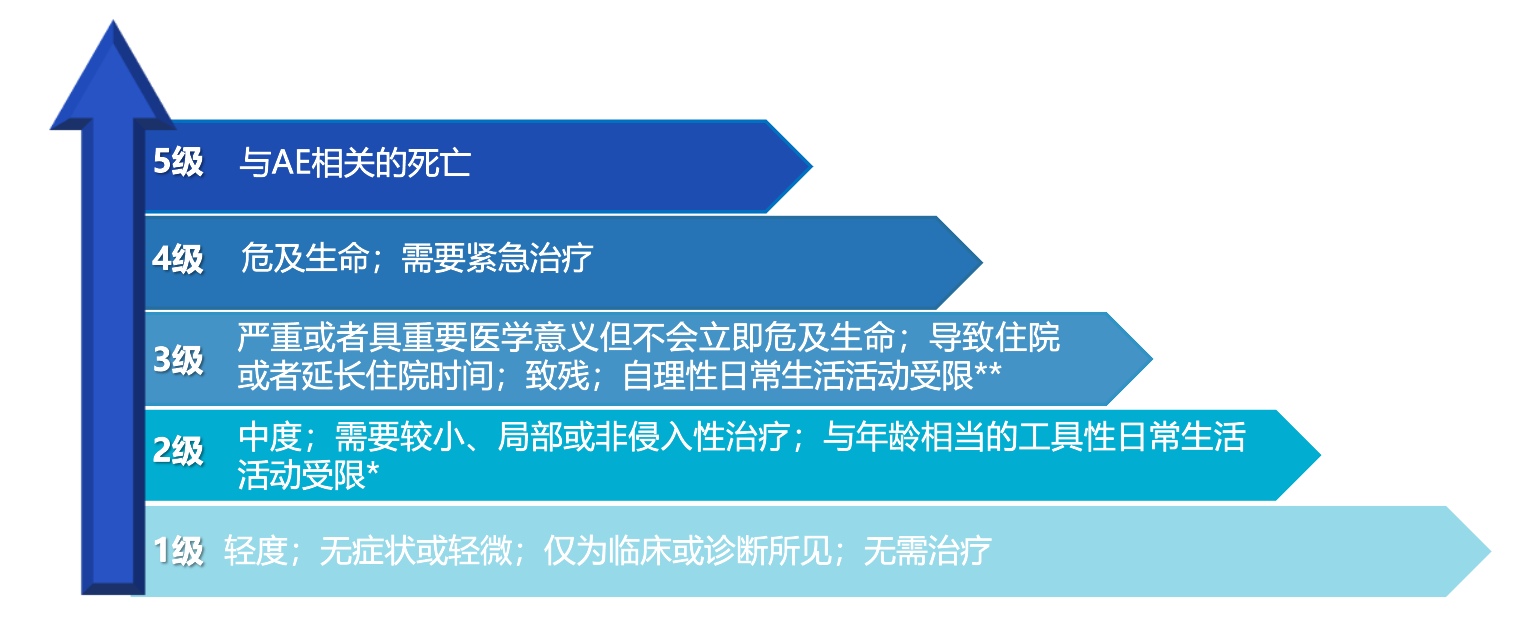
* 工具性日常生活活动指做饭、购买衣物、使用电话、理财等。
** 自理性日常生活活动指洗澡、穿脱衣、吃饭、盥洗、服药等,并未卧床不起。
细胞因子释放综合征(CRS)和免疫效应细胞相关性神经毒性综合征(ICANS)分级基于美国移植和细胞治疗学会(ASTCT)2019 分级标准 。4
表9. CRS分级(ASTCT标准) 4
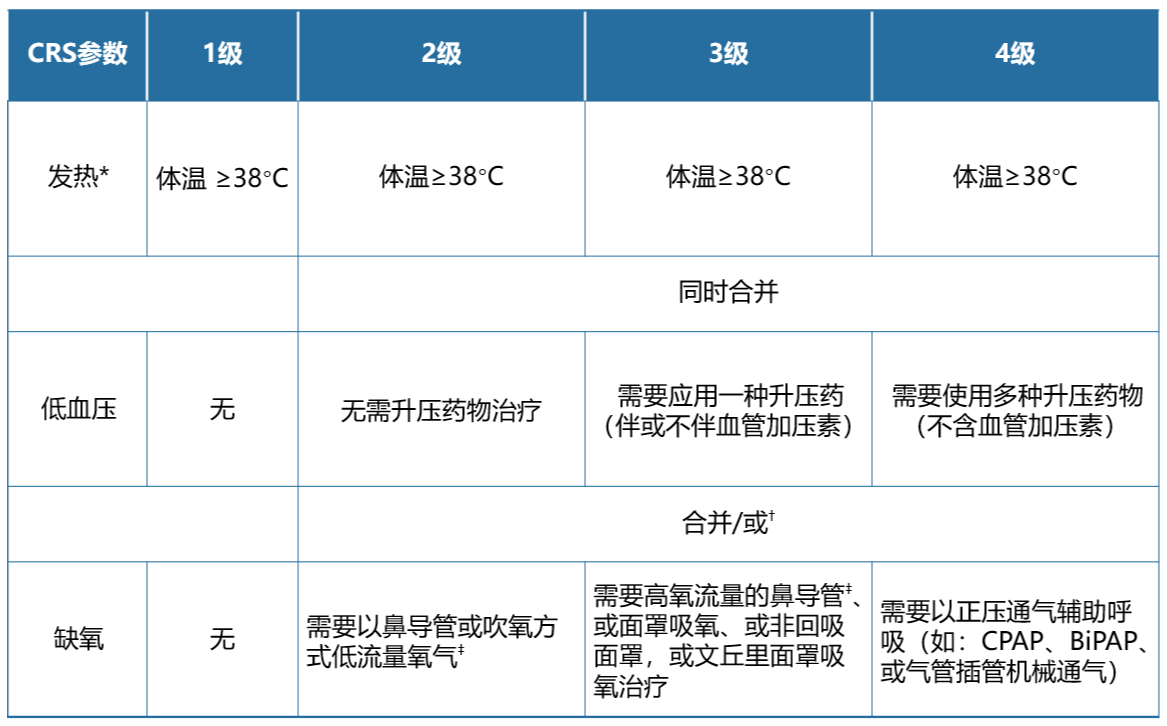
BiPAP = 双水平正压通气;CPAP = 持续气道正压通气;CRS = 细胞因子释放综合征
⁎ 发热定义为体温≥ 38°C,不能归因于任何其他原因。在发生CRS并接受解热或抗细胞因子治疗 (例如,托珠单抗或类固醇)的患者中,不再需要按照发热对后续CRS严重程度进行分级。在这种情况下,CRS分级取决于低血压和/或缺氧。
† CRS等级由严重程度最高的事件决定:低血压或缺氧,不可归因于任何其他原因。例如,体温为 39.5°C、合并有需要一种血管升压药的低血压和需要低流量鼻导管给氧的缺氧患者被分级为3级CRS。
‡ 低流量鼻导管给氧定义为以≤ 6 L/min的速率输送氧气。低流量给氧还包括吹气给氧,有时用于儿童。高流量鼻导管给氧定义为以≥ 6 L/min的速率输送氧气。
表10. ICANS分级(ASTCT标准) 4
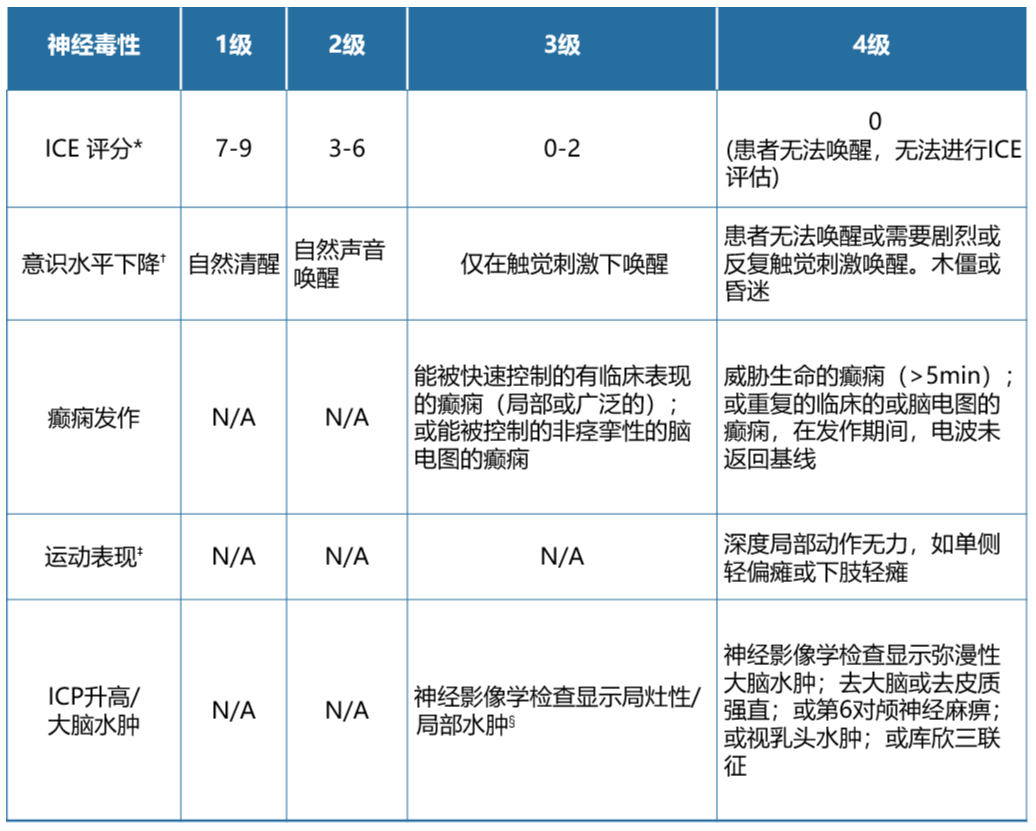
ICE=免疫效应细胞相关脑病;ICP=颅内压;N/A=不适用。ICANS分级由无法归因于任何其他原因的最严重事件(ICE评分、意识水平、惊厥发作、运动异常、ICP升高/大脑水肿)决定;例如,ICE评分为3的全身性惊厥发作患者归类为3级ICANS
⁎对于ICE评分为0分的患者:若患者是清醒的,且为完全性失语,ICANS则为3级;若患者无法被唤醒,ICANS则为4级
†不能归因于其他原因的意识水平下降(例如,未使用镇静药物)。
‡可能会根据CTCAE v5.0对免疫效应细胞治疗相关震颤和肌阵挛进行分级,但并不会影响ICANS的分级。
§无论是否合并脑水肿,颅内出血均不属于神经毒性特征,且不用于 ICANS 分级。可以根据CTCAE(5.0版)标准对其进行分级。
按推荐给药方案接受本品治疗的患者中有57.9% 发生CRS,其中1 级,2级和3级CRS发生率分别为43.7% ,13.7%和0.5%。大多数患者在首次剂量递增给药(43.2%) 或第二次剂量递增给药(19.1%) 后发生CRS,而7.1% 的患者在接受首次完整治疗剂量后发生CRS,1.6% 的患者在后续给药后发生。在发生CRS 的患者中,相关症状包括发热(99.0%)、低血压(21.0%) 和缺氧(11.4%) 。
从最近一次给药后到发生CRS 的中位时间为2 天(范围:1 - 9 天),中位持续时间为2 天(范围:1 - 19 天)。1
处理策略1:
- 应根据剂量递增给药方案开始治疗,以降低CRS 的风险,并在本品给药后对患者进行相应的监测。在前三剂给药前应给予治疗前药品,以降低CRS 的风险。
- 应指导患者在出现CRS 体征或症状时立即就医。
- 在患者首次出现CRS 体征时,应暂停本品,并应立即评估患者是否应住院。应根据说明书建议管理CRS,并应根据当地机构指南考虑给予更多措施。
- 应酌情给予CRS 支持治疗(包括但不限于退热药、支持性静脉补液、血管加压药、IL-6 或IL-6 受体抑制剂、补充氧气等)。
- 应考虑进行实验室检查,以监测弥漫性血管内凝血(DIC)、血液学参数以及肺、心脏、肾脏和肝功能。
本品治疗后可能发生严重或危及生命的神经毒性,包括免疫效应细胞相关性神经毒性综合征(ICANS)。 1
按推荐给药方案接受本品治疗后,3.3% 的患者发生了 ICANS,其中1级,2级和3级ICANS发生率分别为0.5%,1.6% 和1.1% 。大多数患者在首次递增剂量给药后发生ICANS (2.7%),1 例(0.5%) 患者在第二次递增剂量给药后发生ICANS,1 例(0.5%) 患者在后续给药后发生。1.1% 的患者出现ICANS 复发。从最近一次给药后到ICANS 复发的中位时间为3 天(范围:1 - 4 天),中位持续时间为2 天(范围:1 - 18 天)。 1
ICANS 可能与CRS 同时发生,也可能在CRS 消退后或不存在CRS 的情况下发生。ICANS 最常见的症状包括意识水平下降和1 级或2 级免疫效应细胞相关脑病(ICE) 评分。 1
处理策略1:
- 在治疗期间,应监测患者是否出现神经毒性的体征和症状。
- 应指导患者在出现神经毒性体征或症状时立即就医。
- 在首次出现神经毒性(包括ICANS)体征时,应暂停本品给药,并应考虑进行神经学评估。神经毒性(包括ICANS)的一般管理总结详见说明书。
- 由于可能出现ICANS,应建议患者在递增剂量给药方案期间、完成2 步递增剂量方案每次给药后48 小时内以及在新发任何神经系统症状时,不要驾驶或操作重型或有潜在危险的机械。
感染是埃纳妥单抗治疗期间常见的不良事件之一,MagnetisMM-3 中接受本品治疗的183名患者数据显示,上呼吸道感染发生率38.8%(3/4级:5.5%)、感染性肺炎发生率37.2% (3/4级:24.6%) ,脓毒症发生率18.8%(3/4级:12.6%) 、尿路感染发生率12.6% (3/4级:4.4%) 。 1
处理策略1:
- 有活动性感染的患者不得开始治疗。在使用本品治疗前和治疗期间,应监测患者的感染体征和症状,并进行适当治疗。
- 对于其他非血液学不良反应,应按说明书用法用量所示,基于感染的严重程度暂停本品给药。
- 应根据当地机构指南给予预防性抗菌药物(例如预防耶氏肺孢子虫肺炎)和抗病毒药物(例如预防带状疱疹再激活)。
接受本品治疗的患者报告了中性粒细胞减少症和发热性中性粒细胞减少症,其中,中性粒细胞减少症发生率44.8%,发热性中性粒细胞减少症发生率2.7% 。1
处理策略1:
- 应在基线时以及治疗期间定期监测全血细胞计数。如发生说明书所示的血液学不良事件应暂停本品治疗。
- 应监测中性粒细胞减少症患者的感染体征。
- 应根据当地机构指南提供支持治疗。
接受本品治疗的患者报告了低丙种球蛋白血症,发生率为14.2%,其中3/4级2.7% 。1
处理策略1:
- 治疗期间应监测免疫球蛋白水平。如果IgG 水平低于400 mg/dL,应考虑皮下或静脉注射免疫球蛋白(IVIG) 治疗,并应根据当地机构指南治疗患者(包括感染预防措施和抗菌药物预防治疗)。
尚未研究在本品治疗期间或治疗后免疫接种活病毒疫苗的安全性。
在首次给药前4 周内、治疗期间以及治疗后至少4 周内不建议接种活病毒疫苗 。1
- NCCN临床实践指南:多发性骨髓瘤
Practical guidance on the prevention and management of infection in multiple myeloma patients: A case-based approach
2025 EHA-EMN 循证指南:多发性骨髓瘤诊断,治疗及随访
EHA–EMN Evidence-Based Guidelines for diagnosis, treatment and follow-up of patients with multiple myeloma
International Myeloma Society/International Myeloma Working Group Consensus Recommendations on the Definition of High-Risk Multiple Myeloma
2025 EMN实用建议:优化多发性骨髓瘤患者的T细胞免疫治疗
Optimising T-cell immunotherapy in patients with multiple myeloma: practical considerations from the European Myeloma Network
2025 IMWG免疫治疗委员会关于多发性骨髓瘤免疫治疗顺序的建议
International myeloma working group immunotherapy committee recommendation on sequencing immunotherapy for treatment of multiple myeloma
2024 IMWG 免疫治疗委员关于T细胞衔接器治疗多发性骨髓瘤最佳应用共识指南
International Myeloma Working Group immunotherapy committee consensus guidelines and recommendations for optimal use of T-cell-engaging bispecific antibodies in multiple myeloma
2023 EMN专家共识:多发性骨髓瘤双特异性抗体及CAR-T细胞治疗期间不良事件的预防和管理
Prevention and management of adverse events during treatment with bispecific antibodies and CAR T cells in multiple myeloma: a consensus report of the European Myeloma Network
2023 专家共识建议:接受双特异性抗体治疗的多发性骨髓瘤患者感染的监测、预防和治疗
Monitoring, prophylaxis, and treatment of infections in patients with MM receiving bispecific antibody therapy: consensus recommendations from an expert panel
2021 EHA-ESMO多发性骨髓瘤诊断,治疗及随访临床实践指南
Multiple myeloma: EHA-ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up
- 中国首次复发多发性骨髓瘤诊治指南(2022年版)
- 中国肿瘤整合诊治指南(CACA)多发性骨髓瘤-英文版(V1.0_2024)
- 中国多发性骨髓瘤诊治指南(2024年修订)
- 多发性骨髓瘤骨病临床诊疗指南(2024年版)
- 多发性骨髓瘤肾损伤诊治指南(2024版)
- 多发性骨髓瘤疗效评估与微小残留病监测中国指南(2024年版)
- 高危多发性骨髓瘤诊断与治疗中国专家共识(2024年版)
- 基于骨髓样本的多发性骨髓瘤微小残留病检测中国专家共识(2024年版)
- 多发性骨髓瘤全身磁共振成像检查专家共识
- 中国髓外浆细胞瘤诊断与治疗专家共识(2024年版)
- 多发性骨髓瘤患者门诊管理标准流程中国专家共识(2025年版)
- BCMA双特异性T细胞接合器治疗多发性骨髓瘤中国临床专家共识(2025版)
1.埃纳妥单抗注射液说明书.
2.Saied G, Halford Z. Engaging a New Treatment Paradigm: Elranatamab in Relapsed/Refractory Multiple Myeloma. Ann Pharmacother. 2025 May;59(5):473-484.
3.常⻅不良事件评价标准(CTCAE)5.0 版.
4.Lee DW, Santomasso BD, Locke FL, et al. ASTCT Consensus Grading for Cytokine Release Syndrome and Neurologic Toxicity Associated with Immune Effector Cells. Biol Blood Marrow Transplant. 2019 Apr;25(4):625-638.



