
PARP抑制剂安全性管理一览
转移性去势抵抗性前列腺癌(mCRPC)是前列腺癌疾病发展的终末期,疾病异质性高,存在多种信号通路的突变。基于对脱氧核糖核酸(DNA)损伤修复通路(DDR)的认识,利用“合成致死”原理,多聚腺苷二磷酸核糖聚合酶(PARP)抑制剂在同源重组修复基因突变(HRRm)的 mCRPC 患者中显示出显著的抗肿瘤活性[1]。目前多款 PARP 抑制剂的临床研究数据相继披露,包括他拉唑帕利、奥拉帕利和尼拉帕利等,然而由于化学结构、药代动力学特点不同,各个PARP抑制剂的安全性有所差别,因此在临床实践中,如何对不良事件进行管理是非常值得关注的。本文旨在探讨 PARP 抑制剂的安全性特点及不良事件管理要点,为临床治疗决策提供参考。
一. PARP抑制剂不良事件概况
PARP 抑制剂相关的不良事件多为“类效应”,即各种 PARP 抑制剂具有相似的不良事件类别,但各自的不良事件发生率、事件级别等存在差异[1]。
1. 他拉唑帕利
TALAPRO-2 是一项评估他拉唑帕利联合恩扎卢胺对比安慰剂联合恩扎卢胺治疗 mCRPC 疗效、安全性和患者报告结局的国际多中心、随机双盲安慰剂对照的 III 期临床研究。其中队列 2 安全性分析人群包括HRR 缺陷人群的 198 例患者。安全性分析评估内容包括:常见治疗期间出现的不良事件(TEAE)类型、严重程度、发生时间以及与研究治疗的相关性[2]。
队列 2 中他拉唑帕利联合治疗组的中位随访时间为 15.4 个月,其中 66.2%的患者报告了任何原因导致的 3/4 级 TEAE,最常见(≥20%)非血液学TEAE为疲劳(33.3%),而血液学 TEAE 通常发生在治疗的前 4 个月内,最常见 3/4 级血液学 TEAE 为贫血(40.9%)、中性粒细胞减少症(18.7%)以及血小板减少症(7.1%)。从首次服用他拉唑帕利至首次出现 3/4 级TEAE的中位时间及中位不良事件持续时间:对于贫血分别为 3.3 个月和 17 天;对于中性粒细胞减少症分别为 2.3 个月和 14 天;对于血小板减少症分别为 1.5 个月和 15 天[2]。
总体而言,队列 2 中他拉唑帕利联合治疗组有 10.1%的患者因 TEAE 停用他拉唑帕利。其中,贫血是最常见的原因,分别导致 41.4%的患者剂量中断、42.9%的患者剂量降低以及 4.0%的患者停药。值得注意的是,贫血并非具有累积性的药物相关毒性,他拉唑帕利联合治疗组中血红蛋白的最大降幅出现在治疗 15 周后。相应地,他拉唑帕利剂量中断和降低的中位时间分别为 12 周和 13 周。调整剂量后,血红蛋白水平在第 15 周后开始回升,并于约第 29 周趋于稳定,这充分体现了剂量调整的临床获益[2]。并且事后分析结果显示,在队列 2 中他拉唑帕利联合治疗组(N=198)中有 105 例(58%)因任何原因至少出现 1 次他拉唑帕利剂量降低的情况,而出现他拉唑帕利剂量降低的患者(n=105)与未出现剂量降低的患者(n=93)在影像学无进展生存期(rPFS,HR=0.92;95% CI,0.56-1.5;P=0.73)和总生存期(OS,HR=0.83;95% CI,0.44-1.54;P=0.55)方面不存在具有临床意义的差异,表明他拉唑帕利剂量降低不影响临床疗效[3]。
2. 奥拉帕利
PROpel 是一项评估奥拉帕利联合阿比特龙(奥拉帕利组,n=399)一线治疗 mCRPC 患者疗效和安全性的全球多中心、随机、双盲 III 期临床研究[4]。
在数据截止时,奥拉帕利的中位治疗持续时间为 17.5 个月。奥拉帕利组常见的血液学不良事件主要为贫血(46.0%),并且贫血(15.1%)是最常见的 ≥3 级不良事件;奥拉帕利组常见的非血液学不良事件主要包括消化系统不良事件(恶心[28.1%]、腹泻[17.3%]、便秘[17.3%]、食欲减退[14.6%]和呕吐[13.1%]等)以及疲劳/虚弱(37.2%)。此外,奥拉帕利组肺栓塞发生率为 6.5%,其中 1 例致死,导致奥拉帕利停药的比例为 2.0%;深静脉血栓发生率为 1.8%[4]。奥拉帕利相关不良事件通常在启动治疗后的前 3 个月出现,并在 6 个月内缓解。多数患者的不良事件可通过支持治疗、降低奥拉帕利剂量和暂停用药进行管理,从而减少终止治疗的情况[1]。据报道,奥拉帕利组 13.8%的患者因不良事件导致停药, 20.1%的患者因不良事件导致剂量降低,44.7%的患者因不良事件导致治疗中断[4]。
3. 尼拉帕利
MAGNITUDE 是一项评估尼拉帕利联合醋酸阿比特龙加泼尼松(尼拉帕利组)的 III 期随机双盲研究,在有 HRRm(HRR+队列,n=423)或没有 HRRm(HRR−队列,n=247)患者中的疗效与安全性[5]。
HRR+ 队列中,指定治疗的中位持续时间在尼拉帕利组(n=212)为 13.8 个月。尼拉帕利组中 ≥3级不良事件的发生率为 67.0%,最常见的 3 级不良事件是贫血(28.3%)和高血压(14.6%)。其他值得注意的 3/4 级不良事件包括血小板减少症(6.6%)和中性粒细胞减少症(6.6%)。尼拉帕利组中严重不良事件的发生率为 35.8%,共有 19 例患者在研究治疗期间因不良事件导致死亡,其中感染是主要死亡原因。值得注意的是,尼拉帕利组中药物中断或剂量减少患者的影像学无进展生存期(rPFS)获益与在总体 HRR+ 人群中观察到的获益相当,表明剂量中断或剂量减少可用于患者不良事件的管理,且无需担心会对治疗效果产生不良影响[5]。
二. PARP抑制剂血液学和非血液学不良事件监测
1. 血液学不良事件监测
PARP 抑制剂血液学不良事件包括贫血、血小板减少、中性粒细胞减少等。此类不良事件在治疗前 3 个月更常见,随着时间的推移会逐渐恢复,有时需要中断或减少 PARP 抑制剂剂量。PARP抑制剂治疗的第 1 个月应每周监测全血细胞计数,治疗第 1 年每月监测,之后定期监测。如发生因 3 或 4 级血液学不良事件导致的暂停治疗,在恢复用药后,考虑每周监测全血细胞计数,直到恢复至正常水平[6]。
1.1他拉唑帕利
使用他拉唑帕利治疗期间,在基线时监测全血细胞计数,此后每月监测一次。如果血液学毒性持续存在,则中断本品给药并且每周监测血细胞计数直至恢复。如果 4 周内血细胞计数水平尚未恢复,则将患者转至血液科医生进行进一步检查,包括骨髓分析和采集血样进行细胞遗传学分析。如果确诊为骨髓增生异常综合症/急性髓性白血病 (MDS/AML),则停用他拉唑帕利[7]。
1.2奥拉帕利
使用奥拉帕利治疗期间,在基线时监测全血细胞计数以评估血细胞减少情况,此后每月监测一次,以便在治疗期间发现具有临床意义的变化。对于持续性血液学毒性,暂停使用奥拉帕利,并每周监测血细胞计数,直至恢复。如果 4 周后各项指标仍未恢复至1级或更低等级,则应将患者转诊至血液科进行进一步检查。如果确诊为 MDS/AML,则应停用奥拉帕利[8]。
1.3尼拉帕利
使用尼拉帕利治疗期间,建议在治疗的第 1 个月每周监测一次全血细胞计数,此后的 2 个月每 2 周监测一次,随后的第 1 年内每月监测一次,之后每 2 月监测一次,以及在有临床指征时进行监测。如果血液学毒性在暂停治疗后 28 天内未消退,则终止治疗,并将患者转诊至血液科进行进一步检查[9]。
2. 非血液学不良事件监测
PARP抑制剂非血液学不良事件包括胃肠道毒性、神经系统毒性、心血管毒性等。此类不良事件一般在开始治疗的前 4-8 周内监测[6]。
三. PARP抑制剂血液学毒性管理及治疗
PARP 抑制剂治疗相关血液学不良事件的发生可能与 PARP-1 捕获造成骨髓造血祖细胞生长抑制有关。根据常见不良事件评价标准(CTCAE v4.03)的血液系统不良事件分级见下表[1]:
表1. 根据 CTCAE v 4.03 的血液系统不良事件分级[1]

1. 血液学毒性——贫血的管理及治疗
贫血通常出现在 PARP 抑制剂治疗的前 3 个月,可在治疗初期发生,也可缓慢进行性发生。大多为轻中度(1-2级),根据患者潜在耐受性不同,可现不同程度贫血,仅少数患者因贫血中断或减量治疗,PARP 抑制剂相关贫血的通用处理流程见图 1[6]。

图1. PARP抑制剂相关贫血的通用处理流程图[6]
2. 血液学毒性——中性粒细胞减少的管理及治疗
中性粒细胞减少通常出现在治疗的前 3 个月,大多数为轻中度,即 1~2 级,治疗期间应监测全血细胞计数,PARP 抑制剂相关中性粒细胞减少的通用处理流程见图 2[6]。
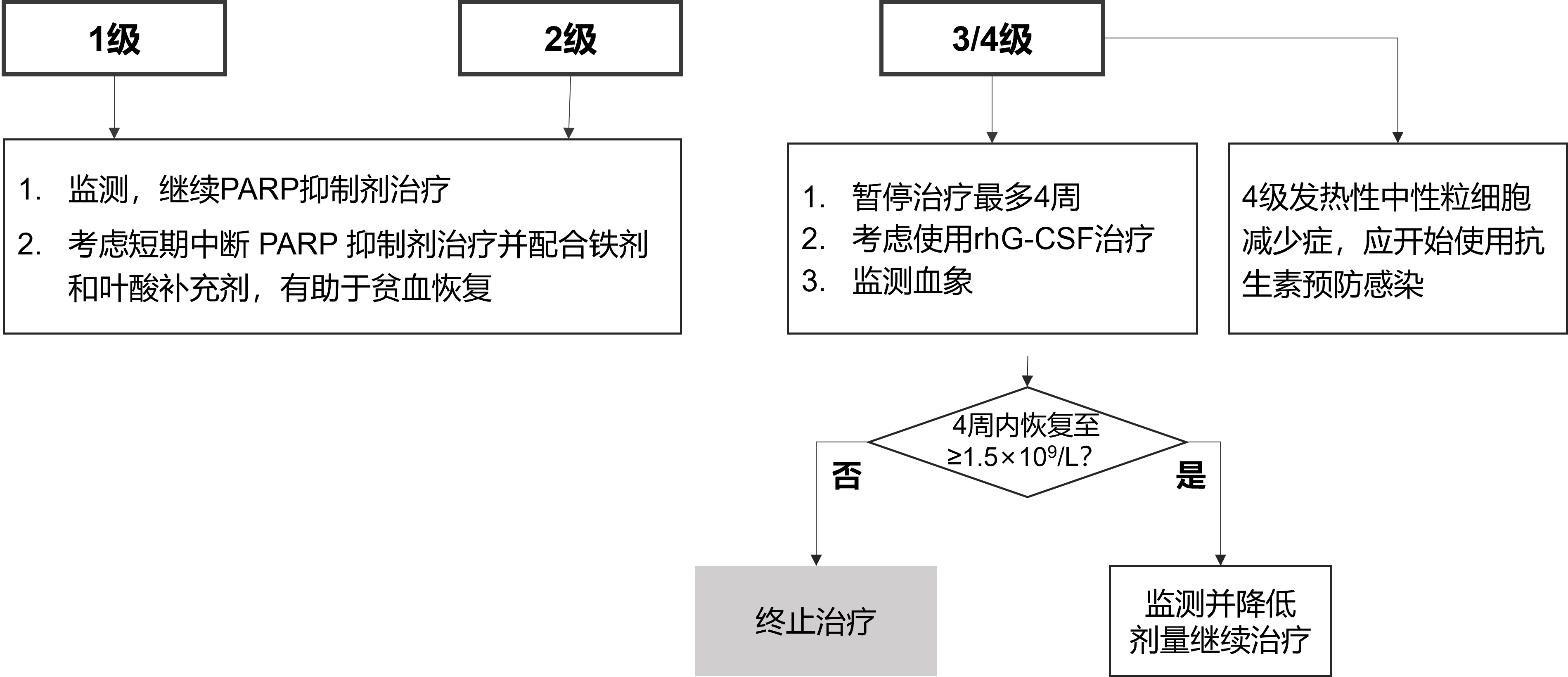
rhG-CSF,短效重组人粒细胞集落刺激因子
图2. PARP抑制剂相关中性粒细胞减少的通用处理流程图[6]
3. 血液学毒性——血小板减少的管理及治疗
血小板减少通常出现在治疗的第 1 个月,在第 2 或3 个月后逐渐呈恢复趋势,大多数为轻中度,即 1~2 级,PARP 抑制剂相关血小板减少的通用处理流程见图 3[6]。
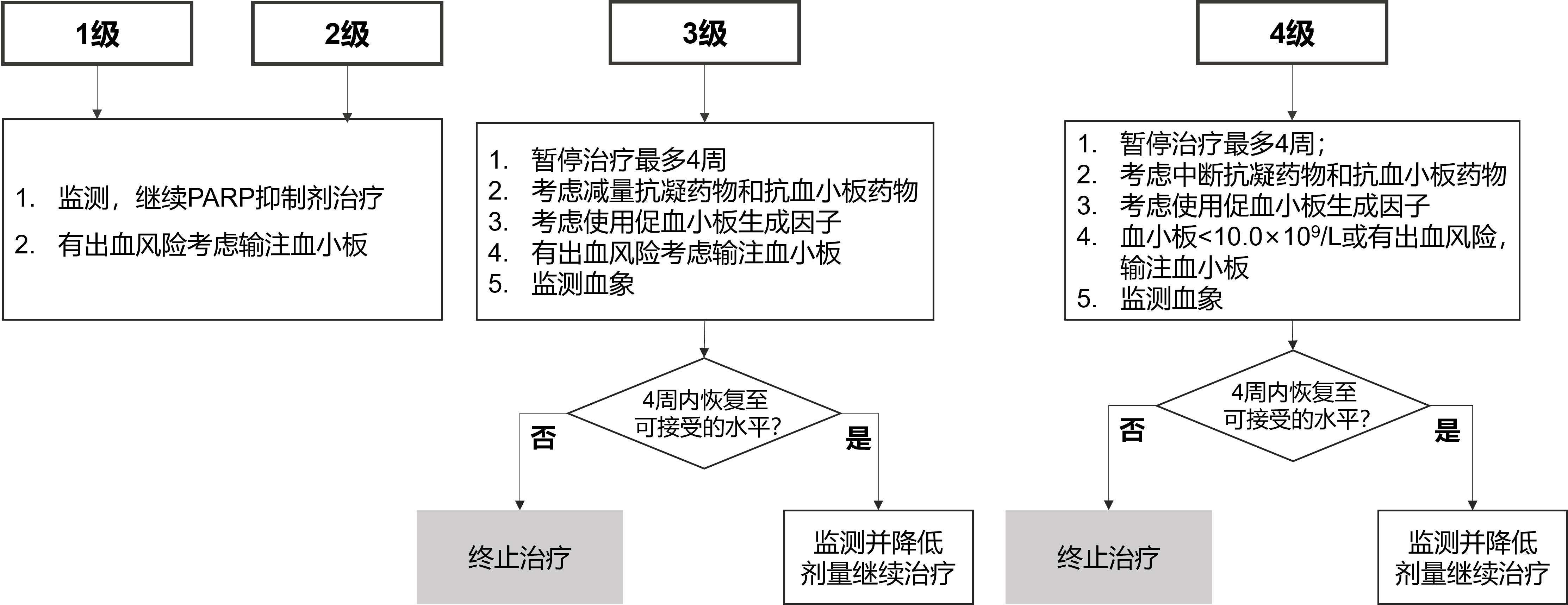
图3. PARP抑制剂相关血小板减少的通用处理流程图[6]
四. PARP抑制剂非血液学毒性管理及治疗
PARP 抑制剂治疗相关非血液学不良事件中,大部分为“类效应”,包括消化系统不良事件、疲劳/乏力以及呼吸系统不良事件等,但在不同的 PARP 抑制剂中具有不同的发生率和严重程度。不同 PARP 抑制剂之间不良事件的差异可能来自其对不同 PARP 酶及脱靶磷酸激酶活性抑制的差异,但目前具体机制尚未明确。非血液学不良事件分级见表 2[1]。
表2. 根据 CTCAE v4.03的非血液系统不良事件分级[1]

绝大部分患者可以通过症状管理而无需暂停给药或减量。常规治疗无效建议转至相关科室治疗或多学科诊疗(MDT),PARP 抑制剂相关非血液不良事件的通用处理流程见图 4[6]。
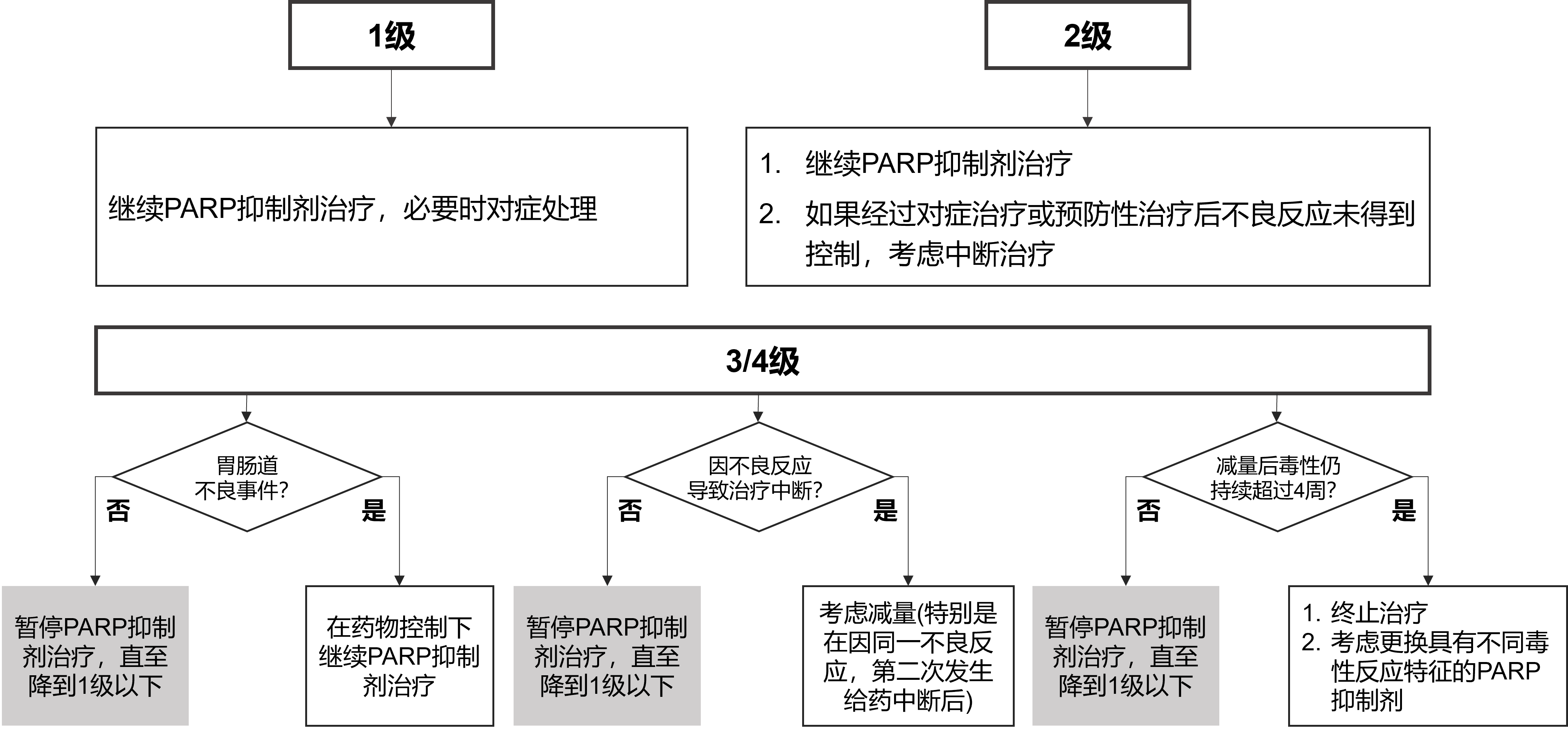
图4. PARP抑制剂相关非血液不良事件的通用处理流程图[6]
五. PARP抑制剂基础肝肾功能用药及合并用药的差异
1. PARP抑制剂基础肝肾功能用药的差异
肝脏通过肝脏代谢和胆汁排泄参与多种药物的清除过程。肝功能损伤可能会通过多种机制影响药物的药代动力学(PK),而肝功能损伤引起 PK 参数的变化可能会导致药物蓄积,或者无法形成具有活性的代谢产物;肾脏清除是 PARP 抑制剂的重要清除途径,因此,肾功能损伤会降低药物的清除率,从而导致药物暴露量增加。此外,肾功能损伤还会影响肝脏和肠道的代谢、药物吸收、血浆蛋白结合以及组织分布的改变[10]。
肝肾功能不全对药物的影响程度与肝肾功能损伤的严重程度相关[10],了解肝肾功能不全对 PARP 抑制剂用药的影响尤为重要(表 3)。
表3. 不同PARP抑制剂基础肝肾功能用药差异

总结
不同 PARP 抑制剂的不良事件特征相似,但不同药物具体的不良事件发生率、严重程度等存在各自特征。在绝大多数药物相关的不良事件处理上,不同药物可以遵循相同的处理原则,但一些药物独有的不良事件应该采取独特的管理措施。整体来看,无论是血液学还是非血液学不良事件,绝大多数不良事件是可控的,通过合理积极管理不良事件,必能使治疗获益最大化。
参考文献
- 中国医师协会泌尿外科医师分会共识专家组. PARP抑制剂治疗前列腺癌不良事件预防及管理中国专家共识[J]. 临床泌尿外科杂志, 2022, 37(7):489-497.
- Azad AA, Fizazi K, Matsubara N, et al. Talazoparib plus enzalutamide in metastatic castration-resistant prostate cancer: Safety analyses from the randomized, placebo-controlled, phase III TALAPRO-2 study[J]. Eur J Cancer. 2024 Dec;213:115078.
- De Giorgi U, et al. Presented at EMUC 2024. Poster P103.
- Clarke NW, Armstrong AJ, Thiery-Vuillemin A, et al. Abiraterone and Olaparib for Metastatic Castration-Resistant Prostate Cancer[J]. NEJM Evid. 2022 Sep;1(9):EVIDoa2200043.
- Chi KN, Rathkopf D, Smith MR, et al. Niraparib and Abiraterone Acetate for Metastatic Castration-Resistant Prostate Cancer[J]. J Clin Oncol. 2023 Jun 20;41(18):3339-3351.
- 中国抗癌协会妇科肿瘤专业委员会. PARP抑制剂不良事件管理的中国专家共识(2021年版)[J]. 中国实用妇科与产科杂志,2021,37(11):1119-1130.
- 甲苯磺酸他拉唑帕利胶囊说明书2024年10月29日.
- 奥拉帕利片说明书2025年1月15日.
- 尼拉帕利阿比特龙片说明书2024年10月16.
- Zhao D, Long X, Wang J. Dose Adjustment of Poly (ADP‑Ribose) Polymerase Inhibitors in Patients with Hepatic or Renal Impairment[J]. Drug Des Devel Ther. 2022 Nov 14;16:3947-3955.



