
简要介绍
前列腺癌
1.Eur Urol:中高危局限性前列腺癌的短期雄激素剥夺治疗联合大剂量放疗:GETUG 14 随机Ⅲ期试验结果
2.Ann Oncol:根据PSA最低值分析转移性激素敏感性前列腺癌患者的10年生存率:ECOG-ACRIN 3805(CHAARTED)试验的长期生存分析
3.Lancet Oncol:加拿大寡转移性去势抵抗性前列腺癌患者在标准全身治疗基础上加用转移灶定向治疗(GROUQ-PCS 9):一项多中心、开放标签、随机Ⅱ期试验
4.Eur Urol:循环肿瘤DNA中的致病性基因组改变可预测转移性去势抵抗性前列腺癌男性患者的总生存期
肾癌
5.Ann Oncol:循环肾损伤分子1(KIM-1)与肾细胞癌辅助免疫治疗结局的相关性
6.Lancet Oncol:贝莫苏拜单抗联合安罗替尼对比舒尼替尼一线治疗晚期肾细胞癌(ETER100):一项多中心、随机、开放标签、Ⅲ期试验
7.Lancet Oncol:不联合全身治疗的转移灶定向放疗用于寡转移性透明细胞型肾细胞癌:一项单臂、单中心、Ⅱ期试验的主要疗效分析
膀胱癌
8.J Clin Oncol:TAR-200用于卡介苗无应答的高危非肌层浸润性膀胱癌:Ⅱb期SunRISe-1研究结果
其他
9.Eur Urol:液体活检在泌尿生殖系统恶性肿瘤患者管理中的作用
前列腺癌
1.中高危局限性前列腺癌的短期雄激素剥夺治疗联合大剂量放疗:GETUG 14 随机Ⅲ期试验结果
发表期刊:Eur Urol
背景与目的:目前比较短期雄激素剥夺治疗(STADT)联合大剂量放疗(STADT-RT)与单纯大剂量放疗(RT)治疗局限性前列腺癌的研究较少。
方法:GETUG 14研究将376例患者随机分配至放疗组(n=191)或短期雄激素剥夺治疗联合放疗组(n=179)。两组的放疗剂量均为80 Gy。短期雄激素剥夺治疗方案为每月使用曲普瑞林,每日使用氟他胺,总疗程为4个月,于放疗前2个月开始。研究主要终点为无病生存期(DFS),次要终点包括总生存期(OS)、生化失败(BF)、转移失败(MF)、毒性反应及生活质量。
主要发现与局限性:在改良意向治疗人群的370例患者中,241例(65%)为中危前列腺癌,107例(28%)为高危前列腺癌。存活患者的中位随访时间为84个月(四分位距62~99个月),如图1,放疗组5年DFS率为76%,短期雄激素剥夺治疗联合放疗组为84%(风险比[HR]=0.64,95%置信区间[CI]:0.43~0.94)。加用雄激素剥夺治疗可降低生化失败(HR=0.45,95% CI:0.28~0.72)和转移失败(HR=0.50,95% CI:0.23~1.11)风险,但对总生存期无显著影响(HR=1.22,95% CI:0.65~2.29)。 在2级毒性反应发生率方面,放疗组与短期雄激素剥夺治疗联合放疗组相比,急性胃肠道(GI)毒性反应(26%,95% CI:20~32 vs 26%,95% CI:20~33)、急性泌尿生殖系统(GU)毒性反应(39%,95% CI:32~46 vs 42%,95% CI:35~50)、晚期胃肠道毒性反应(21%,95% CI:16~28 vs 23%,95% CI:18~30)及晚期泌尿生殖系统毒性反应(30%,95% CI:24~38 vs 27%,95% CI:21~34)均无显著差异。
结论与临床意义:短期雄激素剥夺治疗耐受性良好且疗效确切,与大剂量放疗联合使用时可改善肿瘤学结局,尤其适用于中高危前列腺癌患者。
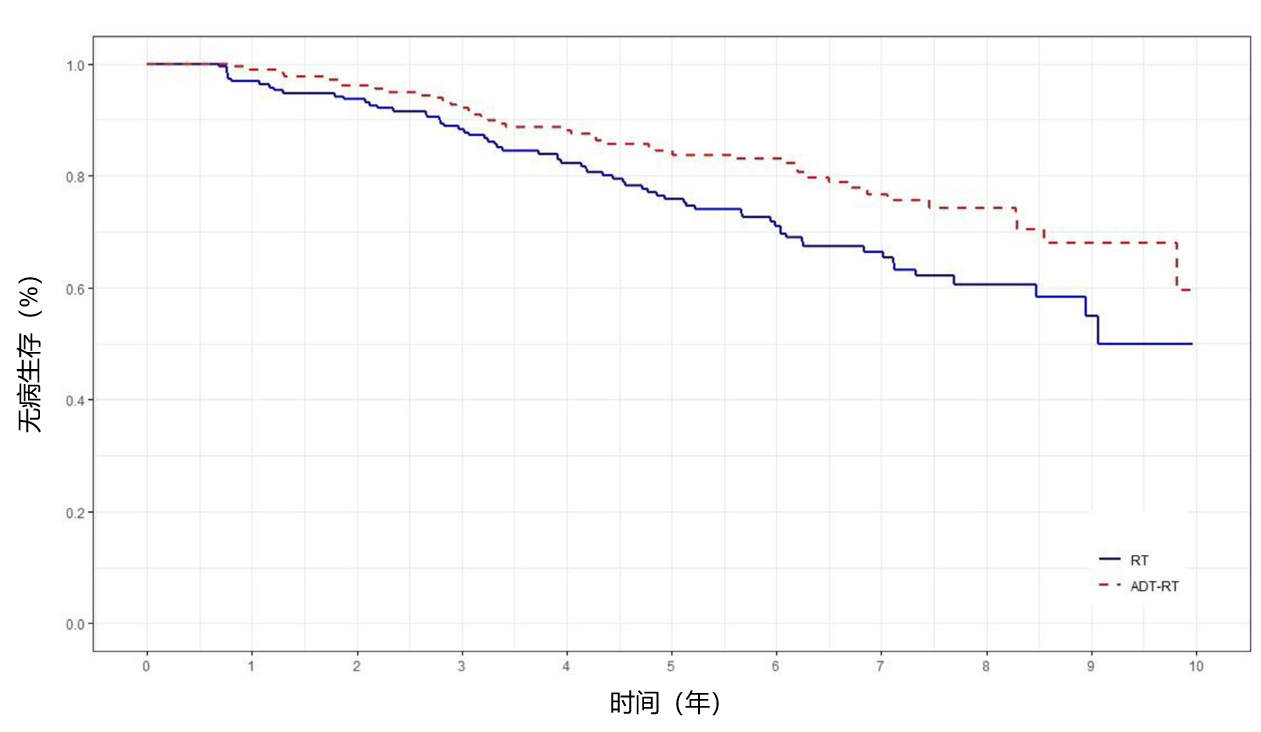
图1.改良意向治疗人群的无病生存期
2.根据PSA最低值分析转移性激素敏感性前列腺癌患者的10年生存率:ECOG-ACRIN 3805(CHAARTED)试验的长期生存分析
发表期刊:Ann Oncol
背景与目的:CHAARTED试验探讨了接受雄激素剥夺治疗(ADT)联合或不联合多西他赛(D)治疗的转移性激素敏感性前列腺癌(mHSPC)患者的长期生存情况。本分析聚焦于按疾病负荷和治疗6个月时PSA水平分层的10年总生存期(OS)。
方法:采用Kaplan-Meier法计算从随机分组至死亡或末次已知存活日期的总生存期。根据患者基线疾病特征(高负荷/HV或低负荷/LV)及治疗6个月时的PSA水平(<0.2 ng/mL vs ≥0.2 ng/mL)进行分组。采用多变量Cox回归分析评估PSA最低值与总生存期的相关性,并校正治疗组、疾病负荷、Gleason评分及既往局部治疗情况。
结果:在790例患者中,中位随访10年后,225例患者无死亡记录。ADT联合多西他赛组10年总生存率为25.9%,单纯ADT组为22.5%(HR=0.78,p=0.004)。接受多西他赛治疗的高负荷疾病患者总生存率显著更高(20.9% vs 11.4%,p<0.0001)。 无论在ADT联合多西他赛组(100.3个月 vs 45.4个月,p<0.0001)还是单纯ADT组(116.8个月 vs 31.8 个月,p<0.0001),治疗6个月时PSA<0.2 ng/mL的患者中位总生存期均显著改善。校正疾病负荷、既往局部治疗、Gleason评分及治疗组后,治疗6个月时PSA最低值< 0.2 ng/mL是总生存期改善的独立预测因素(HR=0.41,p<0.0001)。
结论:长期随访结果证实,ADT联合多西他赛可显著改善高负荷转移性激素敏感性前列腺癌患者的总生存期。治疗6个月时PSA最低值< 0.2 ng/mL是总生存期的强预后指标,这一发现支持将其用于基于疗效调整的降阶治疗策略。
3.加拿大寡转移性去势抵抗性前列腺癌患者在标准全身治疗基础上加用转移灶定向治疗(GROUQ-PCS 9):一项多中心、开放标签、随机Ⅱ期试验
发表期刊:Lancet Oncol
背景:转移灶定向治疗(MDT)在去势抵抗性前列腺癌(CRPC)中的作用尚不明确。前列腺癌研究9(PCS-9)旨在评估寡转移性去势抵抗性前列腺癌患者在标准全身治疗基础上加用立体定向体部放疗(SBRT)的获益。
方法:本项开放标签、随机Ⅱ期试验在加拿大13个学术及社区肿瘤中心开展。纳入年龄≥18岁、东部肿瘤协作组(ECOG)体能状态评分为0~2分、经组织学证实为寡转移性去势抵抗性前列腺癌(转移灶≤5个)且在雄激素剥夺治疗(ADT)期间疾病进展的男性患者,按1:1比例随机分配至ADT联合恩扎卢胺组(ENZA,每日1次,160 mg)或ADT联合恩扎卢胺加全寡转移灶SBRT组。采用按顺序编号的密封不透光信封进行随机分组,并根据转移灶位置进行分层。主要终点为影像学无进展生存期。采用意向治疗法进行分析。本研究已在ClinicalTrials.gov注册,注册号为NCT02685397,试验在Ⅱ期阶段终止并完成。
结果:2016年10月18日至2023年7月31日期间,共102例男性患者被随机分配至ADT联合恩扎卢胺组(n=49)或ADT联合恩扎卢胺加SBRT组(n=53);每组各排除1例因早期退出和数据不足的患者后,最终纳入分析的ADT联合恩扎卢胺组有48例患者,ADT联合恩扎卢胺加SBRT组有52例患者。 大多数患者为白人(80例,80%),中位年龄为73.0岁(四分位距67.0~79.5)。中位随访时间为4.8年(四分位距3.4~5.0),如图2,与单纯ADT联合恩扎卢胺相比,ADT联合恩扎卢胺加SBRT显著改善了影像学无进展生存期(中位影像学无进展生存期:4.6年,95% CI:3.7~未达到 vs 2.3年,95% CI:1.4~3.7;HR=0.48,95% CI:0.27~0.86;p=0.014)。 最常见的3级治疗相关不良事件为勃起功能障碍(ADT联合恩扎卢胺组14例患者中有8例[57%],ADT联合恩扎卢胺加SBRT组12例患者中有9例[75%])。未发生4级毒性反应,也无治疗相关死亡病例。
解读:研究结果表明,SBRT与ADT联合恩扎卢胺联用时,可使寡转移性去势抵抗性前列腺癌患者的中位影像学无进展生存期延长1倍,从而改善疾病控制,且两组毒性反应谱相似。这些发现支持将SBRT纳入寡转移性去势抵抗性前列腺癌的治疗方案。
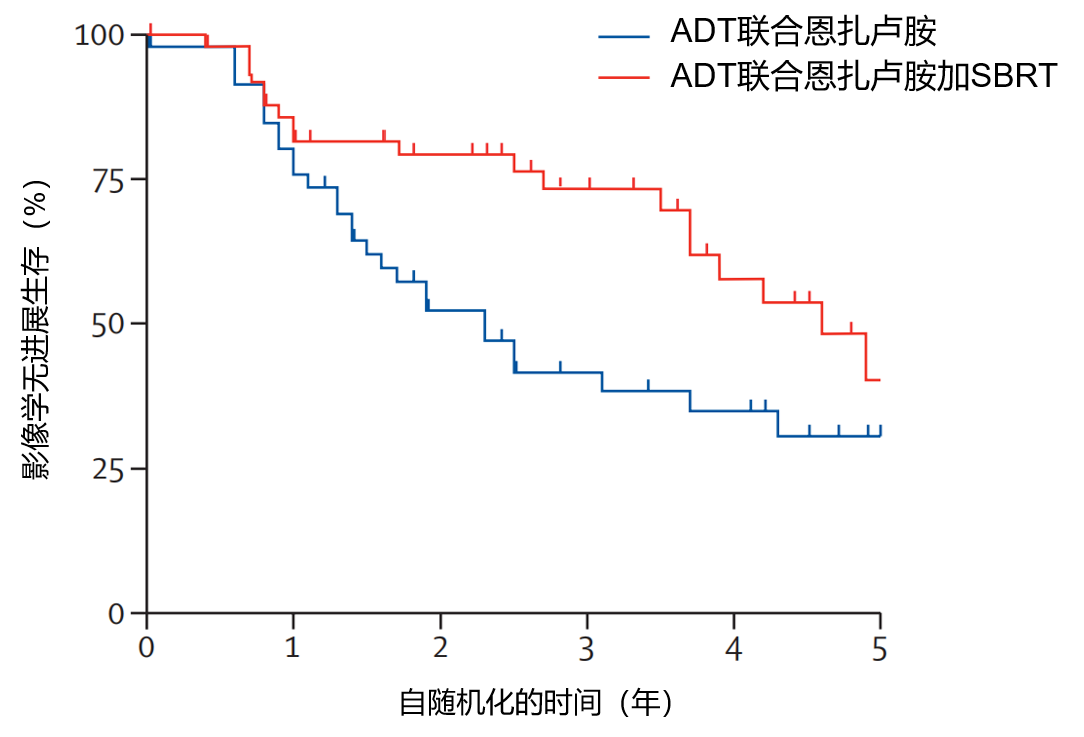
图2.两组患者的影像学无进展生存期
4.循环肿瘤DNA中的致病性基因组改变可预测转移性去势抵抗性前列腺癌男性患者的总生存期
发表期刊:Eur Urol
背景与目的:尽管已有针对转移性去势抵抗性前列腺癌(mCRPC)男性患者的验证预后模型,但目前的工具尚未纳入循环肿瘤DNA(ctDNA)异倍体或致病性基因组改变(PGAs)等基因组生物标志物。本研究旨在评估ctDNA中致病性基因组改变的发生率,分析其与ctDNA异倍体比例的相关性,并探讨其与总生存期(OS)的关联。此外,还构建并验证了一种用于预测总生存期的临床-基因(CG)模型。
方法:对纳入AllianceⅢ期试验(A031201)的776例患者的ctDNA进行分析。采用AR-ctDETECT检测法确定致病性基因组改变。通过净重新分类改善(NRI)评估临床-基因模型的附加价值,采用时间依赖性受试者工作特征曲线下面积(tAUC)评估总生存期预测模型的准确性。
主要结果与局限性:通过随机生存森林进行特征选择,发现以下基因存在扩增:雄激素受体(AR)、AR增强子、MYC、RSPO2、CCND1、BRAF和MET;以下基因存在缺失或致病性变异:ZBTB16、PTEN、MSH6、PPP2R2A、NKX3-1、ZFHX3、TP53、ZNFR3、RB1、FANCA、CHECK1、APC和CHD1;此外还检测到AR致病性变异。 临床-基因模型的性能显著优于单纯临床模型:临床-基因模型的平均tAUC为0.77(95% CI:0.73~0.79),而临床模型的tAUC为0.72(95% CI:0.69~0.75,p=0.01),两组模型的NRI为0.29。根据预测风险评分,将患者分为差、中、低风险组,其对应的中位总生存期分别为19.6个月、33.6个月和60.8个月。
结论与临床意义:将ctDNA中的致病性基因组改变纳入临床-基因模型后,其对总生存期的预测能力较单纯临床模型提高了近30%。该模型可将患者分为不同风险组,有助于在未来的转移性去势抵抗性前列腺癌试验中筛选患者。
肾癌
5.循环肾损伤分子1(KIM-1)与肾细胞癌辅助免疫治疗结局的相关性
发表期刊:Ann Oncol
背景:目前,辅助免疫治疗是复发风险较高的切除术后肾细胞癌(RCC)患者的标准治疗方案,但尚无可用的生物标志物指导治疗。肾损伤分子1(KIM-1)此前被报道为肾细胞癌中一种潜在的循环生物标志物。
患者与方法:对肾细胞癌切除术后辅助阿替利珠单抗对比安慰剂的随机Ⅲ期试验(IMmotion010)中患者的生物标志物与结局进行评估。该试验在意向治疗人群中未达到主要终点无病生存期(DFS)。采用基于亲和性的邻近延伸蛋白质组学检测法,比较基线(肾切除术后)血清样本与复发时血清样本中循环蛋白质的水平。
结果:与基线相比,复发时血清中KIM-1是富集最显著的蛋白质。基线血清KIM-1水平较高的患者无病生存期更短(HR=1.68,95% CI:1.35~2.09),但接受辅助阿替利珠单抗治疗相较于安慰剂治疗时,其无病生存期显著改善(HR=0.72,95% CI:0.52~0.99)(见图3)。 随访期间KIM-1水平升高的患者,其无病生存期相较于KIM-1水平未升高的患者更短。在KIM-1高水平亚组中,接受阿替利珠单抗治疗后无病生存期较长的患者,其基线效应T细胞和Th1细胞特征表达更高;而无病生存期较短的患者,其基线基质重塑基因和促肿瘤细胞因子表达更高。
结论:这些分析表明,肾切除术后血浆KIM-1水平升高及其动态变化具有预后意义,支持KIM-1可作为肾细胞癌微小残留病灶生物标志物的假设。由于KIM-1高水平患者更能从辅助免疫治疗中获益,因此应评估基于生物标志物指导的辅助治疗作为肾细胞癌潜在新治疗模式的可行性。
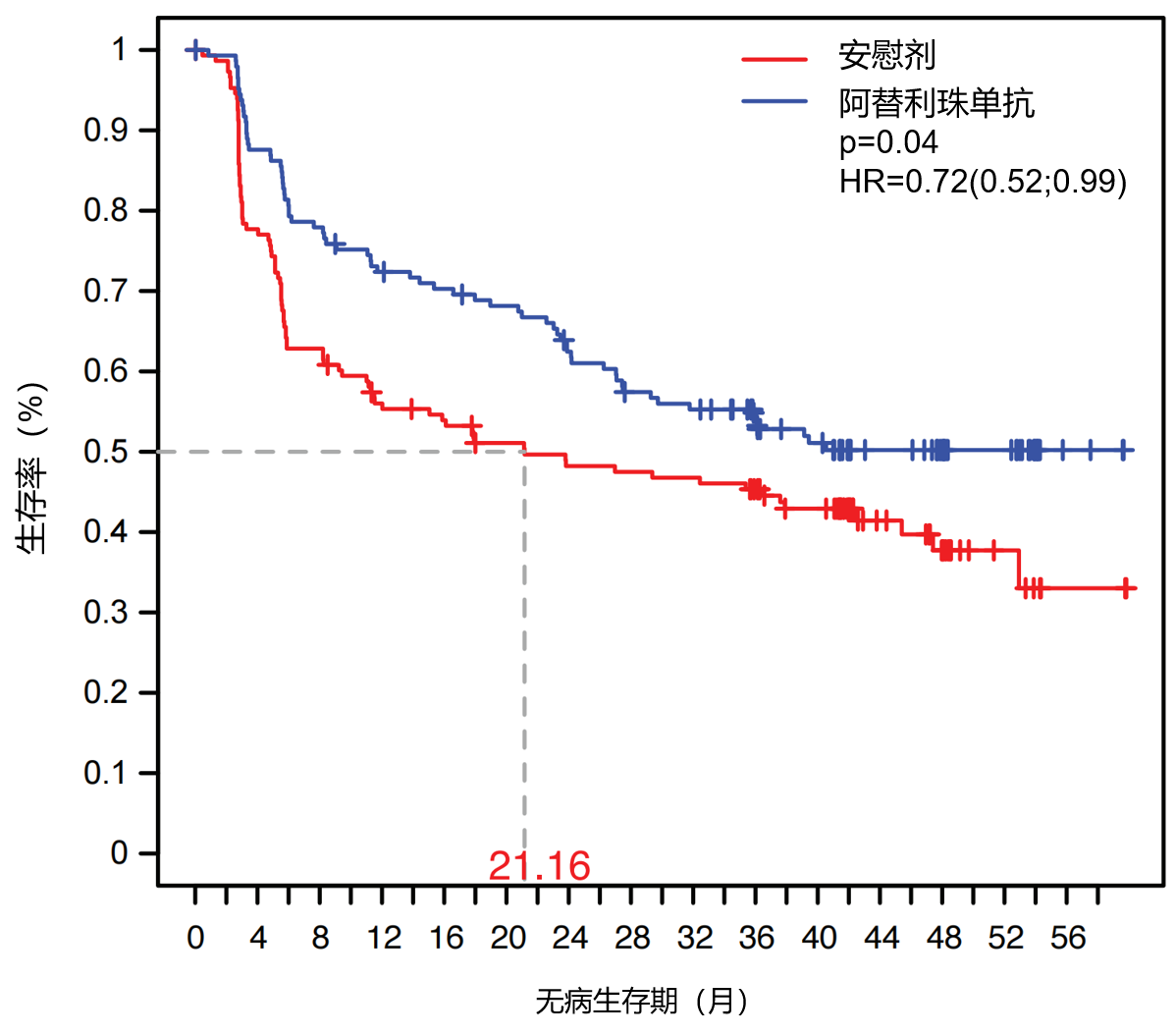
图3.基线血清KIM-1水平较高的患者接受阿替利珠单抗或安慰剂治疗的无病生存期
6.贝莫苏拜单抗联合安罗替尼对比舒尼替尼一线治疗晚期肾细胞癌(ETER100):一项多中心、随机、开放标签、Ⅲ期试验
发表期刊:Lancet Oncol
背景:PD-L1抑制剂在晚期肾细胞癌中的应用潜力尚未充分挖掘,因此迫切需要研发新型药物。本试验旨在比较贝莫苏拜单抗(一种新型PD-L1抑制剂)联合安罗替尼与舒尼替尼作为晚期肾细胞癌一线治疗的疗效。
方法:ETER100是一项在中国37个医疗中心开展的多中心、随机、开放标签、Ⅲ期试验。纳入年龄18~80岁、既往未接受过治疗、确诊为晚期透明细胞型肾细胞癌且东部肿瘤协作组(ECOG)体能状态评分为0或1分的患者。按1:1比例将患者随机分配至贝莫苏拜单抗联合安罗替尼组(贝莫苏拜单抗:静脉注射,1200 mg,每3周1次;安罗替尼:口服,12 mg,每日1次,每3周为1个周期,前2周服药)或舒尼替尼组(口服,50 mg,每日1次,每6周为1个周期,前4周服药),治疗持续至疾病进展、出现不可耐受的毒性反应、研究者决定停药或患者退出。 采用中央分层区组随机化(区组大小为4),按国际转移性肾细胞癌数据库联盟(IMDC)风险分层。主要终点为全分析集(即随机分配后至少接受过1剂研究药物且未违反关键纳入标准的患者)和符合方案集(即随机分配后至少完成1个周期方案治疗、无重大方案违背且至少进行过1次疗效评估的患者)中,由设盲独立中心评审根据实体瘤疗效评价标准1.1版(RECIST 1.1)评估的无进展生存期(PFS)。本文报告预设的中期分析结果。本试验目前仍在进行中,但已停止招募患者,已在ClinicalTrials.gov注册,注册号为NCT04523272。
结果:2020年8月25日至2023年2月6日期间,共评估了687例患者的入组资格,其中531例(77%)被随机分配至贝莫苏拜单抗联合安罗替尼组(266例,50%)或舒尼替尼组(265例,50%)。527例(99%)患者被纳入全分析集,其中贝莫苏拜单抗联合安罗替尼组263例(50%),舒尼替尼组264例(50%)。所有患者均为中国人(男性400例,76%;女性127例,24%),中位年龄为60岁(四分位距54~67)。 截至数据截止日期(2024年1月31日),中位随访时间为22.8个月(四分位距15.2~29.7)。如图4,在全分析集中,贝莫苏拜单抗联合安罗替尼组的中位无进展生存期显著长于舒尼替尼组(19.0个月,95% CI:15.3~22.8 vs 9.8 个月,95% CI:8.4~12.4;HR=0.53,95% CI:0.42~0.67;p<0.0001)。在符合方案集中,贝莫苏拜单抗联合安罗替尼组中位无进展生存期为19.0个月(95% CI:16.5~22.8),舒尼替尼组为11.0个月(95% CI:8.5~13.6)(HR=0.55,95% CI:0.43~0.70;p<0.0001)。 最常见的3级及以上治疗相关不良事件为高血压(贝莫苏拜单抗联合安罗替尼组264例患者中91例[34%],舒尼替尼组264例患者中55例[21%])。贝莫苏拜单抗联合安罗替尼组有63例(24%)患者发生严重治疗相关不良事件,舒尼替尼组有42例(16%)。贝莫苏拜单抗联合安罗替尼组有3例(1%)患者因治疗相关不良事件死亡(分别为心搏呼吸骤停、原因不明及肾衰竭各1例),舒尼替尼组无死亡病例。
解读:对于既往未接受过治疗的晚期透明细胞型肾细胞癌患者,贝莫苏拜单抗联合安罗替尼相较于舒尼替尼可显著改善无进展生存期。这些结果表明,贝莫苏拜单抗联合安罗替尼有望成为该人群的治疗选择之一。
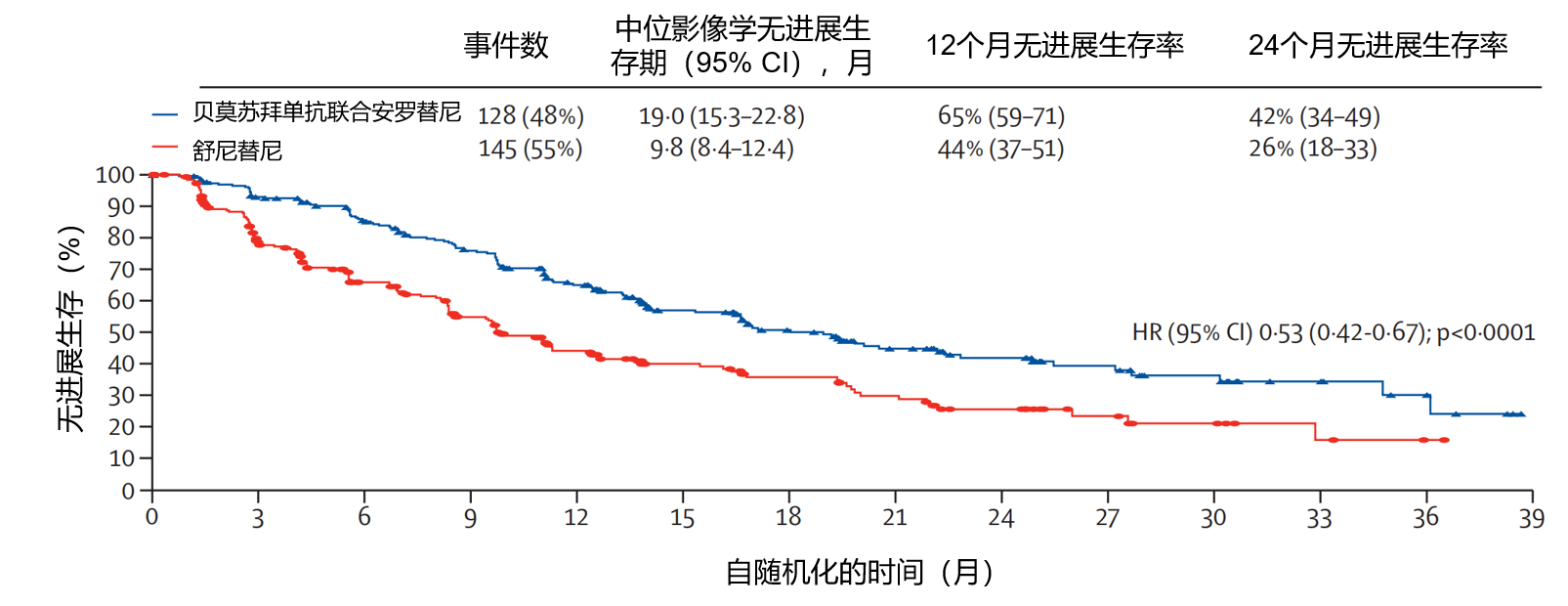
图4.独立审查委员会在全分析集中评估的无进展生存期
7.不联合全身治疗的转移灶定向放疗用于寡转移性透明细胞型肾细胞癌:一项单臂、单中心、Ⅱ期试验的主要疗效分析
发表期刊:Lancet Oncol
背景:部分转移性透明细胞型肾细胞癌患者可在不接受全身治疗的情况下进行治疗,但针对此类人群的研究较少。本研究探讨了不联合全身治疗的转移灶定向治疗用于寡转移性透明细胞型肾细胞癌的疗效。
方法:本项由研究者发起的单臂Ⅱ期试验,纳入年龄≥18岁、东部肿瘤协作组(ECOG)体能状态评分为0~2分、经组织学证实为透明细胞型肾细胞癌且转移灶数量为1~5个的患者。患者不接受全身治疗,对所有病灶进行转移灶定向治疗,疾病出现有限进展时可追加转移灶定向治疗。 共同主要终点为符合方案人群(初始局部治疗期间至少对1个转移灶进行过放疗的患者)基于实体瘤疗效评价标准1.1版(RECIST 1.1)的无进展生存期,以及意向治疗人群的无全身治疗生存期。无进展生存期定义为从入组至首次出现符合RECIST 1.1标准的疾病进展、临床进展或任何原因死亡的时间间隔;无全身治疗生存期定义为从入组至开始全身治疗或因透明细胞型肾细胞癌死亡的时间。预设的中位无全身治疗生存期达到24个月为试验成功阈值。在符合方案人群中进行安全性分析。本试验已在ClinicalTrials.gov注册,注册号为NCT03575611,目前已停止招募新患者。
结果:2018年7月13日至2023年5月2日期间,共纳入121例患者至意向治疗人群,其中120例至少接受过1次根治性放疗,被纳入符合方案人群和安全性人群。121例入组患者的中位随访时间为36.3个月(四分位距26.5~51.1)。中位无进展生存期为17.7个月(95% CI:14.9~22.4),中位无全身治疗生存期为34.0个月(95% CI:28.3~54.1)(见图5)。中位无全身治疗生存期及其95% CI下限均超过了预设的24个月目标。 120例患者中,8例(7%)发生了至少可能与转移灶定向治疗相关的3~4级不良事件。最常见的3级事件为治疗部位附近疼痛(4例);唯一的4级事件为高血糖。无治疗相关死亡病例。
解读:部分寡转移性透明细胞型肾细胞癌患者可通过序贯转移灶定向治疗进行管理,该治疗方式能延长患者脱离全身治疗的时间,且无进展生存期良好,不良事件较少。
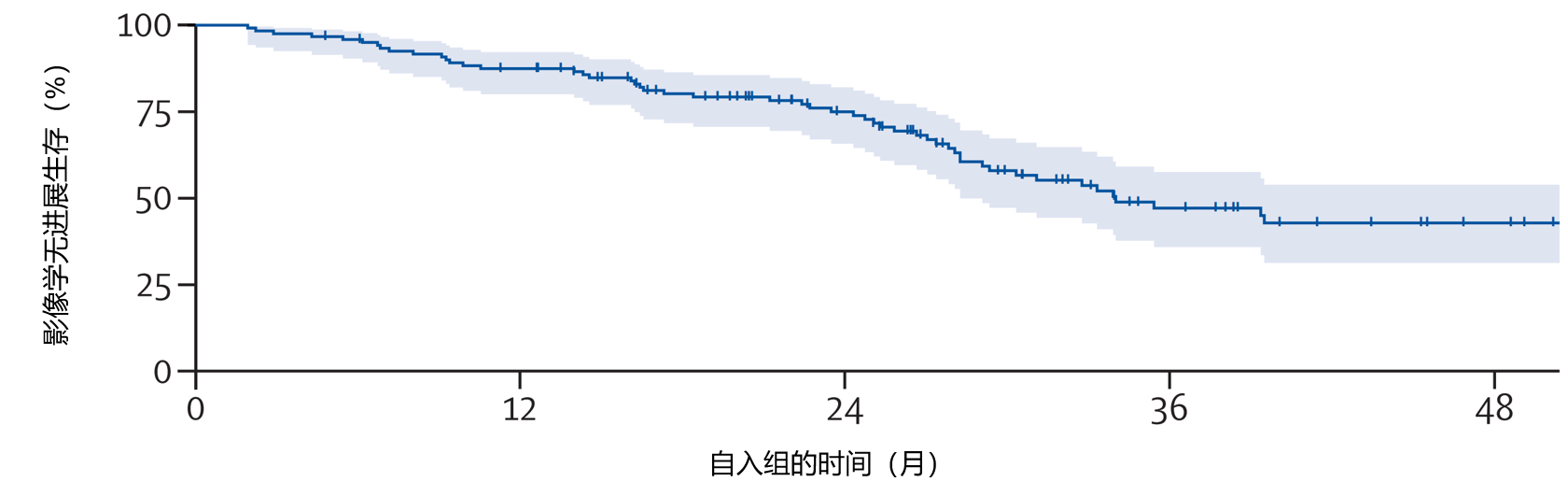
图5.无全身治疗生存期
膀胱癌
8.TAR-200用于卡介苗无应答的高危非肌层浸润性膀胱癌:Ⅱb期SunRISe-1研究结果
发表期刊:J Clin Oncol
目的:TAR-200是一种首创的膀胱内药物释放系统,旨在实现吉西他滨在膀胱内的持续递送。对于卡介苗(BCG)无应答的高危非肌层浸润性膀胱癌(NMIBC)患者,若不适合或拒绝接受根治性膀胱切除术,单独使用TAR-200或TAR-200联合cetrelimab(PD-1抑制剂)可能改善治疗结局。
方法:在这项Ⅱb期平行队列研究中,卡介苗无应答的原位癌(CIS)合并或不合并乳头状病变患者接受TAR-200单药治疗(队列2[C2])、TAR-200联合cetrelimab治疗(队列1[C1])或cetrelimab单药治疗(队列3[C3]);仅患有卡介苗无应答的高危乳头状病变的非肌层浸润性膀胱癌患者接受TAR-200单药治疗(队列4[C4])。TAR-200治疗持续至第24个月,cetrelimab治疗持续至第18个月。主要结局指标为中心确认的总完全缓解(CR)率(队列1~3)或无病生存(DFS)率(队列4)(ClinicalTrials.gov注册号:NCT04640623)。
结果:截至数据截止日期(2025年3月31日),队列1~4分别治疗了53例、85例、28例和52例患者。队列2的总完全缓解率和中位缓解持续时间分别为82.4%(95% CI:72.6~89.8)和25.8个月(95% CI:8.3~无法评估);如图7,队列4的6个月、9个月和12个月无病生存率分别为85.3%(95% CI:71.6~92.7)、81.1%(95% CI:66.7~89.7)和70.2%(95% CI:51.6~82.8);队列1和队列3的总完全缓解率分别为67.9%(95% CI:53.7~80.1)和46.4%(95% CI:27.5~66.1)。 队列2、队列4、队列1和队列3的3级及以上治疗相关不良事件发生率分别为12.9%、13.5%、37.7%和7.1%;严重治疗相关不良事件发生率分别为5.9%、5.8%、15.1%和3.6%。未发生治疗相关死亡病例。
结论:TAR-200单药治疗耐受性良好,在卡介苗无应答的高危非肌层浸润性膀胱癌患者中显示出较高的完全缓解率、持久的缓解效果和较长的无病生存期。对于卡介苗无应答的原位癌患者,TAR-200单药治疗相较于TAR-200联合cetrelimab或cetrelimab单药治疗,具有更优的风险-获益比。
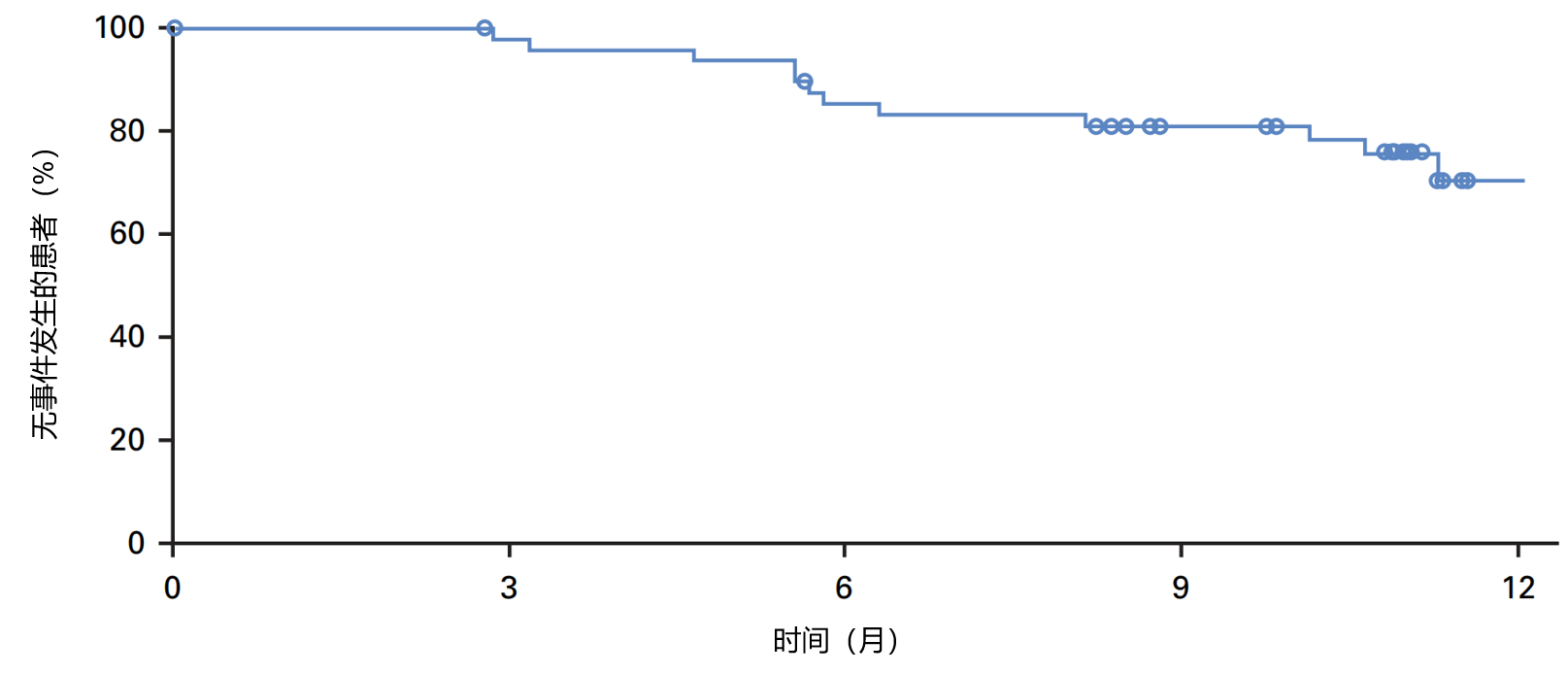
图6.使用TAR-200单药治疗高危非肌层浸润性膀胱癌患者的无病生存率
其他
9.液体活检在泌尿生殖系统恶性肿瘤患者管理中的作用
发表期刊:Eur Urol
背景与目的:液体活检是指采用特定分析方法检测血液或其成分中疾病相关生物标志物的技术,可分为定性检测和定量检测。液体活检在患者临床诊疗中的应用日益广泛。本文旨在探讨目前美国食品药品监督管理局(FDA)批准的与泌尿生殖系统肿瘤相关的所有液体活检适应证;次要目的是介绍该技术的其他几项可能即将获得批准的潜在应用。
方法:对2015年至2025年期间所有FDA批准项目进行系统综述,查询多个FDA数据库以获取肿瘤特异性和组织不可知型批准项目。检索范围限定为需要生物标志物检测以评估液体活检价值的适应证。共识别出1119项批准项目,其中9项与泌尿生殖系统癌症相关的独特药物批准需进行分子检测。随后通过PubMed检索这些批准项目所依据的注册试验,并在此呈现相关结果。对于次要目的,纳入了过去10年内发表的相关应用案例。
主要结果:基于监管批准,液体活检目前的应用场景为预测治疗反应。现有9种FDA批准的药物或药物联合方案可用于泌尿生殖系统恶性肿瘤患者的临床治疗,其中大多数适应证均可通过液体活检筛选患者。
结论与临床意义:目前,液体活检在常规临床实践中有多项临床适应证。这些FDA批准的适应证可显著改善经生物标志物筛选患者的治疗结局。建议所有诊治泌尿生殖系统恶性肿瘤的医务人员在适应证明确时常规使用这些工具,以改善患者诊疗效果。预计未来将有更多液体活检应用获批用于常规临床实践。
参考文献
- Demogeot N, Sargos P, Salleron J, et al. Short-term Androgen Deprivation Therapy and High-dose Radiotherapy in Intermediate- and High-risk Localized Prostate Cancer: Results from the GETUG 14 Randomized Phase 3 Trial [J]. Eur Urol. 2025 Aug 14:S0302-2838(25)00436-1.
- Tripathi A, Chen Y, Jarrard DF, et al. Ten-year survival rates by PSA nadir in patients with metastatic hormone-sensitive prostate cancer: long-term survival analysis from the ECOG-ACRIN 3805 (CHAARTED) trial [J]. Ann Oncol. 2025 Aug 23:S0923-7534(25)00924-X.
- Niazi T, Saad F, Tisseverasinghe S, et al. Metastases-directed therapy in addition to standard systemic therapy in oligometastatic castration-resistant prostate cancer in Canada (GROUQ-PCS 9): a multicentre, open-label, randomised, phase 2 trial [J]. Lancet Oncol. 2025 Sep;26(9):1158-1167.
- Halabi S, Guo S, Luo B, et al. Pathogenic Genomic Alterations in Circulating Tumor DNA Predict Overall Survival in Men with Metastatic Castrate-resistant Prostate Cancer [J]. Eur Urol. 2025 Aug 6:S0302-2838(25)00407-5.
- Rini BI, Albiges L, Tang X, et al. Circulating kidney injury molecule-1 (KIM-1) and association with outcome to adjuvant immunotherapy in renal cell carcinoma [J]. Ann Oncol. 2025 Aug 28:S0923-7534(25)00927-5.
- Zhou A, Shen P, Li J, et al. First-line benmelstobart plus anlotinib versus sunitinib in advanced renal cell carcinoma (ETER100): a multicentre, randomised, open-label, phase 3 trial [J]. Lancet Oncol. 2025 Sep;26(9):1145-1157.
- Tang C, Sherry AD, Seo A, et al. Metastasis-directed radiotherapy without systemic therapy for oligometastatic clear-cell renal-cell carcinoma: primary efficacy analysis of a single-arm, single-centre, phase 2 trial [J]. Lancet Oncol. 2025 Sep 4:S1470-2045(25)00380-8.
- Daneshmand S, Van der Heijden MS, Jacob JM,et al. TAR-200 for Bacillus Calmette-Guérin-Unresponsive High-Risk Non-Muscle-Invasive Bladder Cancer: Results From the Phase IIb SunRISe-1 Study [J]. J Clin Oncol. 2025 Jul 30:JCO2501651.
- Maughan BL, Dyrskjøt L, Grivas P,et al. The Role of Liquid Biopsy in the Management of Patients with Genitourinary Malignancies [J]. Eur Urol. 2025 Aug 18:S0302-2838(25)00434-8.



