
简要介绍
前列腺癌
1. Eur Urol:根治性前列腺切除术后的立体定向调强放疗(SCIMITAR):一项II期临床研究的4年结果
2. JAMA Oncol:根治性前列腺切除术后PSMA PET引导下的强化挽救性放疗:一项II期随机临床研究
3. Nature Cancer:一种用于前列腺癌无创诊断与分级的MRI-病理学基础模型
4. JAMA:比较双参数与多参数MRI用于前列腺癌的诊断:PRIME诊断性临床研究
5. CA Cancer J Clin:2025年前列腺癌统计报告
肾癌
6. Eur Urol:新型血浆代谢组学特征用于肾细胞癌检测的开发与验证
7. Lancet Oncol:肾细胞癌新辅助治疗的病理缓解评估:国际肾癌新辅助治疗协作组关于取样及报告标准的系统综述与指南
8. Ann Oncol:CheckMate 9ER III期随机临床试验:纳武利尤单抗联合卡博替尼治疗晚期肾细胞癌的最终分析结果
膀胱癌
9. J Clin Oncol:肌层浸润性膀胱癌患者保留膀胱的下一代围手术期试验终点
10. Lancet Oncol:TAR-200联合cetrelimab对比cetrelimab单药治疗作为新辅助治疗用于不能接受或拒绝含顺铂新辅助化疗的肌层浸润性膀胱癌(MIBC)患者的疗效与安全性(SunRISe-4研究):一项随机、开放标签II期临床试验的中期分析结果
前列腺癌
1. 根治性前列腺切除术后的立体定向调强放疗(SCIMITAR):一项II期临床研究的4年结果
发表期刊:Eur Urol
背景与目的:立体定向体部放疗(SBRT)采用先进放疗技术,实施≤5次、每次>5 Gy的剂量方案,现已成为前列腺癌的标准根治性放疗方案。然而,由于器官运动相关的挑战以及膀胱尿道吻合口放射敏感性的不确定性,根治性前列腺切除术(RP)后前列腺窝的SBRT应用此前仅局限于小型试验。SCIMITAR研究是一项双中心、单臂、II期临床试验,旨在评估针对RP术后前列腺窝进行SBRT的安全性与有效性。
方法:SCIMITAR研究于2018年2月至2021年3月期间,纳入100例需接受术后放疗的根治性前列腺切除术后患者,在前列腺窝接受了SBRT,总剂量为30-34 Gy/5次。此外,患者接受雄激素剥夺疗法(ADT)、盆腔淋巴结放疗及针对明确病灶的加量放疗,均由医生根据临床判断决定。患者分别于治疗后1个月首次随访,之后1年内每3个月随访1次,再之后每6个月随访一次直至4年。研究主要终点为4年无生化复发生存率(BCR-FS),次要终点包括生化复发(BCR)和局部/淋巴结复发及远处转移情况。通过逆概率加权处理(IPTW)和Fine-Gray模型,将研究结果与一项常规分割放疗(CFRT)III期研究的个体患者数据(IPD)进行比较。
主要结果:中位随访时间为53个月,以患者末次随访或死亡时间为截尾数据。4年BCR-FS为60%(95% 置信区间[CI]:50%-70%),与历史对照组60%的BCR-FS无显著差异(P=0.5;图1A)。采用历史生化复发标准(PSA>0.4 ng/mL)时,BCR-FS为67%(95% CI:57%-77%;P=0.07;图1B)。观察到4例单纯局部复发(无一例位于临床靶区内),7例单纯区域淋巴结复发,以及19例远处转移(其中5例伴淋巴结复发)。4年局部复发、淋巴结复发和远处转移的累积发生率分别为3.5%、12%和13%。
经IPTW的多变量Fine-Gray模型分析显示,在两组未接受ADT治疗时,SBRT相较于CFRT可显著降低BCR风险(亚分布风险比[sHR]=0.49,95% CI:0.29-0.84;P=0.009)。在接受ADT治疗组中,SBRT与CFRT的BCR风险未见显著差异(sHR=1.58,95% CI:0.81-3.11;P=0.18);然而需注意,该置信区间范围宽泛,既包含风险轻度降低的可能,也包含风险增加超过三倍的可能,且点估计值的趋势显示SBRT组风险升高。在单纯放疗组与放疗联合ADT组中,GETUG队列与SCIMITAR研究队列的总生存率均相似。
研究对全队列(n=100)的毒性反应进行了评估。≥2级胃肠道(GI)与泌尿生殖系统(GU)晚期毒性累积发生率分别为6.6%和32%(图1C、D)。计算机断层扫描(CT)引导放疗组的4年GU毒性累积发生率显著高于磁共振(MRI)引导放疗组(40% vs 14%;sHR=3.54,95% CI:1.19-10.55;P=0.023);而不同引导平台的GI毒性发生率无显著差异。
结论:SCIMITAR研究的四年随访数据显示,前列腺窝SBRT是一种安全高效的治疗选择,值得在更大规模的验证性试验中开展深入研究。
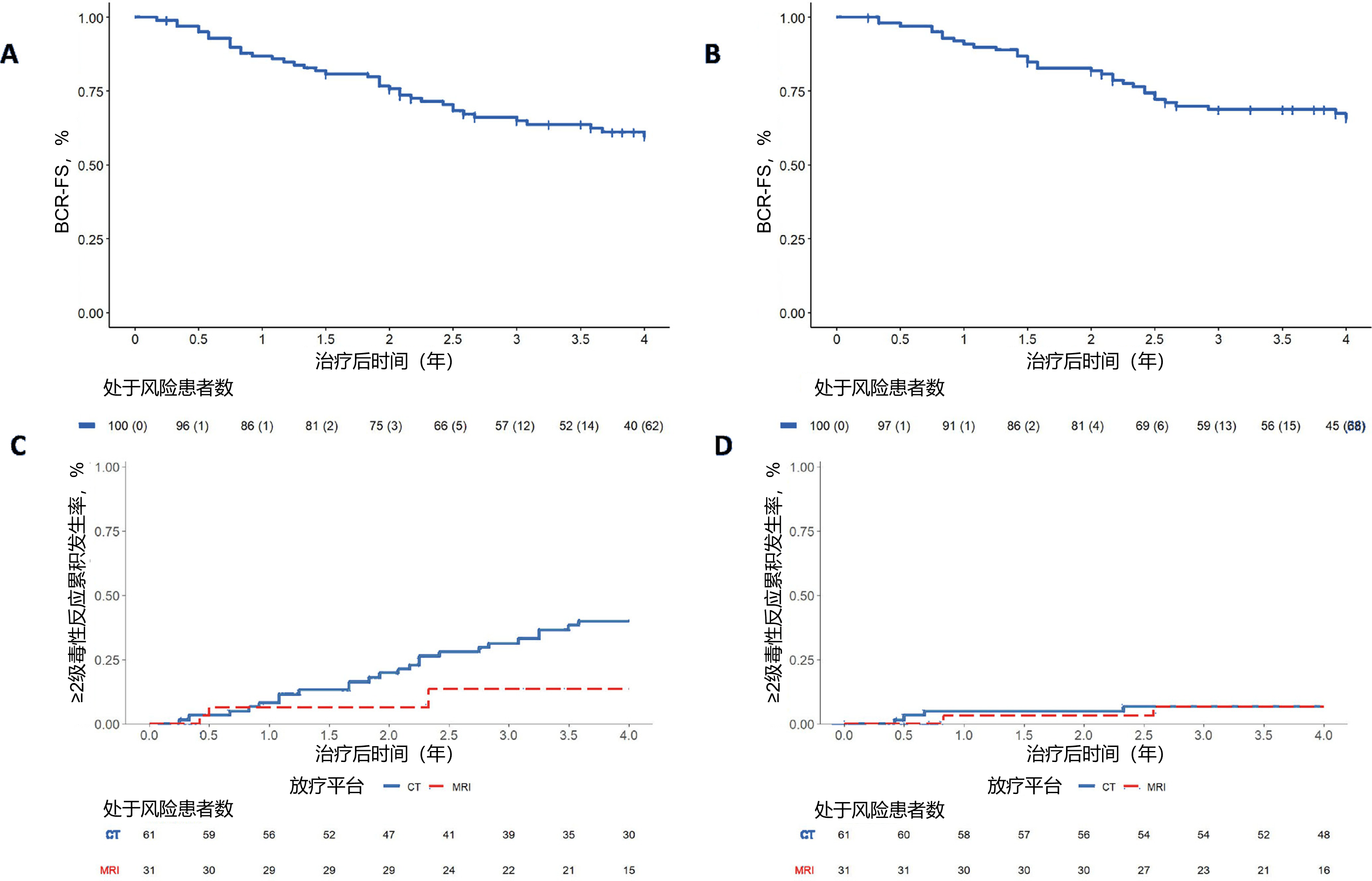
图1. BCR-FS与毒性反应结果。(A,B)SCIMITAR试验队列(n=100)的BCR-FS 结果,分别依据两种BCR定义:(A)治疗后前列腺特异性抗原(PSA)最低值升高≥0.2 ng/ml;(B)治疗后PSA最低值升高≥0.4 ng/ml。(C,D)根据《不良事件通用术语标准v4.03》评估的≥2级(C)胃肠道与(D)泌尿生殖系统晚期毒性累积发生率。
2. 根治性前列腺切除术后PSMA PET引导下的挽救性放疗强化方案:一项II期随机临床研究
发表期刊:JAMA Oncol
背景与目的:前列腺特异性膜抗原正电子发射断层扫描(PSMA-PET)已被证实相较于传统影像学检查在根治性前列腺切除术(RP)后具有卓越诊断准确性,尤其适用于RP术后出现生化复发(BCR)的患者。既往研究表明,PSMA-PET可显著改变挽救性放疗(SRT)的治疗策略,约50%的患者因此接受了治疗方案的调整,但其对临床结局的具体影响尚未明朗。基于PSMA-PET的高敏感性与高特异性,本研究提出以下假设:对于RP术后出现BCR的患者,采用PSMA-PET引导下的挽救性放疗强化方案(PSMAiSRT)相较于常规SRT,可显著改善无失败生存期(FFS)。
方法:PSMA引导下的PSMAiSRT是作为大型PSMA指导放疗强化(PSMAgRT)试验中的一个分层队列开展研究——该项II期、双中心、多重队列随机临床试验,纳入了2018年5月至2021年2月期间符合标准挽救性放疗(SOC SRT)的128例根治性前列腺切除术后出现BCR的患者。主要分析的截止日期为2023年10月26日。患者按1:1比例随机分配至两组:一组接受SOC SRT,可联合或不联合选择性盆腔放疗(pelvic RT),可联合或不联合辅助内分泌治疗(HT);另一组接受PSMAiSR。研究主要终点为FFS,次要终点包括总生存期、无生化复发生存期(BPFS)、无后续治疗生存期(TFS)、不良事件及生活质量(QoL)。
结果:中位随访时间37个月(范围7-60个月)时,PSMAiSRT组较对照组显著改善FFS(84% vs 69%,风险比[HR]=0.46;95% CI:0.22-0.99;P=0.04)。两组在远处转移和总生存期方面均无显著差异。两组间BPFS的差异未达到常规统计学显著性水平(HR=0.47;95% CI:0.21-1.05;P=0.06)。PSMAiSRT组较对照组显著改善TFS(HR=0.32;95% CI:0.10-1.00;P=0.04)。研究中67%的患者恢复至正常睾酮水平(≥5.2 ng/dL)。从达到正常睾酮水平至治疗失败的中位时间(范围)为22.3(0-90)个月。PSMAiSRT组恢复正常睾酮状态后的FFS显著延长(HR=0.45;95% CI:0.21-0.96;P=0.03)。图2展示了FFS、BPFS、TFS及恢复正常睾酮状态后的FFS的KM曲线。不良事件方面,在6个月时或中位随访时,≥2 级和≥3 级事件的无事件生存率(EFS)在两组间均无显著性差异。
解读:本研究首次证实,在根治性前列腺切除术后采用PSMAiSRT可在不增加毒性的前提下提升抗肿瘤效果。后续一项III期随机临床试验(NCT04557501)已完成患者入组,该研究将进一步明确哪些患者能从PSMAiSRT中获得最大获益。
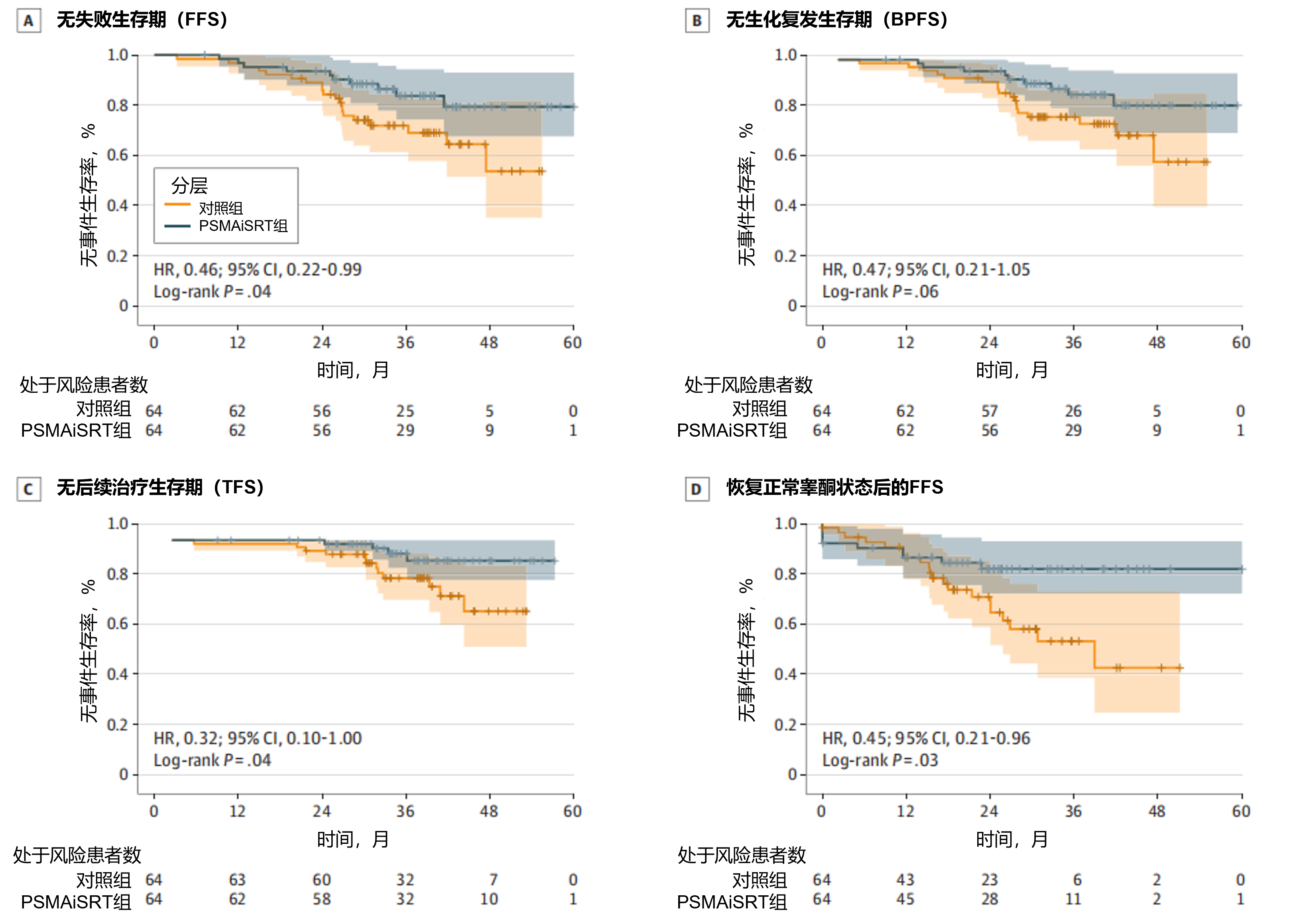
图2. FFS(A)、BPFS(B)、TFS(C)及恢复正常睾酮状态后的FFS(D)的KM曲线
3. 一种用于前列腺癌无创诊断与分级的MRI-病理学基础模型
发表期刊:Nature Cancer
背景:前列腺癌(PCa)是男性面临的主要健康问题,但目前对肿瘤侵袭性的临床评估依赖于侵入性操作,常常导致结果不一致。因此,亟需准确的、无创的诊断与分级方法。本研究开发了一种基于多参数磁共振成像(MRI)及配对病理数据训练的基础模型,用于前列腺癌的无创诊断与分级。该模型被命例为 MRI-PTPCa(MRI-based Predicted Transformer for Prostate Cancer),通过对超过5,500例患者、近130万对图像–病理配对样本进行对比学习训练,涵盖发现、建模、外部验证和前瞻性队列。
方法:研究团队纳入了多中心的回顾性及前瞻性患者队列,共涵盖5,747例接受前列腺穿刺活检或根治性前列腺切除术(RP)的患者,所有患者均完成病理学评估。研究收集了包括影像学、病理学及临床检查在内的多维度数据。AI模型的评估方法包括时间外部测试、空间外部测试、人口外部测试以及前瞻性测试。为减少图像序列遗漏、过拟合和仪器差异对结果的影响,团队使用1,296,950对影像数据进行模型训练,并融合了自监督学习、任务多重学习、变换器(Transformer)架构以及基础模型迁移学习等技术,进一步优化训练过程,最终成功构建出端到端的AI辅助诊断系统。
解读:MRI-PTPCa模型在PCa诊断方面表现出高准确性。在回顾性接受针刺活检的患者队列中,MRI-PTPCa模型的曲线下面积(AUC)达0.983[0.98-0.986],灵敏度(SEN)为0.988[0.986-0.991],特异度(SPE)达0.981[0.977-0.986]。
MRI-PTPCa模型在临床显著前列腺癌(CSPCa)诊断方面,研究人员通过外部测试集及PI-CAI数据集对MRI-PTPCa模型进行了评估。数据显示,MRI-PTPCa模型的整体AUC达到0.978[0.975-0.981],SEN为0.997[0.995-0.998],SPE达0.938[0.931-0.945]。MRI-PTPCa模型在保SEN稳定的同时,显著提升SPE,使临床过度诊断的cCSPCa病例减少近90%。
在RP确认格里森分级组(GGG)的患者中评估MRI-PTPCa的分级性能,结果显示该模型能有效关联MRI表现与PCa病理特征及肿瘤侵袭性。MRI-PTPCa在多中心患者队列中表现出稳健性能。MRI-PTPCa评分与RP确定的GGG呈显著相关(P<0.001),有效表征前列腺肿瘤侵袭程度。MRI-PTPCa在GGG预测中的总体准确率(ACC)达0.891[0.882-0.899],且在回顾性测试集中多分类准确率均不低于84%。
MRI-PTPCa展现出基于肿瘤侵袭性对PCa进行独立分级的能力。与前列腺特异性抗原(PSA)、前列腺影像报告和数据系统(PI-RADS)及穿刺活检等临床工具相比,MRI-PTPCa的预测结果与RP确认的GGG相关性显著更强。
解读:综上所述,研究通过开发并验证多中心数据集,建立了MRI-PTPCa这一基于MRI-病理学的基础模型,可实现PCa、CSPCa及GGG的无创诊断与分级。本研究证实了多参数MRI(mp-MRI)能够定量反映前列腺肿瘤的病理学特征,进一步强化了人工智能基础模型在临床无创癌症诊断与分级中的应用潜力。
4. 比较双参数与多参数MRI用于前列腺癌的诊断:PRIME诊断性临床研究
发表期刊:JAMA
背景与目的:在过去五年间,多参数磁共振成像(MRI)已然成为国际公认的前列腺癌诊断标准,无论是否联合前列腺活检。然而,受限于医疗资源紧张与日益增长的检查需求,全面推广多参数MRI面临现实挑战。为此提出了一种解决方案,即采用不含动态增强序列的短时、低资源消耗扫描方案,即双参数MRI。当前针对双参数与多参数MRI的对比研究普遍存在局限性:多数试验规模较小、采用单中心设计且未实施盲法评估,同时缺乏严格的影像质量控制体系。此外,配套的活检策略也存在局限性。因此为突破上述研究瓶颈,进行了MRI±对比增强前列腺成像的PRIME试验,旨在通过严谨的科研设计验证双参数MRI在检测具有临床意义的前列腺癌时是否具备与多参数MRI相当的诊断效能。
方法:PRIME研究是一项前瞻性、国际多中心、自身对照、非劣效性、1级证据诊断效能临床试验,在12个国家的22个中心开展。患者纳入标准为因临床疑似前列腺癌(基于前列腺特异性抗原[PSA]水平升高或直肠指检异常[如前列腺结节或质地变硬])被转诊,同时要求受试者PSA水平≤20 ng/mL,且既往未接受MRI检查或穿刺活检。受试者接受了多参数MRI检查。放射科医生首先报告简化的双参数MRI(T2加权成像和弥散加权成像),对动态对比增强(DCE)序列不知情。揭盲后,放射科医生报告完整的多参数MRI检查结果。如果双参数MRI或多参数MRI提示存在临床意义的前列腺癌,则患者接受靶向活检(联合或不联合系统活检)。主要研究终点为有临床意义前列腺癌患者的比例。次要研究终点为无临床意义前列腺癌患者的比例。非劣效性界值为5%。
主要结果:从2022年4月至2023年9月,筛选了来自12个国家/地区的22个研究中心的555例男性,其中490例进行主要结局分析。患者中位年龄为65岁(四分位距,59-70岁),PSA水平中位值为5.6 ng/mL(四分位距,4.4-8.0 ng/mL),直肠指检结果异常的患者比例为12.7%。
在检测具有临床意义的前列腺癌方面,双参数MRI非劣于多参数MRI。在490例男性中,双参数MRI检出143例(29.2%),而多参数MRI检出145例(29.6%)(差异为-0.4个百分点,95% CI:-1.2~0.4;P=0.50)。该结果与使用Gleason分级3级或更高级别来定义有临床意义的前列腺癌的敏感性分析结果一致(差异为-0.4个百分点,95% CI:-1.2~0.4)。
对于无临床意义前列腺癌的检测,双参数MRI和多参数MRI的比例分别为45/490例(9.2%)和47/490例(9.6%)(差异为-0.4个百分点,95% CI:-1.2~0.4)
双参数MRI和多参数MRI的灵敏度、特异度以及阳性预测值和阴性预测值相似(98.0% vs 99.3%、61.6% vs 60.1%、53.1% vs 52.5%和98.6% vs 99.5%)。敏感性(差异-1.4个百分点,95% CI:-3.9~1.2)和特异性(差异1.5个百分点,95% CI:-1.2~4.2)均无显著差异。使用PI-RADsv2.1评分系统替代Likert评分系统时,结果一致。
结论与临床意义:这项国际、多中心、非劣效性试验表明,在经验丰富的放射科医生中,如果图像质量足够,双参数MRI在癌症检测、分期和治疗计划方面的表现与多参数MRI非常相似。该研究提供了一级证据,表明双参数MRI可以作为多参数MRI的替代一线诊断方法,用于疑似前列腺癌的男性癌症诊断。
解读:在转移性激素敏感性前列腺癌的总体患者人群中,我们未发现标准治疗基础上加用二甲双胍能显著改善总生存期的证据。二甲双胍的副作用谱符合预期,主要为腹泻。与标准治疗组相比,二甲双胍组雄激素剥夺治疗的不良代谢副作用显著减少。
5. 2025年前列腺癌统计报告
发表期刊:CA Cancer J Clin
背景:前列腺癌已成为美国男性中最常见的恶性肿瘤,且晚期疾病发病率正快速攀升。本文概述美国当前前列腺癌统计数据,内容包括:按年龄分列的2025年新发病例与死亡病例预估数;基于截至2021年的发病数据与截至2023年的死亡数据,呈现不同年龄、种族和族裔的发病率、生存率、死亡率及其变化趋势;同时提供50岁及以上男性2023年全国与2020年各州的前列腺癌筛查普及率,以及追溯至2005年的全国趋势分析。
解读:发病率:在美国,约八分之一的男性(12.8%)一生中会患前列腺癌,预计2025年美国将新增313,780例前列腺癌病例。患病风险随年龄增长而迅速上升,50岁之前为0.2%,70-79岁男性中升至6.5%。约90%的诊断病例发生在80岁前的男性中,但仅约一半的死亡病例发生在该年龄段。黑人男性的发病率在所有种族和民族群体中最高(每10万人191.5例);比发病率第二高的白人男性高出67%,约为美洲印第安人/阿拉斯加原住民(AIAN)男性(每10万人99.1例)和西班牙裔男性(每10万人92.9例)的两倍。亚裔美国人和太平洋岛民(AAPI)男性的发病率最低(每10万人63.1例);然而,在广泛的亚裔人群中,各亚组的发病率差异很大(图3)。
生存率:美国前列腺癌的5年相对生存率为98%,15年相对生存率为97%,这主要是因为83%的男性在诊断时疾病处于局部或区域阶段,这些阶段的相对生存率接近100%。高发病率和高生存率导致该疾病的患病率很高;截至2022年1月1日,美国估计有350万男性有前列腺癌病史,是男性其他任何癌症的四倍多。白人男性的生存率最高(99%),亚裔美国人和太平洋岛民(AAPI)和西班牙裔男性的生存率最低(94%),这部分反映了后两者群体中早期诊断比例较低。
死亡率:美国预计2025年将有35,770例前列腺癌死亡病例,其中80%将发生在70岁及以上的男性中,近一半发生在80岁及以上的男性中。死亡率的种族差异比发病率更为显著。例如,尽管发病率较低,但AIAN男性的死亡率比白人男性高12%(图3)。黑人男性的死亡率(每10万人36.9例死亡)几乎是其他任何种族或民族群体的两倍,并且在各个年龄段均高于白人男性,死亡率比在85岁及以上男性中为1.61,在40-44岁男性中高达3.33。
筛查:前列腺特异性抗原(PSA)是一种由前列腺上皮细胞和前列腺癌细胞产生的血液生物标志物。血清PSA浓度于1986年首次获得美国食品药品监督管理局(FDA)批准用于监测疾病进展,但自1980年代末以来一直被用于筛查前列腺癌。PSA筛查可以在直肠指检发现或引起症状之前5到7年检测出前列腺癌,但也会导致过度诊断(即那些永远不会进展到引起症状或死亡的肿瘤)。通过更有针对性的筛查(包括用于风险评估的基因检测)和对低危疾病的保守管理来减少这些危害,一直是当代早期检测研究的重点。
结论:在2000年代后期和2010年代初期大部分时间呈下降趋势之后,美国前列腺癌发病率已持续上升近十年,各年龄段男性中远处转移期疾病的诊断均在增加,包括55岁以下男性每年增加近3%。黑人男性依然承受着最沉重的疾病负担,其死亡率是其他任何种族或民族群体的两倍,而AIAN男性的死亡率虽发病率较低却高于白人男性。晚期诊断病例的增加和持续存在的差异凸显了需要加倍努力以优化早期检测,并解决实现公平结局的障碍,包括改善所有男性获得高质量诊疗的机会。
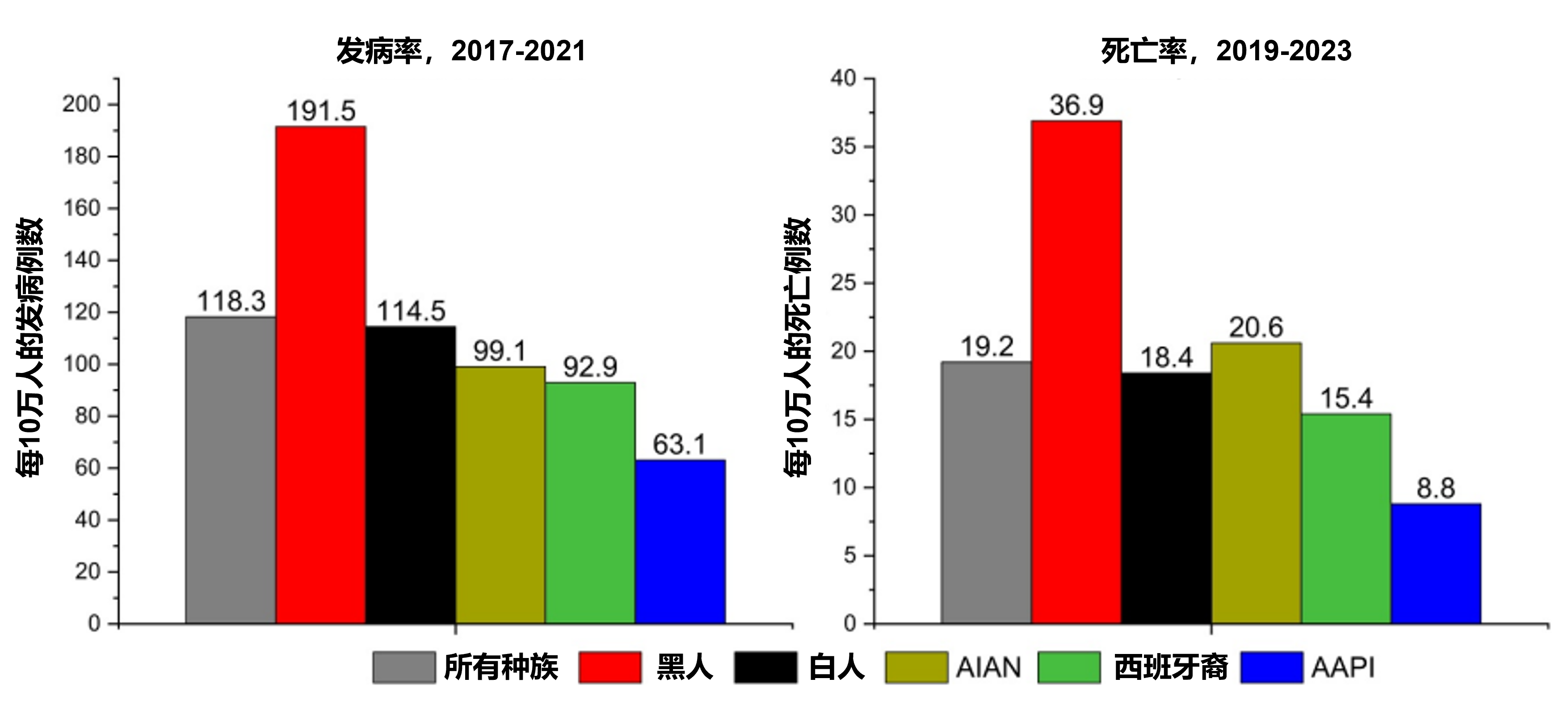
图3. 美国不同种族和族裔的前列腺癌发病率和死亡率
肾癌
6. 新型血浆代谢组学特征用于肾细胞癌检测的开发与验证
发表期刊:Eur Urol
背景:早期诊断对改善肾细胞癌(RCC)患者生存至关重要,但目前仍缺乏有效的实验室检测手段。本研究旨在系统解析RCC的代谢重编程特征,并开发一种基于人工智能(AI)的血浆代谢模型用于RCC检测。
方法:这项多中心诊断模型开发与验证研究于2019年12月至2023年10月期间从五家医院收集了RCC患者和健康对照(HC)的血浆样本。入组患者需经病理确诊且未接受过任何治疗;健康对照来自常规体检人群。排除有恶性肿瘤史的参与者。通过支持向量机进行非靶向血浆代谢组学研究,并通过高分辨率质谱技术进一步确认。研究鉴定出7种关键的血浆代谢标志物,建立了基于液相色谱-质谱的平行反应监测(PRM)靶向检测方法,并结合机器学习算法,使用选定的代谢物开发了一种人工智能(AI)辅助血浆代谢检测肾癌诊断模型——肾细胞癌人工智能检测器 (RCAID)。
关键发现:RCAID模型在来自全国5家医学中心的1680名参与者(包括920名RCC患者和760名HC)的六个独立验证队列中进行了多组分析以及训练和验证。RCC病例中,744例(81%)为透明细胞癌,633例(69%)为I期疾病。鉴定出7种关键血浆代谢物(2-羟基苯乙酸、壬二酸、N,N-二甲基甘氨酸、N-乙酰天冬氨酸、N-ε-乙酰赖氨酸、脯氨酸及(Z,Z)-4-氧代-2,5-庚二烯酸)并用于构建RCAID模型。RCAID模型在训练队列(n=503)中受试者工作特征曲线下面积(AUROC)达0.988,在预设阈值下判别准确度为0.952。研究进一步在两个回顾性验证队列中评估了RCAID模型的效能:在内部验证队列(n=202)中,该模型AUROC达0.977,准确率为0.906;在独立外部验证队列(n=158)中,AUROC为0.911,准确率达0.905。这些结果表明RCAID模型在肾细胞癌诊断中具有可靠的准确性与稳健性。为评估RCAID模型的可重复性与有效性,研究开展了包含五家医院346名参与者的多中心验证。结果显示,RCAID模型对早期RCC展现出卓越诊断性能:AUROC达0.945,准确率为0.902。在包含123名参与者的独立时间验证队列中,RCAID模型仍保持稳健性能,AUROC达0.972,准确率为0.911。值得注意的是,RCAID模型在训练集与合并验证队列中均表现出良好的校准度(图4)。
为进一步验证RCAID模型在不同临床场景中的适用性,研究分别建立了晚期RCC(n=179)和非透明RCC(n=169)独立验证队列,其AUROC分别达0.94和0.932。这些结果表明RCAID模型可广泛应用于不同分期和病理亚型的肾细胞癌检测。
结论:本研究揭示了肾细胞癌的代谢特征变化,成功开发出具有临床应用潜力的人工智能血浆代谢模型,为肾细胞癌诊断提供了新策略。
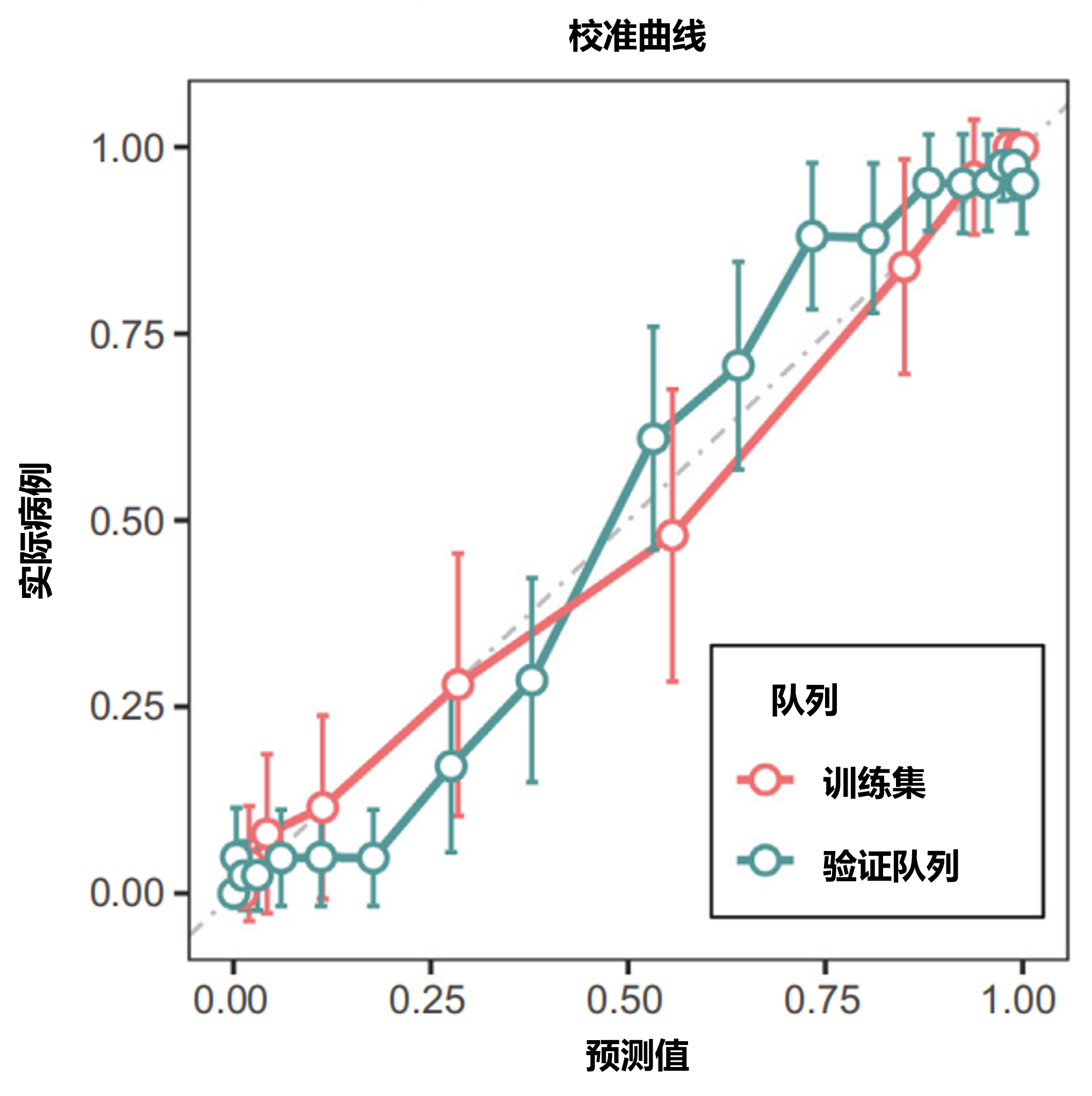
图4.训练集与验证队列中,基于RCAID评分预测的RCC检出情况与实际病例的校准曲线
7. 肾细胞癌新辅助治疗的病理缓解评估:国际肾癌新辅助治疗协作组关于取样及报告标准的系统综述与指南
发表期刊:Lancet Oncol
背景及目的:病理学缓解是评估多种肿瘤类型新辅助治疗疗效的替代性标志物,然而针对肾细胞癌的病理学反应报告标准尚未达成共识。在其他癌种中,已建立成熟的新辅助治疗病理缓解评估方案,例如国际黑色素瘤新辅助治疗联盟制定的标准,以及广泛应用于乳腺、胃肠和肺部肿瘤的评估体系。这些肿瘤中已观察到病理缓解程度与生存获益的相关性,病理缓解因此被用作临床试验终点。而在肾细胞癌领域,既往研究多采用影像学终点作为疗效判定标准。然而,对于如何评估新辅助治疗的病理缓解仍缺乏明确共识,病理缓解与生存结局的关联性亦有待证实。本研究旨在系统评估肾细胞癌病理缓解报告现状,并就新辅助治疗的组织处理与缓解报告制定推荐意见,以供临床试验使用并为未来标准临床实践提供依据。
方法:研究系统检索了PubMed和Web of SCIence在线数据库,筛选涉及肾细胞癌术前治疗缓解的相关文献。检索时间范围自数据库建库至2024年7月31日。在初步筛查的2959篇文献中,最终119篇纳入系统评价。分析发现肾细胞癌文献中的病理缓解报告存在高度异质性。现有报告方法的证据基础及反应程度判定阈值均显不足。建立统一的方法学体系是确立病理缓解程度与无病生存期、总生存期等肿瘤学结局关联的首要步骤,也是验证影像学与病理学反应一致性的基础。为此,制定了病理缓解报告指南,供临床试验使用并作为后续研究基础。
关键结果:国际肾癌新辅助治疗协作组(INKCC)关于肾细胞癌病理缓解报告的指导建议如表1所示:
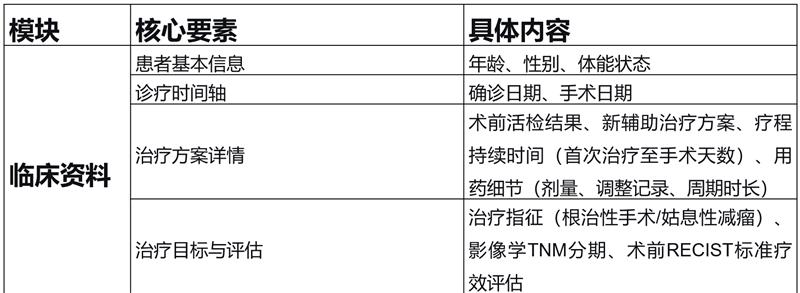
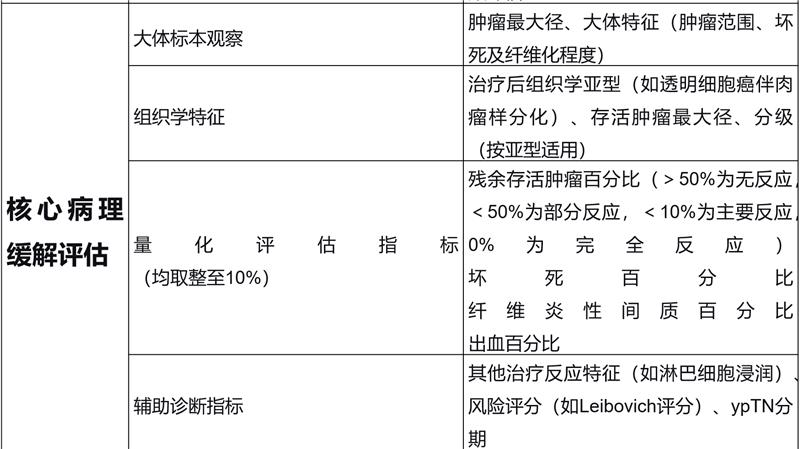
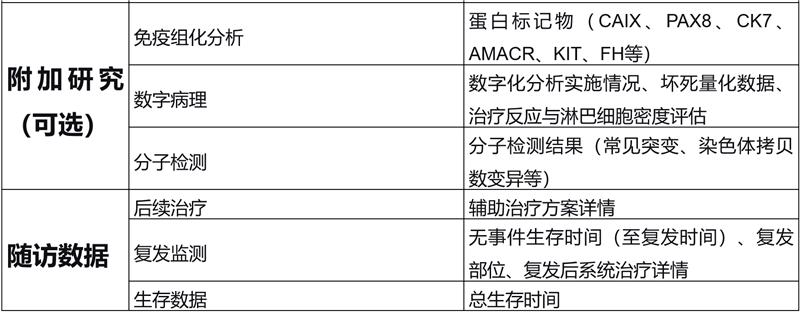
结论与意义:当前肾癌新辅助治疗病理缓解的报告存在显著差异性。因此提出了一套标准化评估与报告方法,旨在供研究使用并为未来标准临床实践提供参考。该领域在肾细胞癌新辅助治疗研究中仍属未满足的需求,亟需在后续研究中给予更多关注。
8. CheckMate 9ER III期随机临床试验:纳武利尤单抗联合卡博替尼治疗晚期肾细胞癌的最终分析结果
发表期刊:Ann Oncol
研究背景及目的:在III期CheckMate 9ER临床试验中,纳武利尤单抗联合卡博替尼(NIVO+CABO)相较于舒尼替尼(SUN),在未经治疗的晚期肾细胞癌(RCC)患者中展现出无进展生存期(PFS)、总生存期(OS)和客观缓解率(ORR)的显著优势。本次报告提供了中位随访5.6年后的最终更新疗效与安全性结果。
研究设计:CheckMate 9ER是一项在18个国家125家医院和癌症中心开展的开放标签、随机、III期临床试验。纳入患者符合年龄≥18岁;经组织学确诊为具有透明细胞成分的晚期/转移性RCC;既往未接受过针对晚期RCC的系统治疗;根据实体瘤疗效评价标准1.1版(RECIST;研究者评估)存在可测量病灶;卡氏功能状态评分≥70%;且不限国际转移性肾细胞癌数据库联盟(IMDC)预后风险分级。
患者按1:1比例随机分配至两个治疗组:一组接受NIVO(240 mg每2周静脉注射)联合CABO(40 mg每日一次口服);另一组接受SUN单药治疗。治疗持续至疾病进展或出现不可耐受毒性,其中NIVO最长用药时间为2年。
随机化分层因素包括:国际转移性肾细胞癌数据库联盟(IMDC)预后风险评分(0分 vs 1-2分 vs 3-6分)、地理区域(加拿大/欧洲/美国 vs 世界其他地区)以及肿瘤程序性死亡配体1(PD-L1)表达水平(≥1% vs <1%或无法判定)。
研究终点:研究主要终点为经盲态独立中心审查(BICR)基于RECIST v1.1标准评估的PFS;次要终点包括OS、经BICR基于RECIST v1.1评估的ORR及安全性。
结果:在2017年9月11日至2019年5月14日期间,共323例患者被随机分配至NIVO+CABO组,328例患者分配至SUN组。两组最终各有320例患者接受研究治疗方案。在所有接受治疗的患者中(NIVO+CABO组320例;SUN组320例),NIVO+CABO组仍有21例(6.6%)患者持续接受治疗,SUN组为15例(4.7%)。
在意向治疗(ITT)人群中,经BICR评估,NIVO+CABO组的PFS显著优于SUN组(HR=0.58,95% CI:0.49-0.70)(图5A)。NIVO+CABO组和SUN组的中位PFS分别为16.4个和8.3个月,两组60个月PFS率分别为13.6%和3.6%。ITT人群中OS同样显示NIVO+CABO组更具优势(HR=0.79,95% CI:0.65-0.96)(图5B)。NIVO+CABO组和SUN组的中位OS分别为46.5个月和35.5个月,两组60个月OS率分别为40.9%与35.4%。
在ITT人群中, NIVO+CABO组的缓解情况优于SUN组。NIVO+CABO组和SUN组的ORR分别为55.7%和27.4%。NIVO+CABO组较SUN组的完全缓解(CR)率更高(13.9% vs 4.6%),疾病进展(PD)率更低(6.5% vs 14.3%)。与SUN组相比,NIVO+CABO组实现深度部分缓解(PR)的患者更多:NIVO+CABO组中20.1%的患者达到肿瘤缩小≥60%的PR,21.7%的患者达到肿瘤缩小<60%的PR;而SUN组中这两类缓解的患者比例分别为8.5%和14.3%。NIVO+CABO组的中位缓解时间为2.8个月,短于SUN组的4.3个月。NIVO+CABO组的缓解持续时间也更长,其中位缓解持续时间(DOR)为22.0个月,而SUN组为15.2个月;两组60个月持续缓解率分别为22.0%与10.0%。
安全性方面,NIVO+CABO组分别有97.5%和 67.8%的患者发生任何级别和3-4级治疗相关不良事件(AEs);SUN组分别有93.1%和55.0%的患者发生任何级别和3-4级治疗相关AEs。NIVO+CABO组最常见的3-4级治疗相关AEs为高血压(13.1%)、手足综合征(7.8%)和腹泻(7.2%);SUN 组最常见的3-4级治疗相关AEs为高血压(12.5%)和手足综合征(8.1%)。
结论与意义:综上所述,CheckMate 9ER试验中位随访5.6年的最终结果表明,NIVO+CABO方案可带来持久的临床获益,且安全性可控,进一步确立了该联合方案作为晚期肾细胞癌一线治疗的标准地位。
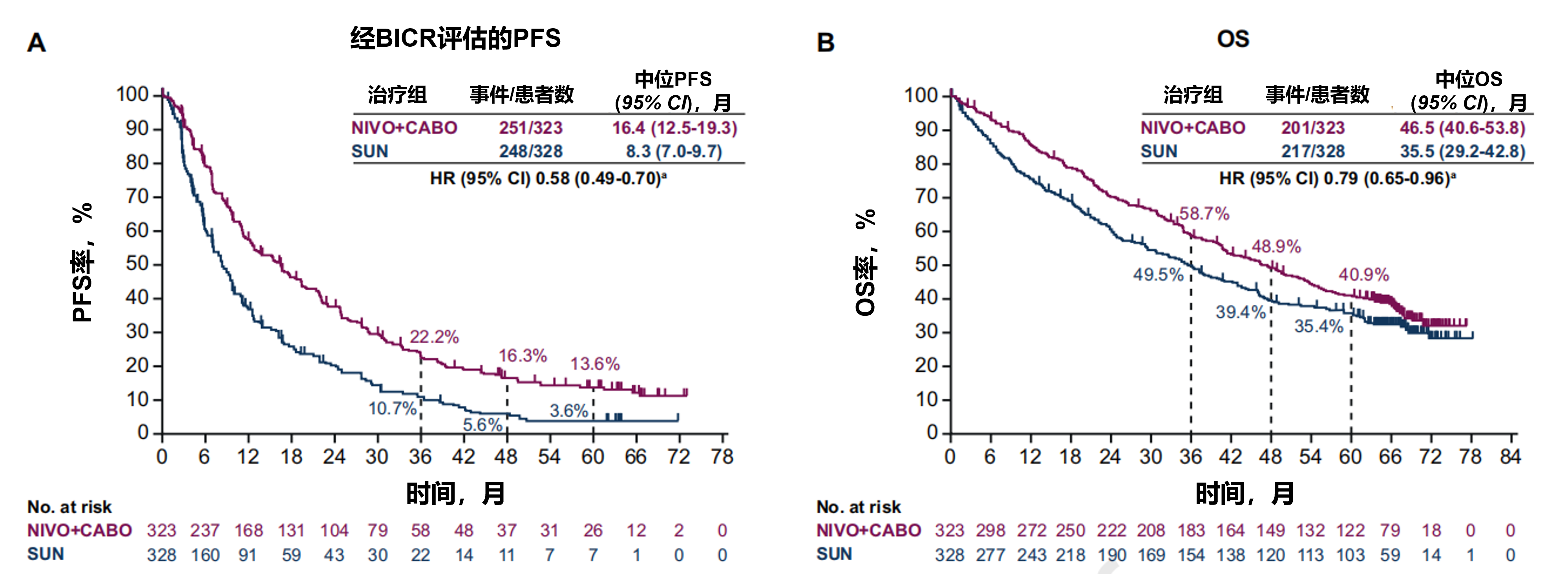
图5. ITT人群中经BICR评估的PFS(A)和OS(B)
膀胱癌
9. 肌层浸润性膀胱癌患者保留膀胱的下一代围手术期试验终点
发表期刊:J Clin Oncol
背景及目的:随着肌层浸润性膀胱癌(MIBC)治疗格局的不断发展,亟需通过创新临床试验设计来评估以保留膀胱为目标的围手术期策略。为建立标准化结局指标以评估MIBC器官保留策略,国际膀胱癌小组(IBCG)与全球罕见泌尿生殖系统肿瘤学会(GSRGT)共同组建了一个国际多学科共识专家组。
方法:IBCG与GSRGT汇集了全球膀胱癌专家及患者权益代表,共同构建针对MIBC的风险适应性保膀胱治疗框架。各工作组通过文献回顾制定推荐意见草案,并于2024年12月在米兰举行的现场会议进行讨论,会议期间专家组采用改良Delphi,通过实时投票生成包含核心共识声明(涉及临床完全缓解[cCR]、无事件生存期[EFS]、总生存期[OS]及其在临床研究中的应用等关键终点)的会后匿名问卷。共识标准设定为≥75%的赞同率,对于会议期间达成≥75%共识度的推荐条款,专家组进行了进一步修订与完善。
结果:共识专家组建议,临床试验中的cCR定义应同时满足以下所有标准:膀胱活检(包括pTa/pT1/pTis分期)未见高级别恶性肿瘤证据(除新辅助治疗前已知肌层浸润性膀胱癌病灶的再切除经尿道膀胱肿瘤切除术[reTURBT]或活检外,还需涵盖所有视觉异常区域的取样),尿液细胞学检查未见恶性细胞,且横断面影像学检查无明确局部或转移性疾病证据。此外,专家组建议基线肿瘤分期及诊断性reTURBT的完整性宜作为试验中的分层因素。对于MIBC,cCR率有望作为药效学终点。共识专家组推荐将cCR作为早期单臂试验的合适主要终点。需要强调的是,cCR作为时间-事件终点替代指标的有效性——即其捕捉随时间推移产生的临床意义获益的能力——尚未在验证性研究场景中得到确认。因此,在注册性与后期试验中,共识专家组不建议将cCR用作主要或共同主要终点。
时间-事件终点(例如EFS、膀胱完整无事件生存期[BI-EFS]、无转移生存期[MFS]、疾病特异性生存期或总生存期[OS])是评估包括MIBC在内的各类癌症治疗能否实现长期缓解或根治的核心指标。专家组建议,用于EFS评估的事件定义应涵盖全身治疗期间或治疗后出现的任何高级别肿瘤持续存在、复发或进展,以及后续接受任何标准治疗(包括根治性膀胱切除术[RC]、膀胱放疗和膀胱内灌注治疗)的情况。共识专家组推荐在意向性治疗人群中采用EFS作为新一代保膀胱试验的合适主要终点,这些试验面向达到临床完全缓解(cCR)的患者(包括具有注册性意图的研究)。
在评估保膀胱策略的围手术期临床试验中,采用标准化工具并预设统计方案对患者报告的生活质量结局进行系统评估与报告,宜作为次要终点纳入研究设计。
结论:综上所述,国际膀胱癌小组与全球罕见泌尿生殖系统肿瘤学会(IBCG-GSRGT)提出了新颖且明确的共识建议,为下一代临床试验的标准化开发提供指导框架。这些试验旨在通过评估高效治疗实现cCR后的膀胱保留效果,并采用个体化、反应驱动的适应性研究设计,从而推动MIBC领域的进步。
10. TAR-200联合cetrelimab对比cetrelimab单药治疗作为新辅助治疗用于不能接受或拒绝含顺铂新辅助化疗的肌层浸润性膀胱癌患者的疗效与安全性(SunRISe-4研究):一项随机、开放标签II期临床试验的中期分析结果
发表期刊:Lancet Oncol
背景与目的:对于不适合或拒绝含顺铂新辅助化疗的患者,可选治疗方案有限。此外,高达半数的肌层浸润性膀胱癌患者因肾功能不全、神经病变、体能状态差、听力损伤、高龄或心血管功能障碍等原因不适合接受含顺铂新辅助化疗,且相当比例患者选择主动拒绝该治疗方案。TAR-200是一种新型靶向释放系统,其结构设计旨在膀胱内实现吉西他滨的持续局部给药。cetrelimab则是一种通过结合并抑制PD-1信号通路发挥作用的单克隆抗体。在肌层浸润性膀胱癌患者的新辅助治疗中,联合应用针对膀胱原发灶的局部消融、TAR-200局部给药以及cetrelimab全身治疗,有望同步提升该人群的病理完全缓解率与长期肿瘤学结局。本研究旨在评估新辅助TAR-200联合cetrelimab对比cetrelimab单药治疗方案,在计划接受根治性膀胱切除术但不适用或拒绝含顺铂新辅助化疗的肌层浸润性膀胱癌患者中的疗效与安全性。本文报告该项试验预设中期分析的结果。
方法:SunRISe-4是一项正在进行的随机、开放标签、II期临床试验,在10个国家的109个研究中心开展。符合入选标准的患者需满足:年龄≥18岁;新确诊经组织学证实的肌层浸润性膀胱癌(临床分期cT2-cT4 N0M0);美国东部肿瘤协作组(ECOG)体能状态评分为0-1分;计划接受根治性膀胱切除术;且经评估不适用或主动拒绝含铂类药物新辅助化疗。患者按5:3的比例随机分配至新辅助TAR-200联合cetrelimab组或cetrelimab单药组。研究根据经尿道膀胱肿瘤切除术结果(肉眼完全切除 vs 不完全切除且残留≤3 cm)以及肿瘤分期(初始诊断cT2期 vs cT3-4a期)进行分层。
研究终点:主要终点为经中心实验室确认的病理学完全缓解;次要终点包括无复发生存期与安全性;关键探索性终点为病理学总体缓解率。
主要结果:研究于2022年7月7日至2024年5月31日,共196例患者接受筛选,其中122例完成随机分组(TAR-200联合cetrelimab组80例,cetrelimab单药组42例)。在可评估疗效人群中(中位随访时间23.5周),TAR-200联合cetrelimab组的病理学完全缓解率为42%,cetrelimab单药组为23%。预设探索性分析显示,TAR-200联合cetrelimab组的病理学总体缓解率达60%,而cetrelimab单药组为35%。
在安全性分析集中,两组患者的中位随访时间(根治性膀胱切除术后)均为10.2周。TAR-200联合cetrelimab组中有72%、cetrelimab单药组中有44%的患者出现治疗相关不良事件。TAR-200联合cetrelimab组和cetrelimab单药组中≥3级治疗相关不良事件发生率分别为11%和5%;严重治疗相关不良事件发生率分别为11%和2%;免疫相关不良事件发生率分别为37%和44%。
结论与临床意义:SunRISe-4研究首次证实,对于不能接受或拒绝含顺铂新辅助化疗的肌层浸润性膀胱癌患者,在全身性检查点抑制剂基础上联合局部TAR-200吉西他滨膀胱内给药系统作为新辅助治疗可带来获益。目前生存数据仍在不断完善中,未来分析将深入探讨新辅助TAR-200联合cetrelimab对肌层浸润性膀胱癌患者总生存期的影响。这些结果为继续探索TAR-200在局限性膀胱癌患者中的应用提供了有力支持。
参考文献
- Kishan AU, Juarez Casillas JE, et al. Stereotactic Intensity-modulated Radiotherapy After Radical Prostatectomy (SCIMITAR): 4-Year Outcomes of a Phase 2 Clinical Trial[J]. Eur Urol. 2025 Sep 30:S0302-2838(25)04699-8.
- Belliveau C, Saad F, Duplan D, et al. Prostate-SpeCIfic Membrane Antigen PET-Guided Intensification of Salvage Radiotherapy After Radical Prostatectomy: A Phase 2 Randomized Clinical Trial[J]. JAMA Oncol. 2025 Oct 2.
- Shao L, Liang C, Yan Y, et al. An MRI-pathology foundation model for noninvasive diagnosis and grading of prostate cancer[J]. Nat Cancer. 2025 Sep 2.
- Ng ABCD, Asif A, Agarwal R, et al. Biparametric vs Multiparametric MRI for Prostate Cancer Diagnosis: The PRIME Diagnostic Clinical Trial. JAMA[J]. 2025 Oct 7;334(13):1170-1179.
- Kratzer TB, Mazzitelli N, Star J, et al. Prostate cancer statistics, 2025[J]. CA Cancer J Clin. 2025 Sep 2.
- Huang C, Wang G, Yuan Y, et al. Development and Validation of a Novel Plasma Metabolomic Signature for the Detection of Renal Cell CarCInoma[J]. Eur Urol. 2025 Oct 4:S0302-2838(25)04698-6.
- Blackmur JP, van der Mijn JCK, Warren AY, et al. Assessing pathological response to neoadjuvant therapy in renal cell carCInoma: a systematic review and guidelines for sampling and reporting standards from the International Neoadjuvant Kidney Cancer Consortium[J]. Lancet Oncol. 2025 Oct;26(10):e536-e546.
- Motzer RJ, Escudier B, Burotto M, et al. Final analysis of nivolumab plus cabozantinib for advanced renal cell carCInoma from the randomized phase III CheckMate 9ER trial[J]. Ann Oncol. 2025 Sep 23:S0923-7534(25)04714-3.
- Necchi A, Galsky MD, Dizman N, et al. End Points for the Next-Generation Bladder-Sparing Perioperative Trials for Patients With Muscle-Invasive Bladder Cancer[J]. J Clin Oncol. 2025 Sep 11:JCO2501608.
- Necchi A, Guerrero-Ramos F, Crispen PL, et al. TAR-200 plus cetrelimab versus cetrelimab monotherapy as neoadjuvant therapy in patients with muscle-invasive bladder cancer who are ineligible for or decline neoadjuvant CIsplatin-based chemotherapy (SunRISe-4): interim analysis of a randomised, open-label phase 2 trial[J]. Lancet Oncol. 2025 Oct;26(10):1312-1322.



