本品适用于复发性或难治性前体B细胞急性淋巴细胞性白血病(ALL)成年患者1。
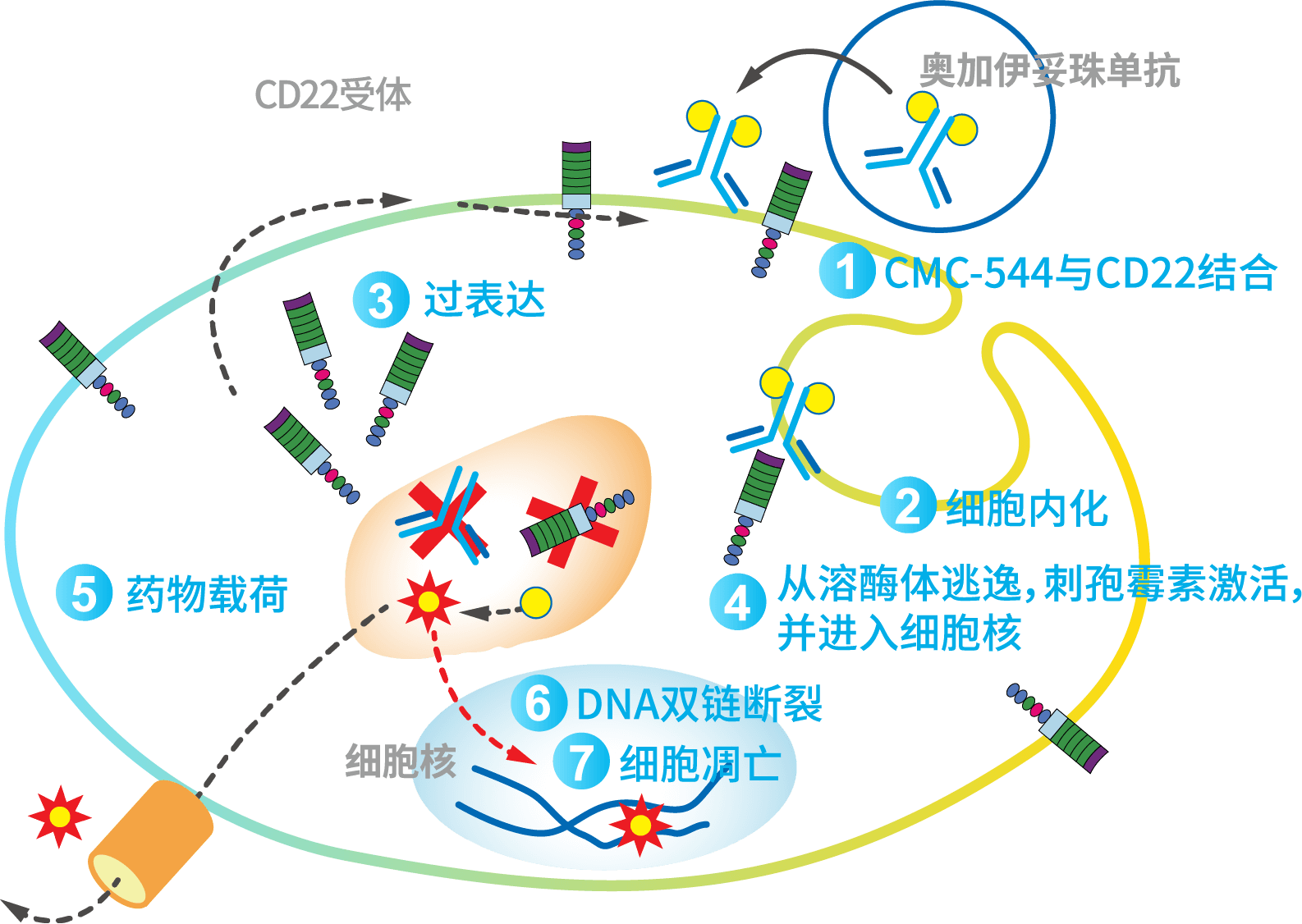
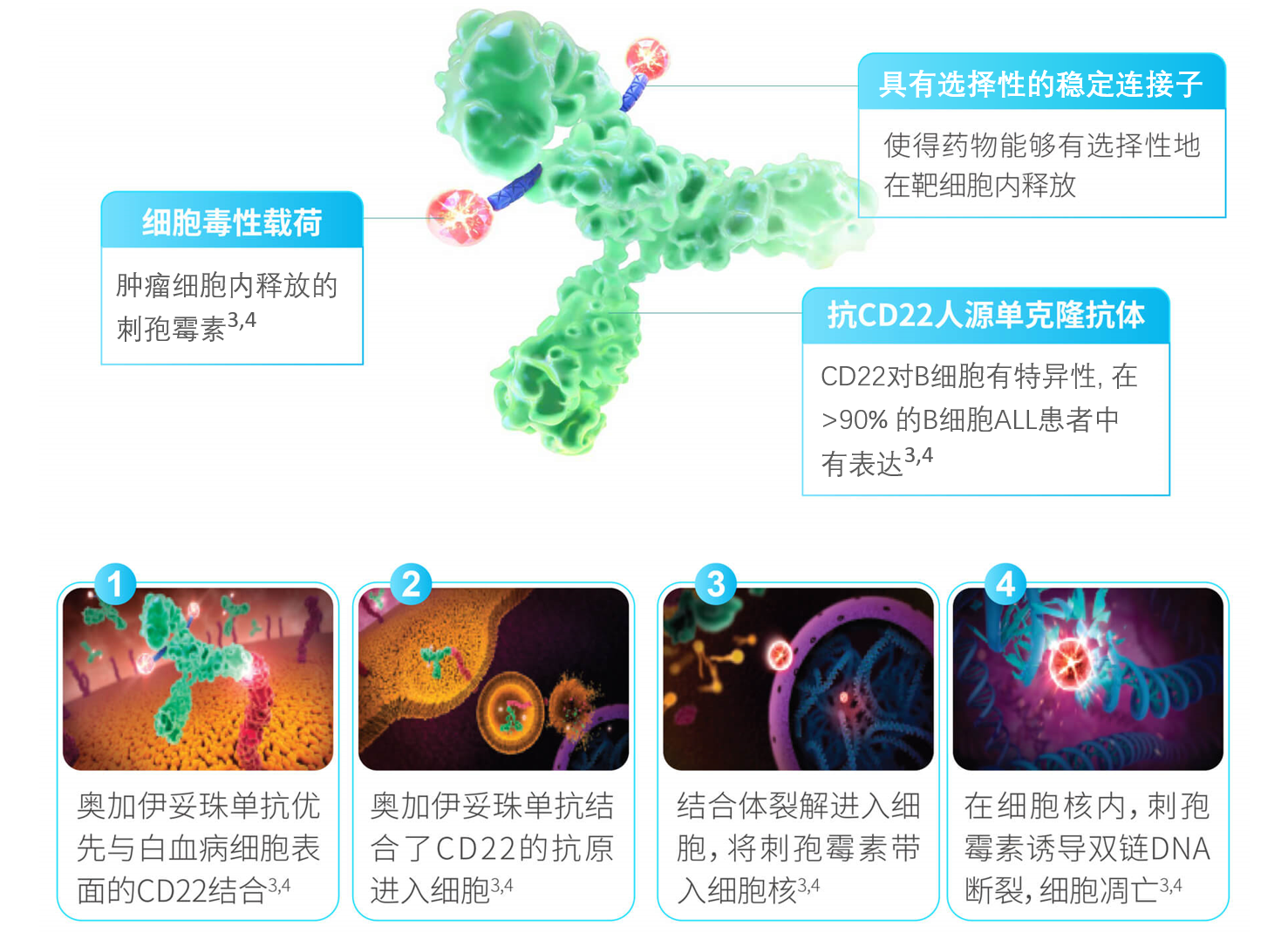
- 奥加伊妥珠单抗是第一个批准用于急性淋巴细胞白血病(R/R B-ALL)的能够特异性识别CD22的独特的治疗手段1,2。
- CD22广泛表达于B细胞的急性淋巴细胞白血病中(90%以上的患者)1,2。
- 奥加伊妥珠单抗能够与细胞表面的CD22结合,抗原-抗体复合物能够通过与细胞表面的CD22结合而加速细胞内化1,2。
- 刺孢霉素在细胞内释放,刺孢霉素比其他化疗药物更具有抗癌潜力,刺孢霉素能够与DNA结合,引起DNA双链断裂。DNA双链断裂后进一步引发细胞凋亡1,2。
推荐剂量1
在每次给药前预先处理(参见下文)。
- 第一个周期,针对所有患者,本品每个周期的推荐总剂量为1.8mg/m2,分3次给药,分别在第1天(0.8mg/m2)、第8天(0.5mg/m2)和第15天(0.5mg/m2)给药。第1周期的持续时间为3周,但如果患者达到完全缓解(CR)或完全缓解伴血液学不完全恢复(CRi),以及/或者为从毒性中恢复,则可以将第1周期延长至4周。
- 在后续周期内:
- 对于达到CR或CRi的患者,本品每个周期的推荐总剂量为1.5mg/m2,分3次给药,分别在第1天(0.5mg/m2)、第8天(0.5mg/m2)和第15天(0.5mg/m2)给药。后续周期的持续时间均为4周。或
- 对于未达到CR或CRi的患者,本品每个周期的推荐总剂量为1.8mg/m2,分3次给药,分别在第1天(0.8mg/m2)、第8天(0.5mg/m2)和第15天(0.5mg/m2)给药。后续周期的持续时间均为4周。在3个周期内未达到CR/CRi 的患者应停止本品治疗。
- 对于需要接受造血干细胞移植(HSCT)的患者,则推荐的本品的治疗周期为2个。对于在2 个周期的治疗后仍未达到CR/CRi和未获得微小残留病(MRD)反应的患者,可以考虑对其进行第三个周期的治疗。
- 对于不需要接受HSCT的患者,可接受后续治疗,最大周期数不超过6个。
周期及根据治疗应答情况判定的后续周期给药方案
| 第1天 | 第8天a | 第15天a | |
|---|---|---|---|
| 适用于第1周期的给药方案 | |||
| 所有患者: | |||
| 剂量b | 0.8mg/m2 | 0.5mg/m2 | 0.5mg/m2 |
| 周期时长 | 21天c | ||
| 根据治疗应答情况判定适用于后续周期的给药方案 | |||
| 达到CRd或CRie的患者: | |||
| 剂量b | 0.5mg/m2 | 0.5mg/m2 | 0.5mg/m2 |
| 周期时长 | 28天f | ||
| 未达到CRd或CRie的患者: | |||
| 剂量b | 0.8mg/m2 | 0.5mg/m2 | 0.5mg/m2 |
| 周期时长 | 28天f | ||
缩略语:CR=完全缓解;CRi=完全缓解伴血液学不完全恢复。
- +/-2天(两次给药至少间隔6天)。
- 根据患者的体表面积(m2) 确定给药剂量。
- 对于达到CR或CRi的患者,以及/或者为从毒性反应中恢复,周期时长可以延长至28天(即自第21天起开始为期7天的无治疗间期)。
- CR 定义为骨髓中原始细胞<5%,并且外周血中无白血病原始细胞,外周血计数完全恢复(血小板≥100×109/L和中性粒细胞绝对计数[ANC]≥1×109/L),以及髓外疾病缓解。
- CRi 的定义为骨髓中原始细胞<5%,并且外周血中无白血病原始细胞,外周血计数不完全恢复(血小板<100×109/L 和ANC<1×109/L),以及髓外疾病缓解。
- 自第 21 天起开始为期 7 天的无治疗间期。
建议给药前预处理和细胞减灭
- 在用药前,建议使用皮质类固醇、解热药和抗组胺药进行预先处理。在输液期间和输液结束后至少1 小时内,应观察患者是否出现输液相关反应的症状。
- 对于外周血循环中有淋巴原始细胞的患者,在首次给药之前,建议与羟基脲、类固醇和/或长春新碱联合用药进行细胞减灭,使外周原始细胞计数≤ 10,000/mm3。
针对血液系统毒性的本品剂量调整1
| 标准 | 本品剂量调整 |
|---|---|
| 如果在本品治疗之前ANC≥1×109/L | 如果ANC降低,则暂时中断下一个周期治疗,直至ANC恢复至≥1×109/L。如果ANC 降低持续超过28天,并且怀疑与本品相关,则停用本品。 |
| 如果在本品治疗之前血小板计数≥50×109/La | 如果血小板计数降低,则暂时中断下一个周期治疗,直至血小板计数恢复至≥50×109/La。如果低血小板计数持续超过28天,并且怀疑与本品相关,则停用本品。 |
| 如果在本品治疗之前ANC<1×109/L 和/或血小板计数<50×109/La | 如果ANC 或血小板计数降低,则中断下一个周期治疗,直至出现至少以下一种情况: - ANC 和血小板计数至少恢复至前一个周期的基线水平,或者 - ANC 恢复至≥1×109/L,并且血小板计数恢复至≥50×109/La,或者 - 疾病稳定或改善(根据最近的骨髓评估),并且认为ANC和血小板计数降低是由于基础疾病所致(而不是本品相关毒性所致)。 |
缩略词:ANC=中性粒细胞绝对计数。
- 指导给药的血小板计数应该排除输血的影响。
针对非血液学毒性的本品剂量调整1
| 非血液学毒性 | 剂量调整 |
|---|---|
| VOD 或其他严重肝毒性 | 永久停止治疗。 |
| 总胆红素>1.5×ULN,并且AST或ALT>2.5×ULN | 除非是由于吉尔伯特综合征(Gilbert’s syndrome)或红细胞溶解所致,否则中断给药,直至每次给药之前总胆红素恢复至≤1.5×ULN,并且AST 或ALT 恢复至≤2.5×ULN。如果总胆红素未恢复至≤1.5×ULN,或者AST或ALT未恢复至≤2.5×ULN,则永久停止治疗 |
| 输液相关反应 | 中断输液并进行适当的医学处理。根据输液相关反应的严重程度,考虑停止输液或者给予类固醇和抗组胺药物。对于严重或危及生命的输液反应,永久停止治疗。 |
| ≥ 2 级的非血液学毒性a | 中断治疗,直至在每次给药之前恢复为 1 级或治疗前的级别水平。 |
缩略语:ALT=丙氨酸氨基转移酶;AST=天冬氨酸氨基转移酶;ULN=正常值上限;VOD=肝小静脉闭塞病。
- 根据美国国立癌症研究所制定的不良事件通用术语标准(NCI CTCAE)(第3.0版)对严重程度进行分级。
根据非血液学毒性导致给药中断的持续时间进行本品剂量调整1
| 毒性所致给药中断持续时间 | 剂量调整 |
|---|---|
| <7天(一个周期内) | 中断下一次给药(两次给药至少间隔6天)。 |
| ≥7天 | 跳过该周期内的下一次给药。 |
| ≥14天 | 一旦充分恢复,下一个周期的总剂量减少25%。如果需要进一步调整剂量,则将后续周期的给药次数减为每个周期2次。如果总剂量减少25%且每个周期减少到2次给药仍无法耐受,则永久停止治疗。 |
| >28天 | 考虑永久停止治疗。 |
除非另有说明,内源因素对于奥加伊妥珠单抗药代动力学的影响使用了群体药代动力学分析进行评估。年龄(18至92岁)、性别和种族(亚裔与非亚裔[高加索人、黑人和未指明])对奥加伊妥珠单抗的药代动力学无具有临床意义的影响。体表面积对奥加伊妥珠单抗分布有显著影响。奥加伊妥珠单抗给药剂量根据体表面积而定。
【孕妇及哺乳期妇女用药】1
妊娠
风险总结
基于其作用机制和动物研究结果,孕妇使用本品可能会引起胚胎-胎儿损害。目前没有关于孕妇使用奥加伊妥珠单抗的相关数据,无法提供与药物相关的出生缺陷和流产风险的信息。在大鼠胚胎-胎仔发育研究中,奥加伊妥珠单抗母体系统暴露量是患者使用最大推荐剂量后暴露量的≥0.4倍时导致了胚胎-胎仔毒性(基于AUC)。如果在妊娠期间使用本品或患者在使用本品治疗期间妊娠,应将药物对胎儿产生的潜在风险告知患者。
不论母体健康状况如何或是否使用了药物,均会发生妊娠期不良结果。对于指定人群,估计的主要先天缺陷和流产的背景风险尚不明确。
哺乳
风险总结
关于本品或其代谢物是否在人类乳汁中分泌、对母乳喂养婴儿的影响或对乳汁分泌的影响,目前尚无相关数据。由于母乳喂养婴儿可能会发生不良反应,因此应告知女性在接受本品治疗期间和末次给药后至少2 个月内不要进行母乳喂养。
具有生育潜能的女性和男性
妊娠试验
基于其作用机制和动物研究结果,孕妇使用本品时可能会引起胚胎-胎儿损害。在开始本品治疗前,核实有怀孕可能的女性患者的妊娠状态。
避孕
女性
建议有怀孕可能的女性患者在使用本品时避免妊娠。建议有怀孕可能的女性患者在接受本品治疗期间以及末次给药后至少8个月内采取有效的避孕措施。
男性
建议女性伴侣有怀孕可能的男性患者在接受本品治疗期间以及末次给药后至少5个月内采取有效的避孕措施。生育力基于动物研究结果,奥加伊妥珠单抗可能损害具有生育潜能的雄性及雌性动物的生育力。
【儿童用药】1
尚未确定本品在儿童患者中的安全性和有效性。
【老年用药】1
在INO-VATE ALL试验中,接受奥加伊妥珠单抗治疗的患者中有30/164 (18%)名患者≥65岁。未发现年龄较大患者与年龄较小患者之间存在治疗反应上的差异。
根据一项基于765名患者的群体药代动力学分析,不需要根据年龄调整起始剂量
肝功能不全1
总胆红素≤1.5×ULN且AST/ALT≤2.5×ULN的患者使用本品时,不需要调整起始剂量。关于在给药前总胆红素>1.5×ULN和/或AST或ALT>2.5×ULN的患者中的安全性信息有限。除非是由于吉尔伯特综合征(Gilbert’s syndrome)或者红细胞溶解所致,否则应中断给药,直至在每次给药之前总胆红素恢复至≤1.5×ULN且AST或ALT恢复至≤2.5×ULN。如果总胆红素未恢复至≤1.5×ULN或AST或ALT未恢复至≤2.5×ULN,则应永久停止治疗。
肾功能不全1
轻度、中度或重度肾功能损害(肌酐清除率[CLcr]分别为60-89mL/min、30-59mL/min或15-29mL/min)的患者无需调整起始剂量。本品在终末期肾病患者中的安全性和有效性尚未研究。
对本品活性成份或任何辅料过敏的患者
既往发生经确认的重度或存在持续性VOD/SOS的患者。
患有严重的持续性肝病(例如肝硬化、结节性再生性增生、活动性肝炎)的患者。
本品未进行系统的药物相互作用研究,体外研究数据表明:
代谢途径和转运体系统对本品的影响
N-乙酰-γ-刺孢霉素二甲酰肼为P糖蛋白(P-gp)的底物。
本品对代谢途径和转运体系统的影响
在临床相关浓度下,N-乙酰-γ-刺孢霉素二甲酰肼产生以下效应的几率较低:
- 抑制细胞色素P450 (CYP450)酶:CYP1A2、CYP2B6、CYP2C8、CYP2C9、CYP2C19、CYP2D6和CYP3A4/5。
- 诱导CYP450酶:CYP1A2、CYP2B6和CYP3A4。
- 抑制UGT酶:UGT1A1、UGT1A4、UGT1A6、UGT1A9和UGT2B7。
- 抑制药物转运体:P-gp、乳腺癌耐药蛋白(BCRP)、有机阴离子转运体(OAT)1和OAT3、有机阳离子转运体(OCT)2和有机阴离子转运多肽(OATP)1B1以及OATP1B3。
在临床相关浓度下,本品产生以下效应的几率较低:
- 抑制CYP450酶:CYP1A2、CYP2A6、CYP2B6、CYP2C8、CYP2C9、CYP2C19、CYP2D6和CYP3A4/5。
- 诱导CYP450酶:CYP1A2、CYP2B6和CYP3A4。
延长QT间期的药物
本品与已知可延长QT间期或诱发尖端扭转性室性心动过速的药物合并使用,可能增加有临床意义的QTc间期延长的风险。在患者使用本品时,应停止合并用药或者使用不延长QT/QTc间期的替代合并药物。如果无法避免合并使用已知可延长QT/QTc的药物,在开始治疗前、开始使用已知可延长QTc的任何药物之后,应获得ECG和电解质检测结果,并且在治疗期间根据临床指征定期监测
【配置】1
【复溶、稀释和给药指南】
本品复溶和稀释后需避光保存。请勿冷冻复溶后的或稀释后的溶液。
从复溶到给药结束之间的最长时间应≤8小时,从复溶到稀释之间的时间应≤4小时。
复溶
- 本品为细胞毒性药物。请遵循适用的特殊处理和弃置方法。
- 计算所需的本品给药剂量(mg)和瓶数。
- 每瓶使用4mL无菌注射用水复溶,复溶后本品浓度为0.25 mg/mL,吸取药量为3.6 mL(0.9 mg)。
- 轻轻旋转药瓶加速溶解。请勿摇晃。
- 检查复溶溶液中是否出现颗粒物和变色。复溶溶液应为澄清至乳状、无色至微黄色,且不含可见异物。
- 复溶溶液的储存时间和条件见下表。
稀释
- 根据患者体表面积,计算获得适当剂量所需的复溶溶液的体积。使用注射器从药瓶中取出所需量。丢弃瓶中剩余的未使用的本品复溶溶液。
- 将复溶溶液添加至含有0.9%氯化钠注射液的输液容器中,获得50 mL的总容积。建议使用由聚氯乙烯(PVC)(二-2-乙基己基苯二甲酸酯,含DEHP或不含DEHP)、聚烯烃(聚丙烯和/或聚乙烯)或乙烯-醋酸乙烯酯(EVA)制成的输液容器。
- 轻轻倒置输液容器以混合稀释溶液。请勿摇晃。
- 稀释溶液的储存时间和条件见下表。
给药
- 稀释溶液给药之前及给药期间的储存时间和条件见下表 。
- 不需要过滤稀释的溶液。然而,如果要过滤稀释溶液,建议使用由聚醚砜(PES)、聚偏氟乙烯(PVDF)或亲水性聚砜(HPS)制成的滤膜。切勿使用尼龙或混合纤维素酯(MCE)制成的滤膜。
- 以50mL/h的速率在室温下(20–25℃)将稀释溶液进行1小时的输液。建议使用由PVC(含DEHP 或不含DEHP)、聚烯烃(聚丙烯和/或聚乙烯)或聚丁二烯制成的输液管。
请勿将本品与其他药品混合使用或与其他药品混合输注。
本品复溶、稀释及给药的储存时间和条件
| 从复溶到给药结束之间的最长时间应≤ 8 小时 | ||
|---|---|---|
| 复溶溶液 | 稀释溶液 | |
| 开始稀释后 | 给药 | |
| 本品不含抑菌防腐剂。复溶后立即使用,或冷藏(2–8℃)不超过4小时内使用。避光。请勿冻存 | 稀释后立即使用,或在室温下(20–25℃)储存不超过4小时或冷藏(2–8℃)储存不超 过3 小时内使用。避光。请勿 冻存。 | 如果将稀释溶液冷藏(2 – 8℃),则在给药前需用大约1小时将其平衡至室温(20 – 25℃)。在复溶后8小时内,以50 mL/h的速率在室温下(20 – 25℃)输注稀释溶液1小时。避光。 |
【贮藏】1
在原始包装中避光冷藏(2-8℃)及运输。请勿冻存。
复溶和稀释后的储存条件参见【用法用量】。
INO-VATE 研究期刊文献
2016《N Engl J Med》杂志
Inotuzumab Ozogamicin versus Standard Therapy for Acute Lymphoblastic Leukemia
2017《Lancet Haematol》杂志
2018《Bone Marrow Transplant》杂志
Management of important adverse events associated with inotuzumab ozogamicin: expert panel review
2018《Cancer》杂志
2019《Cancer》杂志
2019《Int J Hematol》杂志
2020《Leuk Res》杂志
2020《Blood Cancer J》杂志
2021《Clin Cancer Res》杂志
INO-VATE 研究会议报道
2016 EHA会议
2017 ASH会议
2019 EHA会议
如需核心研究原文,请您联系辉瑞医学信息部: [email protected], 或通过辉瑞医学信息网站在线提问获取。
声明
- 关于奥加伊妥珠单抗更多详细信息请参见完整版药品说明书。
- 辉瑞公司无法针对个体患者不良事件的诊断和处理提出任何临床建议,应当由临床医生根据患者的具体请况作出合理判断和采取相应措施。
接受奥加伊妥珠单抗治疗的患者中,最常见的(≥20%)不良反应为血小板减少、中性粒细胞减少、感染、贫血、白细胞减少、疲乏、出血、发热、恶心、头痛、中性粒细胞减少伴发热、转氨酶升高、腹痛、γ-谷氨酰转移酶升高和高胆红素血症。接受奥加伊妥珠单抗治疗的患者中,最常见的(≥2%)严重不良反应为感染、中性粒细胞减少伴发热、出血、腹痛、发热、VOD和疲乏。1
接受奥加伊妥珠单抗治疗的患者中,报告为永久停药原因的最常见(≥2%)不良反应为感染(6%)、血小板减少(2%)、高胆红素血症(2%)、转氨酶升高(2%)和出血(2%);1
报告为中断给药原因的最常见(≥5%)不良反应为中性粒细胞减少(17%)、感染(10%)、血小板减少(10%)、转氨酶升高(6%)和中性粒细胞减少伴发热(5%);1
报告为剂量减少原因的最常见(≥1%)不良反应为中性粒细胞减少(1%)、血小板减少(1%)和转氨酶升高(1%)。1
警示语
肝脏毒性,包括肝小静脉闭塞病(VOD)(也称为肝窦阻塞综合征)和造血干细胞移植(HSCT)后非复发性死亡的风险增加。1
肝脏毒性,包括VOD1
- 接受本品治疗的复发性或难治性急性淋巴细胞性白血病(ALL)患者可出现肝脏毒性,包括致命性或危及生命的VOD。本品治疗后接受HSCT的患者发生VOD的风险更高;使用含2种烷化剂的HSCT预处理方案以及HSCT前末次总胆红素水平≥正常值上限(ULN)与VOD风险增加显著相关。
- 接受本品治疗的患者,发生VOD的其他风险因素包括持续性或既往肝病史、既往接受过HSCT、年龄增加、接受过多线挽救治疗或者多个本品治疗周期。
- 如果肝功能检查结果升高,可能需要中断给药、减少剂量或者永久停用本品。如发生VOD,应永久停止治疗。如发生重度VOD,则应根据标准医学规范进行治疗。
HSCT 后非复发性死亡风险增加1
- 接受本品治疗的患者人群,HSCT后非复发性死亡率更高,导致HSCT后第100天死亡率更高。
不良事件公共术语标准(CTCAE)v3.0是一项描述性术语,能被用于不良事件报告。
CTCAE v3.0针对每一项不良事件进行描述,其级别(1-5级)分别对应不良事件的严重程度。

| 不良事件 | 骨髓抑制/血细胞减少 |
|---|---|
| 一级 | 轻微的细胞减少或正常细胞减少≤25% |
| 二级 | 中度的细胞减少或正常细胞减少>25%-≤50% |
| 三级 | 重度的细胞减少或正常细胞减少>50%-≤75% |
| 四级 | — |
| 五级 | 死亡 |
| 不良事件 | 出血事件 |
|---|---|
| 一级 | 轻微,无微创治疗的指征 |
| 二级 | 微创或需要血块清除治疗 |
| 三级 | 有输血/介入治疗或手术指征 |
| 四级 | 有生命危险;有需要危重紧急治疗的指征 |
| 五级 | 死亡 |
| 不良事件 | 感染 |
|---|---|
| 一级 | — |
| 二级 | 局部感染,有需要局部治疗的指征 |
| 三级 | 有需静脉给予抗生素/抗真菌/抗病毒治疗指征;有介入放射或手术治疗指征 |
| 四级 | 有生命危险(如败血症休克、低血压、酸血症、坏疽) |
| 五级 | 死亡 |
| 不良事件 | 肝毒性 |
|---|---|
| 一级 | - |
| 二级 | 黄疸 |
| 三级 | 扑翼样震颤 |
| 四级 | 肝性脑病或肝昏迷 |
| 五级 | 死亡 |
概况1
发生率
| 所有级别 | |
|---|---|
| 输注相关反应 | 2% |
特点
在INO-VATE ALL试验中观察到接受奥加伊妥珠单抗的患者出现输液相关反应。有4/164(2%)名患者报告了输液相关反应(均为2级)
处理策略1
- 输液相关反应一般发生在第1 周期奥加伊妥珠单抗输液结束后不久,可自行消退或通过医学处理解决。
- 在给药前,建议使用皮质类固醇、解热药和抗组胺药预先处理。
- 在输液期间和输液结束后至少1小时内,密切监测患者,以防发生可能的输液相关反应,包括例如发热、寒战、皮疹或呼吸问题等症状。
- 如果发生输液相关反应,应中断输液,并给予适当的医学处理。根据输液相关反应的严重程度,考虑停止输液或者给予类固醇和抗组胺药物。对于严重或危及生命的输液反应,永久停用奥加伊妥珠单抗。
概况1
发生率
分别有83/164(51%)和81/164(49%)名患者报告了血小板减少和中性粒细胞减少。分别有23/164(14%)和33/164(20%)名患者报告了3 级血小板减少和中性粒细胞减少。分别有46/164(28%)和45/164(27%)名患者报告了4 级血小板减少和中性粒细胞减少。有43/164(26%)名患者报告了中性粒细胞减少伴发热(可能危及生命)。对于在治疗结束时达到CR 或CRi 的患者,奥加伊妥珠单抗组和研究者所选化疗方案组分别有15/164(9%)名患者和3/162(2%)名患者在末次给药后45天后血小板计数恢复到>50×109/L 。
特点
接受奥加伊妥珠单抗的患者中观察到与骨髓抑制相关的并发症(包括感染和流血/出血事件)。有79/164(48%)名患者报告了感染(包括严重感染,其中有些可能危及生命或致命)。有8/164(5%)名患者报告了致命感染,包括肺炎、败血症伴中性粒细胞减少、败血症、败血性休克和假单胞菌败血症。有报告细菌、病毒和真菌感染。54/164(33%)名患者报告了出血事件。8/164(5%)名患者报告了3或4级出血事件。1/164(1%)名患者报告了5级(致命)出血事件(腹腔内出血)。最常见的出血事件为鼻衄,共有24/164(15%)名患者报告。
处理策略1
在每次奥加伊妥珠单抗给药前,监测全血细胞计数以及奥加伊妥珠单抗治疗期间感染、出血或其他骨髓抑制导致的体征和症状。根据情况使用预防性抗感染药,并且在奥加伊妥珠单抗治疗期间和之后进行监测。在处理重度感染、流血/出血或其他骨髓抑制症状(包括重度中性粒细胞减少或血小板减少)时,可能需要中断给药、减少剂量或永久停用奥加伊妥珠单抗。
概况1
- 54/164(33%)的患者发生出血性事件。
- 8/164例(5%)患者出现3级或4级出血事件。
- 1/164(1%)的患者中,有1例5级(致命)出血事件(腹腔内出血)。
- 24/164(15%)的患者出现最常见的出血事件为鼻出血。
处理策略1
- 每次注射奥加伊妥珠单抗前,应监测全血计数,治疗期间应监测流血/出血的体征和症状。
- 对于出血情况的处理,可能需要中断、减少剂量或停止使用奥加伊妥珠单抗。
概况5
在接受奥加伊妥珠单抗治疗的患者中观察到与骨髓抑制相关的并发症(包括感染和出血/出血性事件)。
- 有79/164(48%)名患者发生感染,包括严重感染,其中一些是危及生命或致命的。
- 8/164(5%)例患者发生死亡感染,包括肺炎、中性粒细胞减少性脓毒症、脓毒症、脓毒症休克和假性脓毒症。
- 也有患者发生细菌、病毒和真菌感染。
处理策略5
- 在每次注射奥加伊妥珠单抗之前,应监测全血计数,在治疗期间应监测感染的体征和症状。
- 在治疗期间和治疗后,应酌情使用预防性抗感染药物,并进行监测检测。
- 对于严重感染的患者可能需要中断给药、减少剂量或停止治疗。
概况1
在INO-VATE ALL试验中,在治疗期间或之后,或者在完成治疗接受一次HSCT之后,奥加伊妥珠单抗组有23/164名患者(14%)观察到了肝脏毒性,包括严重、危及生命,和某些情况下致命的VOD。在治疗或没有接受HSCT干预的随访期间,末次给药后长达56天时仍有VOD报告。从后续HSCT至VOD发病的中位时间为15天(范围:3– 57天)。在奥加伊妥珠单抗组,接受后续HSCT的79名患者中,有18/79名患者(23%) 报告了VOD;在接受治疗的全部164名患者中,有5/164名患者(3%) 在研究治疗期间或者没有接受HSCT干预的随访期间报告了VOD。
在奥加伊妥珠单抗治疗后接受了HSCT的患者发生VOD的风险更高;使用含2种烷化剂(例如白消安与其他烷化剂联合使用)的HSCT预处理方案以及在HSCT前末次总胆红素水平≥ULN,与VOD风险增加显著相关。对于接受奥加伊妥珠单抗治疗的患者,发生VOD的其他风险因素包括持续性或既往肝脏疾病、既往HSCT、年龄增加、接受过多线挽救治疗或者多个奥加伊妥珠单抗治疗周期。既往出现过VOD或目前患有严重的肝病(例如肝硬化、结节状再生性增生、活动性肝炎)的患者接受奥加伊妥珠单抗治疗后,肝病恶化的风险增加,包括出现VOD。
INO-VATE ALL试验中肝脏功能检查结果异常的报告增加。分别有7/160(4%)、7/161(4%)和8/161(5%)名患者的肝脏功能检查结果出现3/4级AST、ALT和总胆红素异常。
处理策略1,5-9
- 在所有诊断为造血干细胞移植后伴或不伴多器官衰竭的重度VOD患者中,建议尽快进行去纤苷治疗以降低死亡率。
- 对于造血干细胞移植后诊断为重度VOD伴或不伴多器官衰竭的所有患者,建议使用25mg/kg/d去纤苷治疗至少21天,直至重度VOD的体征和症状消失,以降低VOD相关的死亡率。
- 对于造血干细胞移植后诊断为重度VOD并接受去纤苷治疗的多器官衰竭患者,需要密切监测出血风险,以便能够及时治疗出血并发症。
- 所有造血干细胞移植后伴或不伴多器官功能衰竭的重度VOD患者,必须避免同时使用有可能增加出血风险的药物(如抗血小板治疗、预防或治疗剂量的抗凝治疗等)。
- 对于造血干细胞移植后发生VOD的所有患者,建议限制体液,给予利尿剂治疗,以达到体液平衡或体液负平衡,以降低进展为重度VOD、多器官衰竭的风险,降低VOD相关死亡率。
- 认可支持治疗对减轻症状(如疼痛、呼吸困难、液体潴留、心理应激)的重要性。
注:去纤苷在中国尚未获批上市
概况1
发生率
| 所有级别 | |
|---|---|
| QT 间隔延长 | 3% |
- 在INO-VATE ALL试验中,4/162(3%)名患者出现按心率校正的QT间期(QTcF)延长。使用相对基线≥60 msec的Fridericia公式进行QT间期校正。
- 没有患者的QTcF值>500msec。
- 2/164(1%)名患者报告了2级QT延长。
- 没有报告任何≥ 3级的QT延长或尖端扭转性室性心动过速事件。
处理策略1
- 对于有QTc延长病史或延长倾向的患者,正在使用已知可导致QT间期延长的药物的患者,以及电解质紊乱的患者,应谨慎使用奥加伊妥珠单抗。
- 在开始治疗前、开始使用已知可延长QTc的任何药物之后,应获得心电图(ECG)和电解质检测结果,并且在治疗期间根据临床指征定期监测。
概况1
在INO-VATE ALL试验中,与研究者所选化疗方案组相比,接受奥加伊妥珠单抗治疗的患者HSCT后非复发性死亡率更高,使得HSCT后100天的死亡率更高。
总体上,奥加伊妥珠单抗组和研究者所选化疗方案组分别有79/164(48%)名患者和35/162(22%)名患者接受了后续HSCT。奥加伊妥珠单抗组和研究者所选化疗方案组的HSCT后非复发性死亡率分别为31/79(39%)和8/35(23%)。
在奥加伊妥珠单抗组,HSCT后非复发性死亡的最常见原因包括VOD和感染。在这18例HSCT后VOD事件中,5例是致命的。奥加伊妥珠单抗组中,死亡时仍患有VOD的患者中,6名患者死于多器官衰竭(MOF)或感染(3名患者死于MOF,2名患者死于感染,1名患者死于MOF和感染)。
处理策略1
应密切监测HSCT后毒性,包括感染和VOD的体征和症状。
概况1
- 基于其作用机制和动物研究结果,向孕妇给予奥加伊妥珠单抗可能会引起胚胎-胎儿损害。
- 在动物研究中,奥加伊妥珠单抗产生胚胎-胎仔毒性的起始剂量的暴露量约是按照最大推荐剂量用药的患者暴露量的0.4倍(基于浓度时间曲线下面积(AUC))。
处理策略1
- 应告知有怀孕可能的女性在奥加伊妥珠单抗治疗期间以及末次给药后至少8个月内应采取有效的避孕措施。
- 告知伴侣有怀孕可能的男性在奥加伊妥珠单抗治疗期间以及末次给药后至少5个月内应采取有效的避孕措施。应将对胎儿的潜在风险告知孕妇。如果女性在奥加伊妥珠单抗治疗期间妊娠或疑似妊娠,建议联系其专业医护人员。
概况1
发生率
| 所有级别 | |
|---|---|
| TLS | 2% |
处理策略1
对于高肿瘤负荷的患者,建议在给药前预处理以降低尿酸水平和水合作用。应监测患者TLS的体征和症状,并根据标准医疗实践进行治疗。
辉瑞医学信息网站指南版块查阅下载 下载链接
如需指南共识原文,请您联系辉瑞医学信息部:[email protected], 或通过辉瑞医学信息网站在线提问获取。
请注意:我们不建议超出国家药品监督管理局批准的药品说明书的应用或未在中国(不含港澳台)上市药品的应用。如我们所提供的文献信息及指南共识涉及该等内容,系出于传递科学知识的需要,不应视为对未在中国(不含港澳台)上市药品或已在中国上市但超出国家药品监督管理局批准的药品说明书的药品适应症/用法的推广。
国内
- 2025年6月20-22日 西安
中国血液病大会暨第十九届中国医师协会血液科医师年会 - 2025年9月11-14日 北京
中华医学会第十九次全国血液学学术会议(CSH)
国外
- 2025年3月30-4月2日 意大利 佛罗伦萨
2025年第51届欧洲血液与骨髓移植学会(EBMT)年会 - 2025年5月30日-6月3日 美国 芝加哥
2025年美国肿瘤学会(ASCO)年会 - 2025年6月12-15日 意大利 米兰
2025年第30届欧洲血液学协会年会(EHA) - 2025年12月6-9日 美国 佛罗里达
2025年第67届美国血液学会年会(ASH) - 2026年3月22-25日 西班牙 马德里
2026年第52届欧洲血液与骨髓移植学会(EBMT)年会 - 2026年5月29日-6月2日 美国 芝加哥
2026年美国肿瘤学会(ASCO)年会 - 2026年6月11-14日 瑞典 斯德哥尔摩
2026年第31届欧洲血液学协会年会(EHA)
- clinicaltrials.gov:
https://clinicaltrials.gov/ - WHO ICTRP:
https://trialsearch.who.int/ - 中国临床试验注册中心:
https://www.chictr.org.cn/ - 药物临床试验登记与信息公示平台:
http://www.chinadrugtrials.org.cn/index.html
2.Adapted from Hagop M, Kantarjian, Yun Su, et al. Patient-Reported Outcomes From a Global Phase 3 Randomized Controlled Trial of Inotuzumab Ozogamicin Versus Standard of Care Chemotherapy for Relapsed/Refractory Acute Lymphoblastic Leukemia. Poster presented at ASH 2016.
3.George B, Kantarjian H, Jabbour E, et al. Role of inotuzumab ozogamicin in the treatment of relapsed/refractory acute lymphoblastic leukemia. Immunotherapy. 2016 Feb;8(2):135-43.
4.Kantarjian HM, DeAngelo DJ, Stelljes M, et al. Inotuzumab ozogamicin versus standard of care in relapsed or refractory acute lymphoblastic leukemia: Final report and long-term survival follow-up from the randomized, phase 3 INO-VATE study. Cancer. 2019 Jul 15;125(14):2474-2487.
5.Bonifazi F, Sica S, Angeletti A, et al. Veno-occlusive Disease in HSCT Patients: Consensus-based Recommendations for Risk Assessment, Diagnosis, and Management by the GITMO Group. Transplantation. 2021 Apr 1;105(4):686-694.
6.Cairo MS, Cooke KR, Lazarus HM, et al. Modified diagnostic criteria, grading classification and newly elucidated pathophysiology of hepatic SOS/VOD after haematopoietic cell transplantation. Br J Haematol. 2020 Sep;190(6):822-836.
7.Bonifazi F, Barbato F, Ravaioli F, et al. Diagnosis and Treatment of VOD/SOS After Allogeneic Hematopoietic Stem Cell Transplantation. Front Immunol. 2020 Apr 3;11:489.
8.Mohty M, Malard F, Abecassis M, et al. Revised diagnosis and severity criteria for sinusoidal obstruction syndrome/veno-occlusive disease in adult patients: a new classification from the European Society for Blood and Marrow Transplantation. Bone Marrow Transplant. 2016 Jul;51(7):906-12.
9.Risk Score for the Development of Veno-Occlusive Disease after Allogeneic Hematopoietic Cell Transplant.Biol Blood Marrow Transplant. 2018 Oct;24(10):2072-2080. doi: 10.1016/j.bbmt.2018.06.013.



