非小细胞肺癌:
1、联合治疗
本品联合培美曲塞和卡铂用于表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性的转移性非鳞状非小细胞肺癌(NSCLC)患者的一线治疗。
本品联合紫杉醇和卡铂用于转移性鳞状非小细胞肺癌(NSCLC)患者的一线治疗。
2、单药治疗
本品用于在接受铂类药物为基础的同步或序贯放化疗后未出现疾病进展的、不可切除、III 期非小细胞肺癌(NSCLC)患者的治疗。
结外NK/T 细胞淋巴瘤:
本品单药用于治疗复发或难治性结外NK/T细胞淋巴瘤(R/R ENKTL)成人患者。
基于一项单臂临床试验的客观缓解率和缓解持续时间结果附条件批准本适应症,暂未获得确证性研究的临床终点数据,尚待上市后进一步确证。
食管鳞癌:
本品联合氟尿嘧啶类和铂类化疗药物用于不可切除的局部晚期、复发或转移性食管鳞状细胞癌(ESCC)的一线治疗。
胃及胃食管结合部腺癌:
本品联合含氟尿嘧啶类和铂类药物化疗用于表达PD-L1(综合阳性评分[CPS]≥5)的不可手术切除的局部晚期或转移性胃及胃食管结合部腺癌的一线治疗。
- 程序性死亡配体-1(PD-L1)可表达在肿瘤细胞和肿瘤浸润性免疫细胞上。当PD-L1与T细胞及抗原递呈细胞上的PD-1和B7.1受体结合时,可抑制细胞毒性T 细胞活性、T细胞增殖和细胞因子释放, 从而在肿瘤微环境中抑制抗肿瘤免疫应答。1
- 舒格利单抗是一种可直接结合PD-L1的人免疫球蛋白G4(IgG4)单克隆抗体,可抑制PD-L1与程序性细胞死亡因子-1(PD-1)及白细胞分化抗原CD80(B7.1)的结合。舒格利单抗未明显诱导抗体依赖性细胞介导细胞毒性(ADCC)及补体依赖性细胞毒性(CDC),在体外实验中可诱导抗体依赖性细胞介导的吞噬作用(ADCP),以直接杀伤肿瘤。在同源小鼠肿瘤模型中,阻断PD-L1活性可减慢肿瘤生长。1
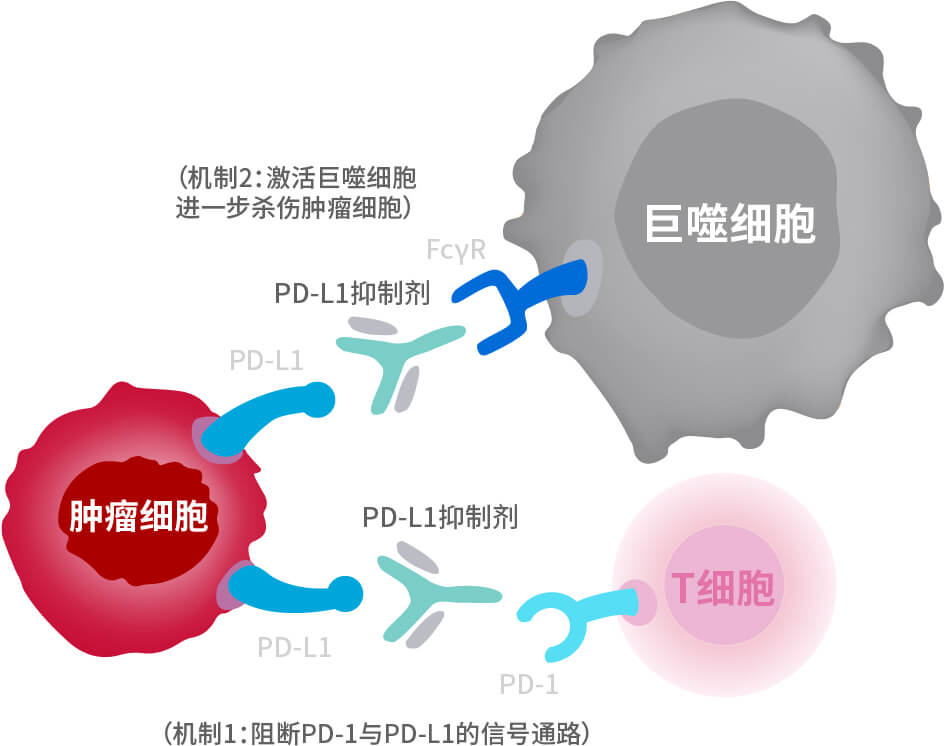
舒格利单抗双重抗肿瘤机制:
- 机制1:阻断PD-1/PD-L1信号通路,激活特异性免疫,介导T细胞抗肿瘤活性2
- 机制2:保留抗体与巨噬细胞表面FcγR结合的功能,活化固有免疫,进一步介导巨噬细胞吞噬肿瘤细胞(即ADCP作用)3
PD-1:程序性死亡受体1; PD-L1:程序性死亡配体1;
PFS:无进展生存期; ADCP:抗体依赖的细胞介导的吞噬作用
受体占有率生物分析1
- 受体占有率(RO)分析旨在定量舒格利单抗与细胞表面PD-L1的结合率。在1001-102研究中,在给药前(第1天)、第2周期给药前(第21天)和第4周期给药前(第63天)采集肝素钠抗凝全血样本。
- 使用外周全血样本中的CD3+T细胞作为替代物,通过流式细胞仪检测新鲜血样中舒格利单抗的RO水平。采集3例患者(10mg/kg组)和4例患者(1200mg组)的血样进行RO分析。在C2D1给药前时间点,7例可评价患者的CD3+T细胞显示100% RO。值得注意的是,与1200mg剂量组相比,3例较低剂量组(10mg/kg)患者的RO已显示饱和。在C4D1给药前时间点,3例患者的RO保持在较高水平(76%-100%)。
在29例中国晚期实体瘤患者进行的每3周1次给药舒格利单抗进行了不同剂量单次和多次给药研究。研究结果显示,舒格利单抗的暴露量(AUC和Cmax)在3mg/kg至40mg/kg的剂量范围内(包括1200mg固定剂量)接近剂量线性相关性增加。每3周1次给药,在4次给药后,药物基本达到稳态浓度。1
与所有治疗用蛋白质一样,舒格利单抗亦有发生免疫原性的可能。III期NSCLC研究(综合项目CS1001-301: 舒格利单抗作为巩固治疗用于同步或序贯放化疗后未发生疾病进展的、不可切除的III期非小细胞肺癌患者的随机双盲研究以及项目CS1001-302: 舒格利单抗联合含铂化疗用于一线晚期非小细胞肺癌患者的随机双盲研究),可评价免疫原性样品共2771个(患者564例)。研究中与舒格利单抗相关的抗药物抗体(ADA)阳性患者42例(7.4%),药物不相关阳性患者37例(6.6%)。对所有ADA阳性样本进行中和抗体(NAb)检测,产生中和型抗药抗体患者共9例(1.6%)。II期R/R ENKTL研究共收集免疫原性样品480个(患者80例)。与舒格利单抗相关的抗药物抗体(ADA)阳性患者3例(3.8%),药物不相关ADA阳性患者2例(2.5%)。对所有ADA阳性样本进行中和抗体(NAb)检测,NAb阳性患者占总体患者比率为1例(1.3%)。基于现有数据,ADA未显示出对本品药代动力学特性造成显著影响,亦未显示出对安全性和有效性的影响。
本品在2~8℃避光保存与运输,不得冷冻。1
- 30个月。1
舒格利单抗的药品上市许可持有人为辉瑞投资有限公司。
- 本品须在有肿瘤治疗经验的医生指导下用药。1
- 用于治疗胃及胃食管结合部腺癌时的患者选择:
- 对于一线不可手术切除的局部晚期或转移性胃或胃食管结合部腺癌,应根据其PD-L1阳性表达状态,选择舒格利单抗联合化疗,PD-L1表达需经充分验证的检测评估。
- 表达PD-L1(综合阳性评分[CPS] ≥5)定义为:有任何强度PD-L1膜染色的肿瘤细胞和有任何强度PD-L1染色的肿瘤相关免疫细胞占所有肿瘤细胞的百分比×100 ≥5。
推荐剂量1
- 本品推荐剂量为1200mg/次,静脉输注每3周给药1次,每次输注时间为60分钟或以上,直至出现疾病进展或产生不可耐受的毒性。如用于巩固治疗,本品治疗最长不超过24个月。舒格利单抗联合化疗给药时,应首先给予舒格利单抗。根据个体患者的安全性和耐受性,可能需要暂停给药或永久停药。不建议增加或减少剂量。
给药方法1
- 本品应该由专业卫生人员采用无菌技术稀释后才可输注,本品须采用静脉输注的方式给药,输注应在60分钟或以上完成。
使用、处理、处置的特殊说明1
- 禁止静脉内推注或快速注射(Bolus)。
- 药物配置前确保药物溶液是澄清、透明、无肉眼可见微粒。
- 以注射器抽取舒格利单抗注射液,注射液体积一共40 mL(20mL/瓶:2瓶)。注入至250mL生理盐水(0.9%氯化钠溶液)静脉输液袋中。
- 混合时轻轻颠倒混匀,禁止震摇。
- 输注时间应不低于60分钟,若出现1-2级输液反应,可暂停输液或适当延长输液时间,出现3级及以上输液反应立即停止输液并予以对症处理。
- 请勿使用同一输液管与其他药物同时给药。
- 建议药物应在配制完成后立即给予患者,以避免配制好的药物暴露于室温超过推荐的6小时限制。其中,6 小时的时间限制包括药物室温贮存、静脉输液袋中输注液贮存和输注持续时间。如果需要推迟使用配制好的药物,则可将其置于2~8°C冰箱中,不超过24小时。
肝功能不全1
目前本品尚无针对中重度肝功能不全患者的研究数据,中度或重度肝功能不全患者不推荐使用。轻度肝功能不全患者无需进行剂量调整。
肾功能不全1
目前本品尚无针对重度肾功能不全患者的研究数据,重度肾功能不全患者不推荐使用。轻度或中度肾功能不全患者应在医生指导下慎用本品,基于群体药代动力学结果,如需使用,无需进行剂量调整
儿童人群1
本品尚无在18岁以下儿童及青少年中的安全性和有效性数据。
老年人群1
老年(≥65岁)与年轻患者(<65岁)在安全性或有效性上未出现总体的差异。无需在这一人群中进行剂量调整。
孕妇及哺乳期妇女用药1
妊娠期
尚无妊娠女性使用本品的安全性数据。根据文献数据,在啮齿类动物模型中,通过保持母体对胎仔的免疫耐受来维持妊娠是PD-1/PD-L1通路的主要功能之一,阻断PD-L1信号通路可破坏母体对于胎仔的耐受性,增加胎仔流产的风险。已知人源性IgG可通过胎盘屏障,而本品属于IgG4类型的一种重组抗PD-L1完全人源化单克隆抗体,因此可能会通过母体被转运到发育中的胎儿体内。基于目前对于其作用机制的理解,PD-1/PD-L1阻断性抗体具有潜在的胚胎胎儿毒性,妊娠期暴露本品不仅可能会增加自然流产及胎儿死亡的风险,并且也可能会增加胎儿发生免疫相关性疾病或者正常免疫应答被改变的风险。除非临床获益大于潜在风险,不建议在妊娠期间使用本品治疗。
哺乳期
目前尚不清楚本品是否会经人乳分泌,以及本品对母乳喂养的婴幼儿及母乳产量的影响。由于许多抗体可在人乳汁中分泌,人IgG也会分泌到母乳中,本品对母乳喂养的婴幼儿可能存在潜在的风险,故建议哺乳期妇女在接受本品治疗期间及末次给药后至少6个月内停止哺乳。
避孕
育龄女性在接受舒格利单抗治疗期间,以及最后一次舒格利单抗给药后至少6个月内应采取有效避孕措施。
生育力
尚无关于舒格利单抗对于生育力潜在影响的临床数据,本品对男性和女性生育力的影响尚不明确。
对下方所列的活性成份或任何辅料存在超敏反应的患者。1
活性成份1:
舒格利单抗(全人源抗程序性死亡配体-1 单克隆抗体)。
辅料1:
组氨酸、盐酸组氨酸、甘露醇、氯化钠、聚山梨酯80。
- 舒格利单抗是一种全人源单克隆抗体,由于单克隆抗体不通过细胞色素CYP450酶或其他药物代谢酶代谢,也不主要以转运体介导的方式摄取和外排,所以合并使用对常见代谢酶或转运体的抑制或诱导作用预期不会影响本品的药代动力学特征。1
- 因可能影响本品的药效学活性,应避免在开始本品治疗前使用全身性皮质类固醇及其他免疫抑制剂。如果为治疗免疫相关不良反应,可以在开始本品治疗后使用全身性皮质类固醇及其他免疫抑制剂。1
CS1001-302:
舒格利单抗联合含铂化疗用于一线晚期非小细胞肺癌患者的随机双盲研究1
- CS1001-302研究为一项多中心、随机对照、双盲的Ⅲ期注册临床研究,旨在评价舒格利单抗联合含铂化疗对比安慰剂联合含铂化疗,在未经系统性治疗的、IV期非小细胞肺癌患者中的有效性和安全性。该研究入组患者包含组织学检查证实为非鳞状非小细胞肺癌(EGFR敏感性突变阴性)或鳞状非小细胞肺癌的患者。符合入组标准的患者,按照2:1的比例随机分组,预设的随机的分层因素包括:PD-L1表达(PD- L1≥1% vs. PD-L1<1%)、ECOG评分(0 vs. 1)、肿瘤组织学(鳞状vs.非鳞状)。
- 研究结果表明,较安慰剂联合含铂化疗,舒格利单抗联合含铂化疗作为一线治疗延长了晚期NSCLC患者的无进展生存期(PFS),研究结果达到统计学显著性,且具有临床意义。亚组分析结果显示,研究者评估的PFS在各个亚组中的PFS获益趋势跟意向治疗人群中PFS获益基本一致,在组织分型亚组(鳞状,非鳞状)和PD-L1表达水平(<1%,≥1%)亚组中均显示临床获益,舒格利单抗联合含铂化疗相较于安慰剂联合含铂化疗降低患者疾病进展或死亡的风险,延长患者PFS。BICR评价的PFS结果与主要研究终点一致。其他次要终点数据也支持主要研究终点结果。总生存期显示出获益趋势。
- CS1001-302研究有效性结果总结在表1、图1和图2。
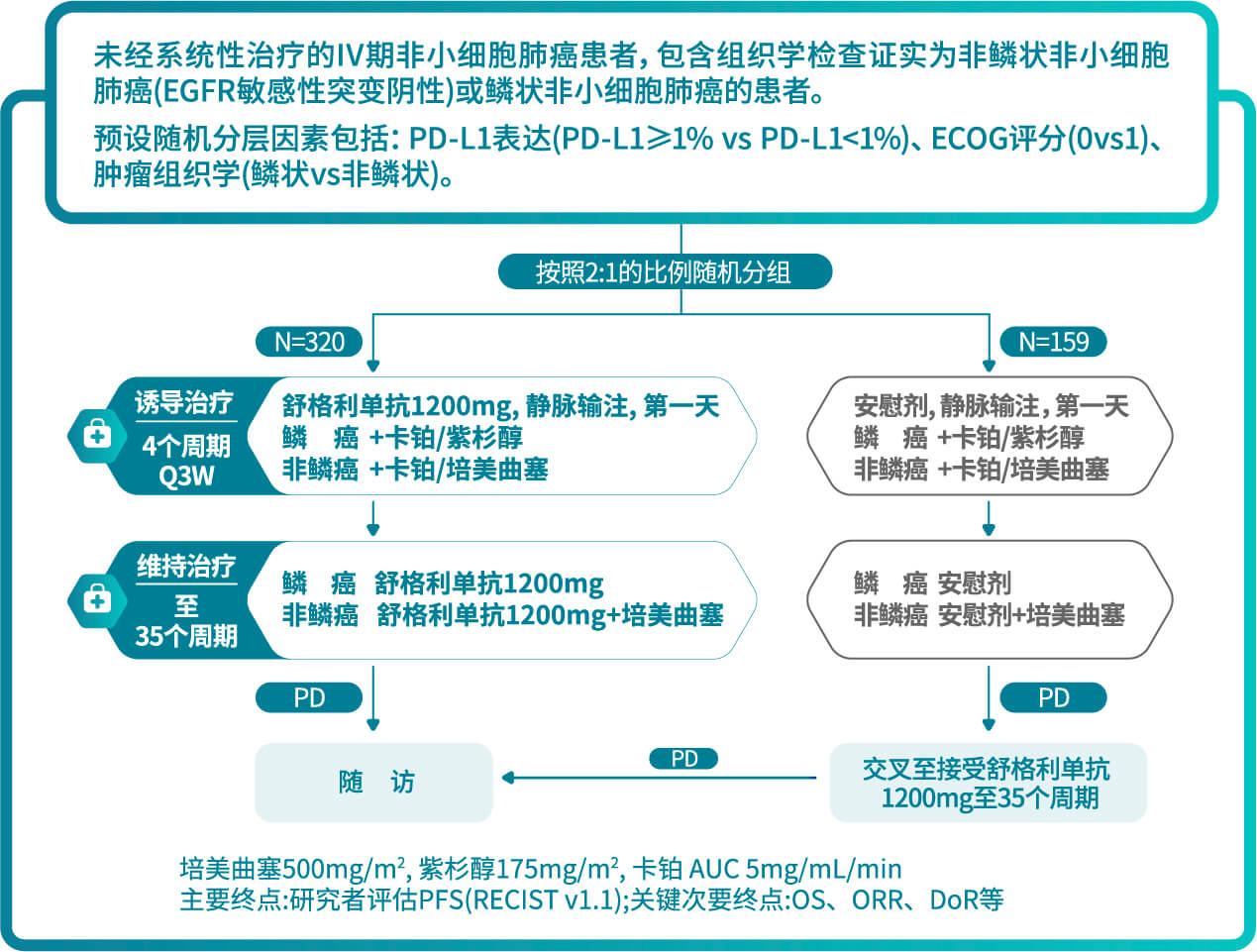
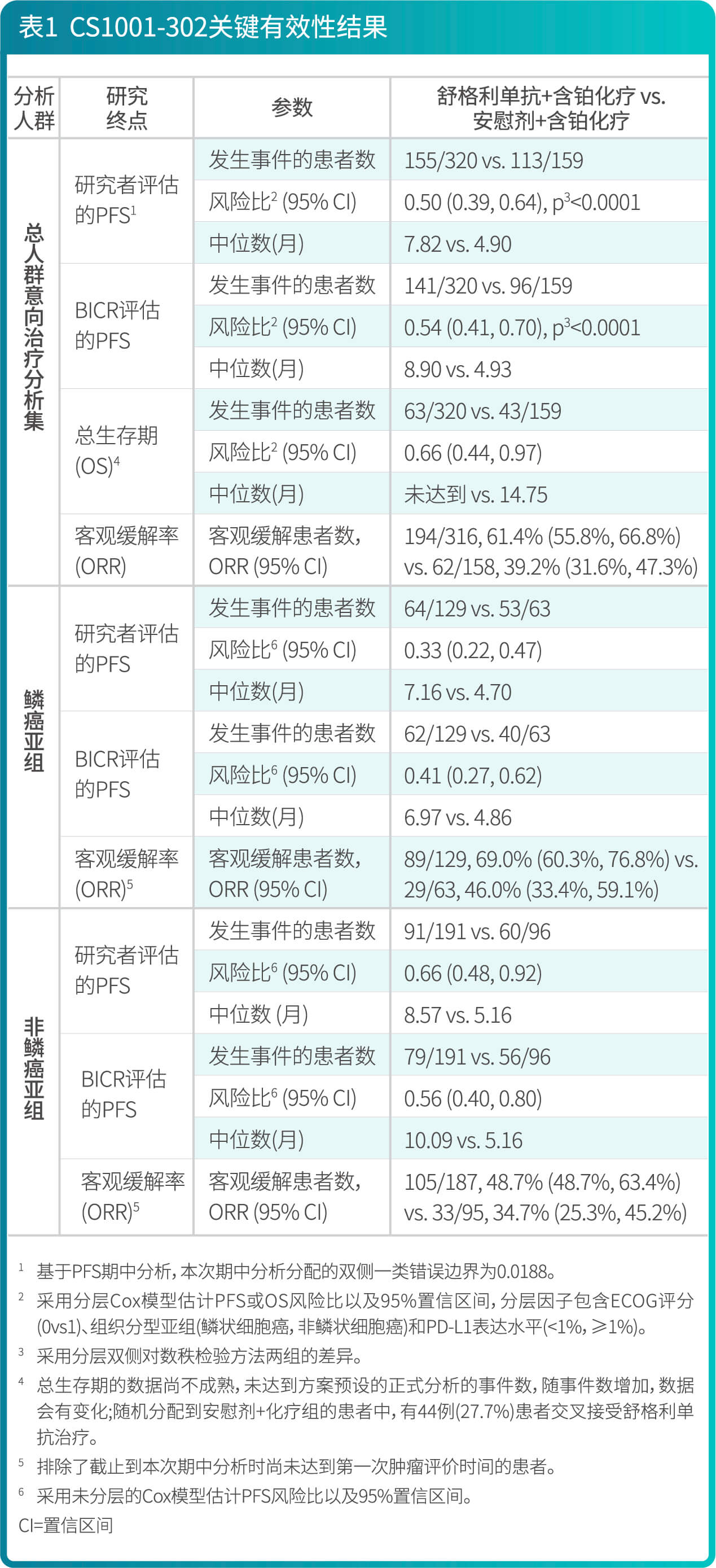
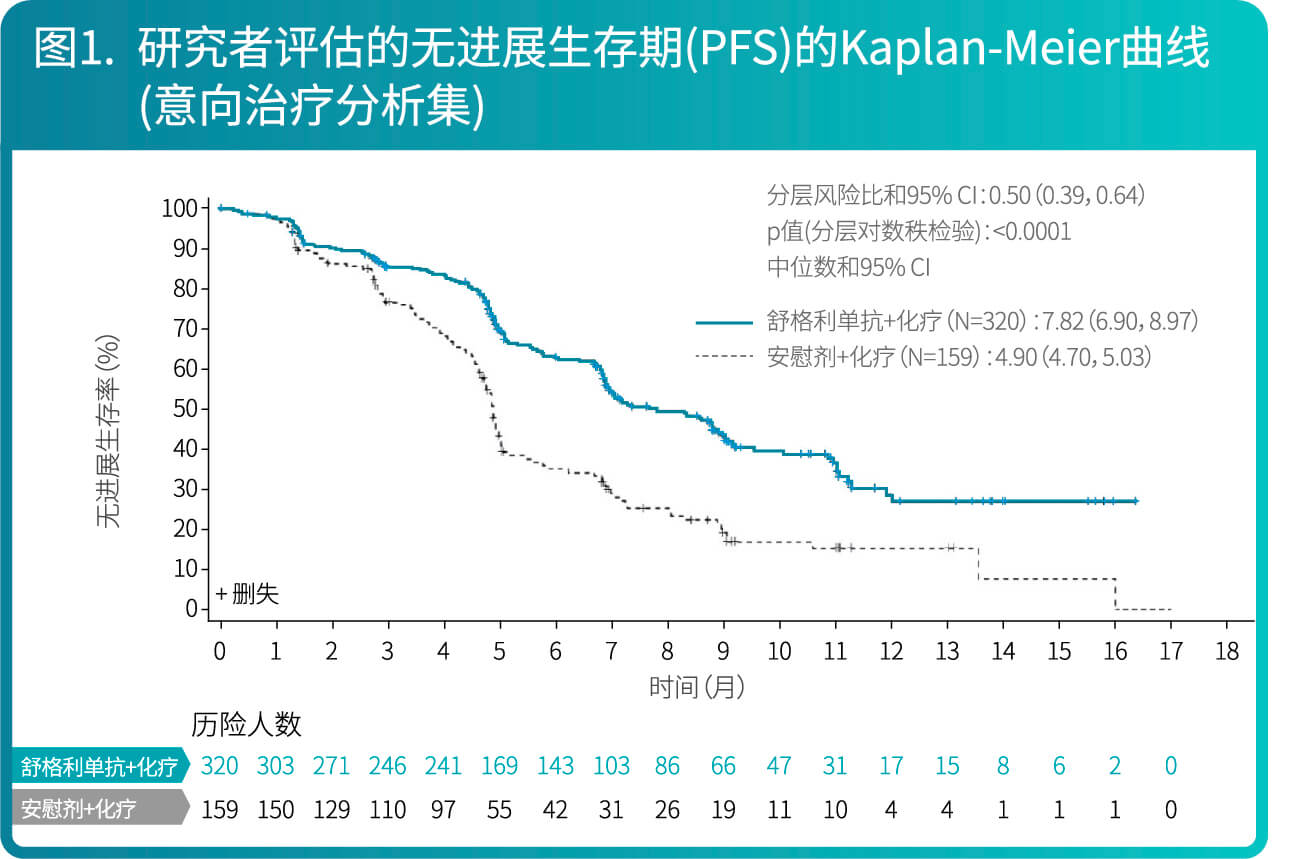
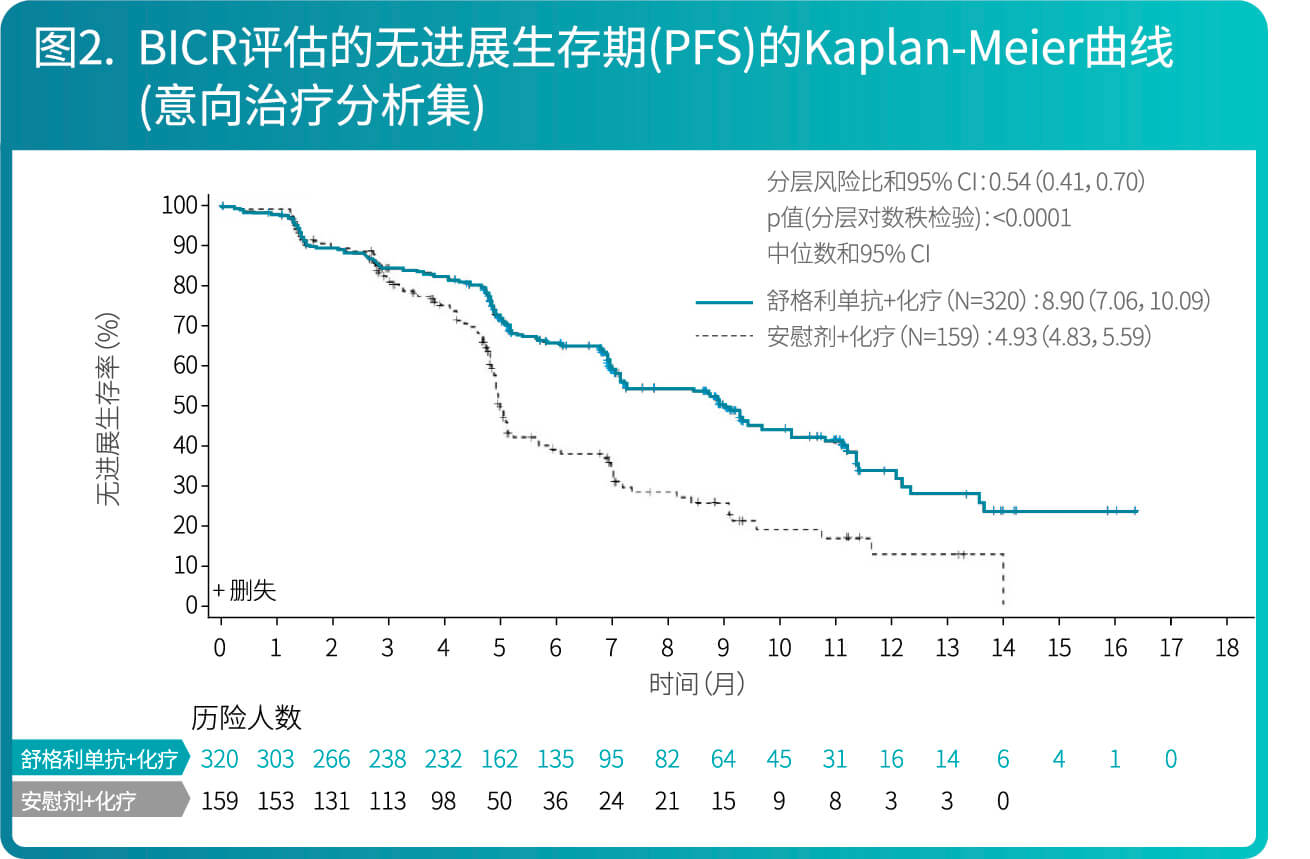
CS1001-301: 舒格利单抗作为巩固治疗用于同步或序贯放化疗后未发生疾病进展的、不可切除的III期非小细胞肺癌患者的随机双盲研究
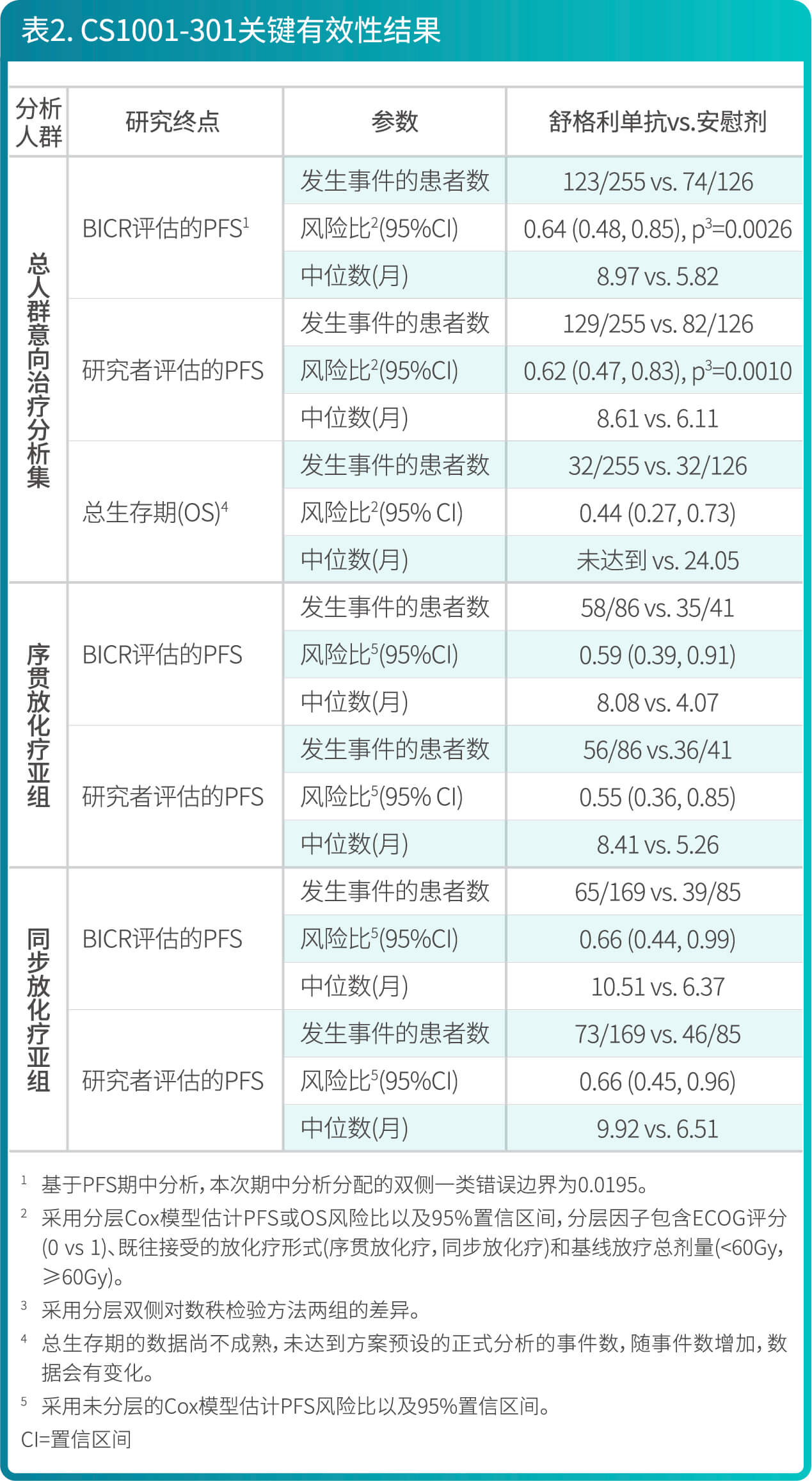
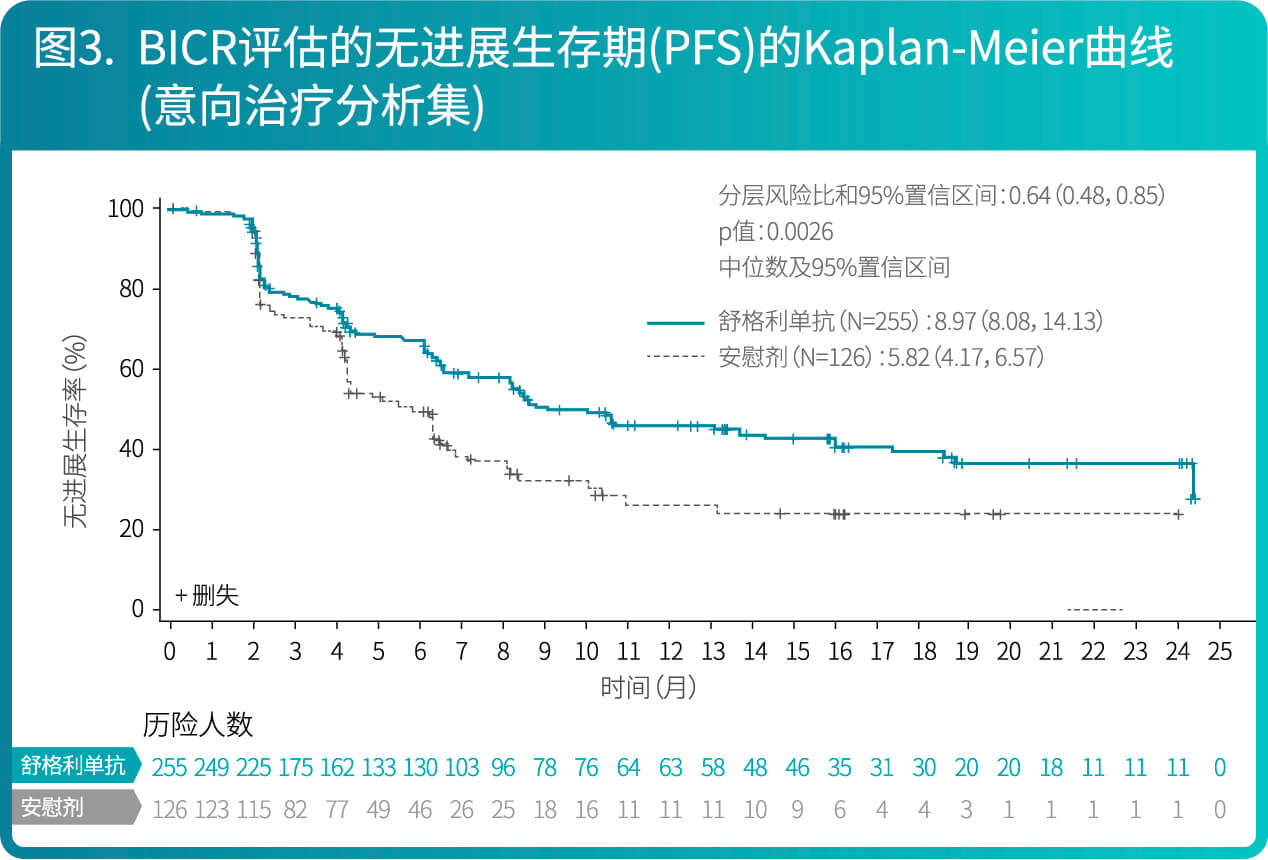
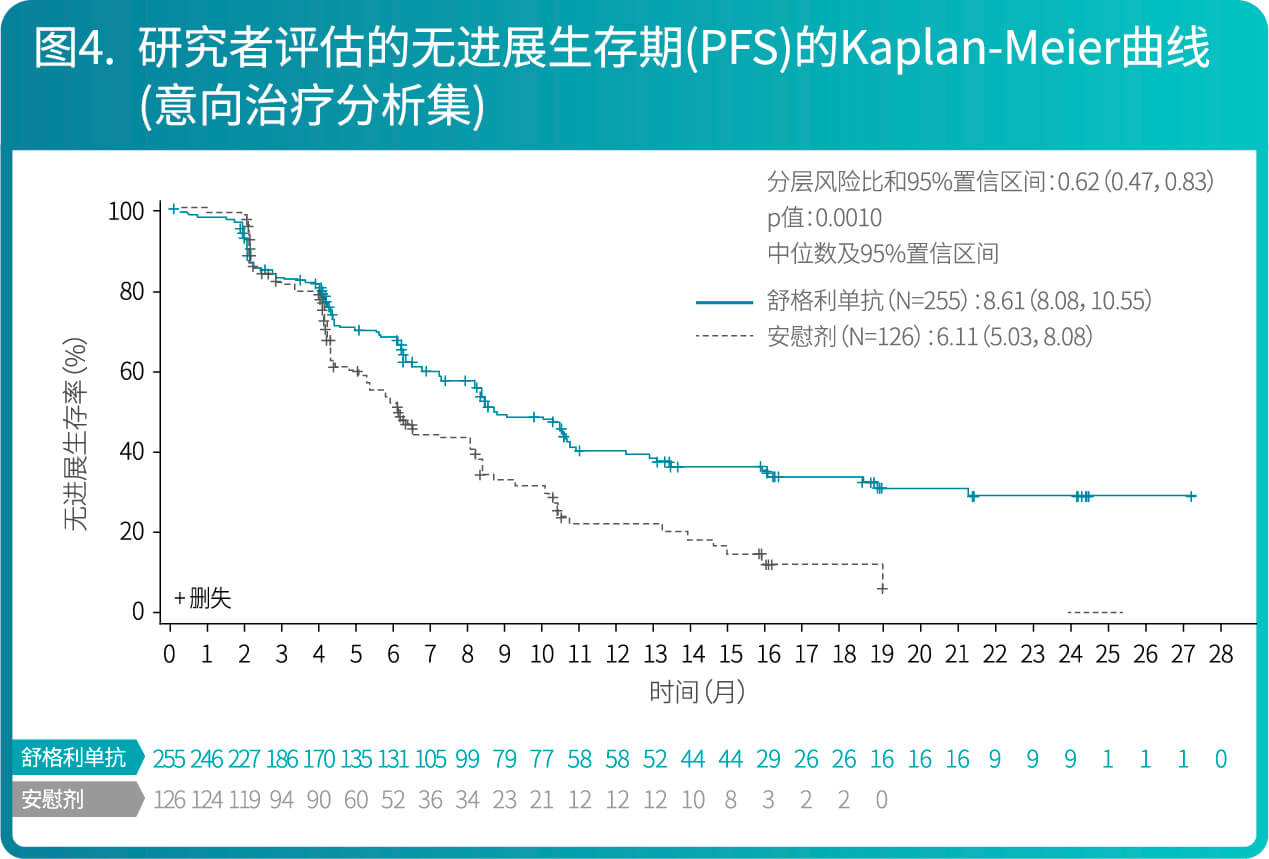
- CS1001-301研究是一项随机、双盲、安慰剂对照、多中心的III期研究,旨在评价舒格利单抗作为巩固疗法对比安慰剂在同步或序贯放化疗后未发生疾病进展的、不可切除的III期非小细胞肺癌患者中的有效性和安全性。符合入选标准的患者按照2:1的比例随机分配至舒格利单抗组(1200 mg [每三周一次])或安慰剂组(每三周一次)。随机化的分层因素包括: ECOG评分(0分 versus 1分)、放化疗(同步放化疗versus序贯放化疗)和放疗总剂量(60 Gy以下 versus 60 Gy 及以上)。
- 共381例患者随机分组,接受试验药物(舒格利单抗或安慰剂)的治疗,直至疾病进展或不能耐受等。最长治疗期为两年,但届时若患者仍有临床获益则可继续研究治疗。本研究的主要有效性终点是盲态独立中心审阅委员会(BICR)根据RECIST v1.1评估的无进展生存期(PFS)。次要终点包括研究者根据RECIST v1.1评估的PFS,总生存期(OS),客观缓解率(ORR)和缓解持续时间(DOR)等。
- 两组间的基线特征均衡。在381例患者中,IIIa期的患者占27.8%,IIIb期的患者占55.4%,IIIc期的患者占16.0%;92.1%为男性,27.6%年龄≥65岁(中位年龄为61岁[范围42-78]),69.0%为鳞状NSCLC患者,30.4%为非鳞状NSCLC患者,ECOG评分为0分的患者为30.4%, 1分的患者为69.6%。随机之前接受同步放化疗的患者66.7%,接受序贯放化疗的患者占33.3%。
- 研究结果表明,相较于安慰剂组,舒格利单抗作为放化疗后的巩固治疗,延长患者的无进展生存期(PFS),研究结果达到统计学显著性,且具有临床意义。亚组分析结果显示,BICR评估的PFS在各个亚组中的PFS获益趋势跟意向治疗人群中PFS获益基本一致,在随机前接受同步放化疗和接受序贯放化疗的患者中均显示临床获益。研究者评价的PFS结果与主要研究终点一致。其他次要终点数据也支持主要研究终点结果。总生存期显示出获益趋势。
- CS1001-301研究有效性结果总结在表2、图3和图4。
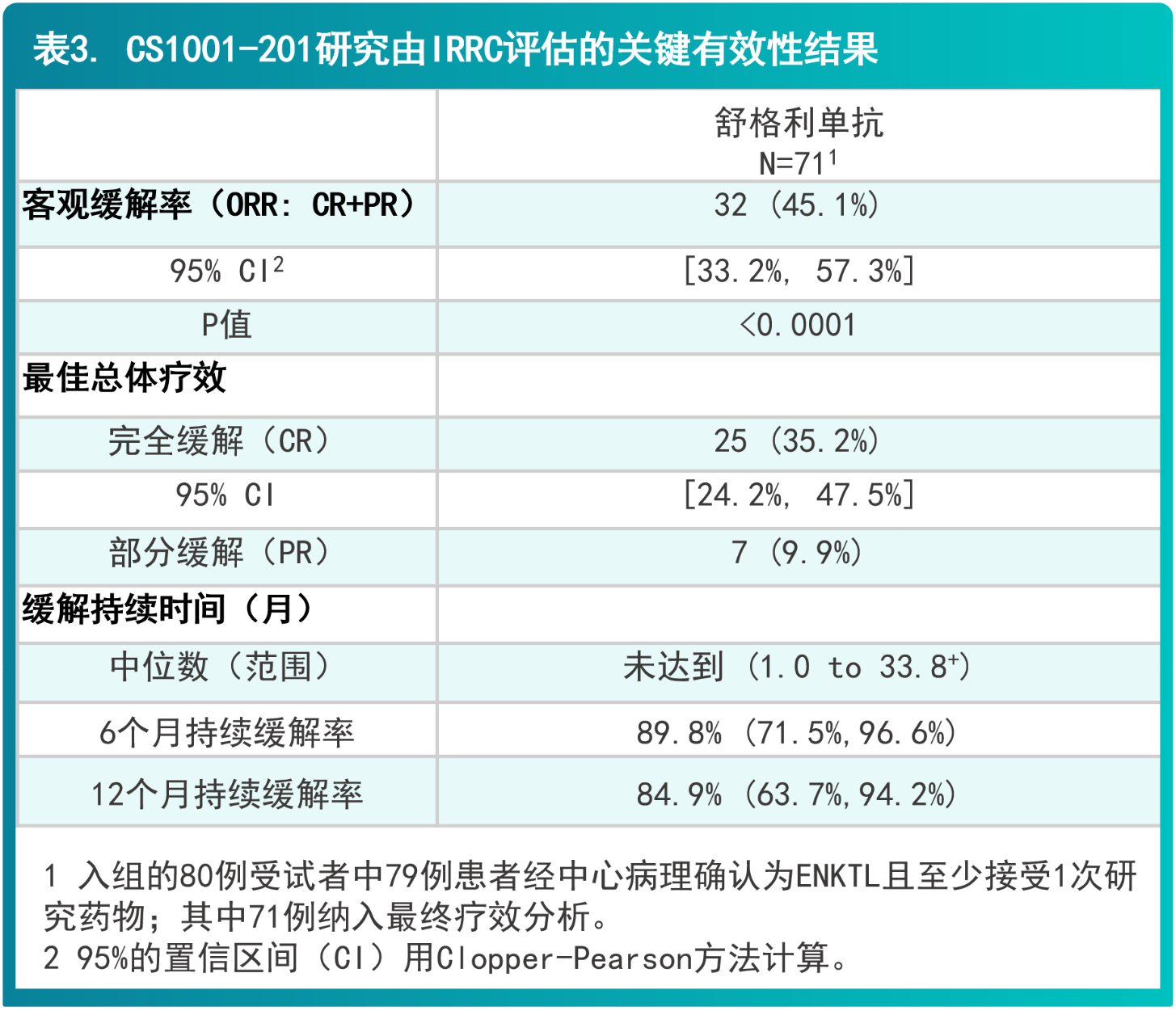
CS1001-201: 一项评价舒格利单抗单药治疗复发或难治性结外NK/T细胞淋巴瘤的单臂、多中心、II 期研究
- 本研究是一项在既往经过门冬酰胺酶为基础的化疗或放化疗方案治疗失败的R/R ENKTL患者中开展的单臂、多中心、II期研究,用以评价舒格利单抗单药治疗的安全性和有效性。入组经研究中心组织病理学确认的ENKTL,且为经过以门冬酰胺酶为基础的化疗或放化疗方案治疗失败的复发或难治性ENKTL,同时有至少1个符合Lugano 2014标准的可评价或可测量病灶【可评价病灶定义:18FDG/PET检查显示淋巴结或结外局部摄取增高(高于肝脏)且PET和/或CT特征符合淋巴瘤表现;可测量病灶定义:淋巴结病灶长径>15mm或结外病灶长径>10mm(如果唯一的可测量病灶既往接受过放疗,须有放疗后影像学进展证据),且伴有18FDG摄取增高】。
- 所有入组患者接受舒格利单抗1200 mg,静脉输注,每3周一次,直至疾病进展、不能耐受、撤回知情同意、死亡或方案规定的其它原因。研究的主要研究终点为独立影像评估委员会(IRRC)根据Lugano2014标准评估的客观缓解率(ORR),定义为最佳疗效为完全缓解(CR)和部分缓解(PR)的患者百分率。
- 本研究共入组80例患者,其中纳入疗效分析的患者共71例。男性患者的比例为63.8%,女性患者的比例为36.3%。患者的年龄中位值(范围)为48岁(29-74岁);≥65岁(老年)的患者数为14(17.5%)例。大部分患者基线ECOG评分为1(73.8%),超半数患者的疾病分期为IV期(67.5%)。基线骨髓累及占比为6.3%。所有患者均接受了既往至少一线的系统性治疗。经IRRC评估的基线有可测量或可评价病灶的患者中,具有可测量病灶的占比为59.0%,仅有可评价病灶的占比为41.0%。42(52.5%)患者在开始接受本次研究治疗前6个月内完成了其他治疗方案。80例患者的中位随访时间为13.4(范围:0.85+,37.16)个月。
- 研究结果表明,主要终点IRRC评估的ORR为45.1%(95% CI: 33.2%,57.3%),相较于历史对照,舒格利单抗显著改善R/R ENKTL人群的ORR。结果达到统计学显著性,且临床有意义,CR率为35.2%(95% CI: 24.2%, 47.5%)。对于达到客观缓解的患者,缓解持久(中位缓解持续时间未达到,范围:1.0至33.8+个月)。研究者评估的主要终点结果和IRRC一致。关键有效性结果总结在表3和图5。
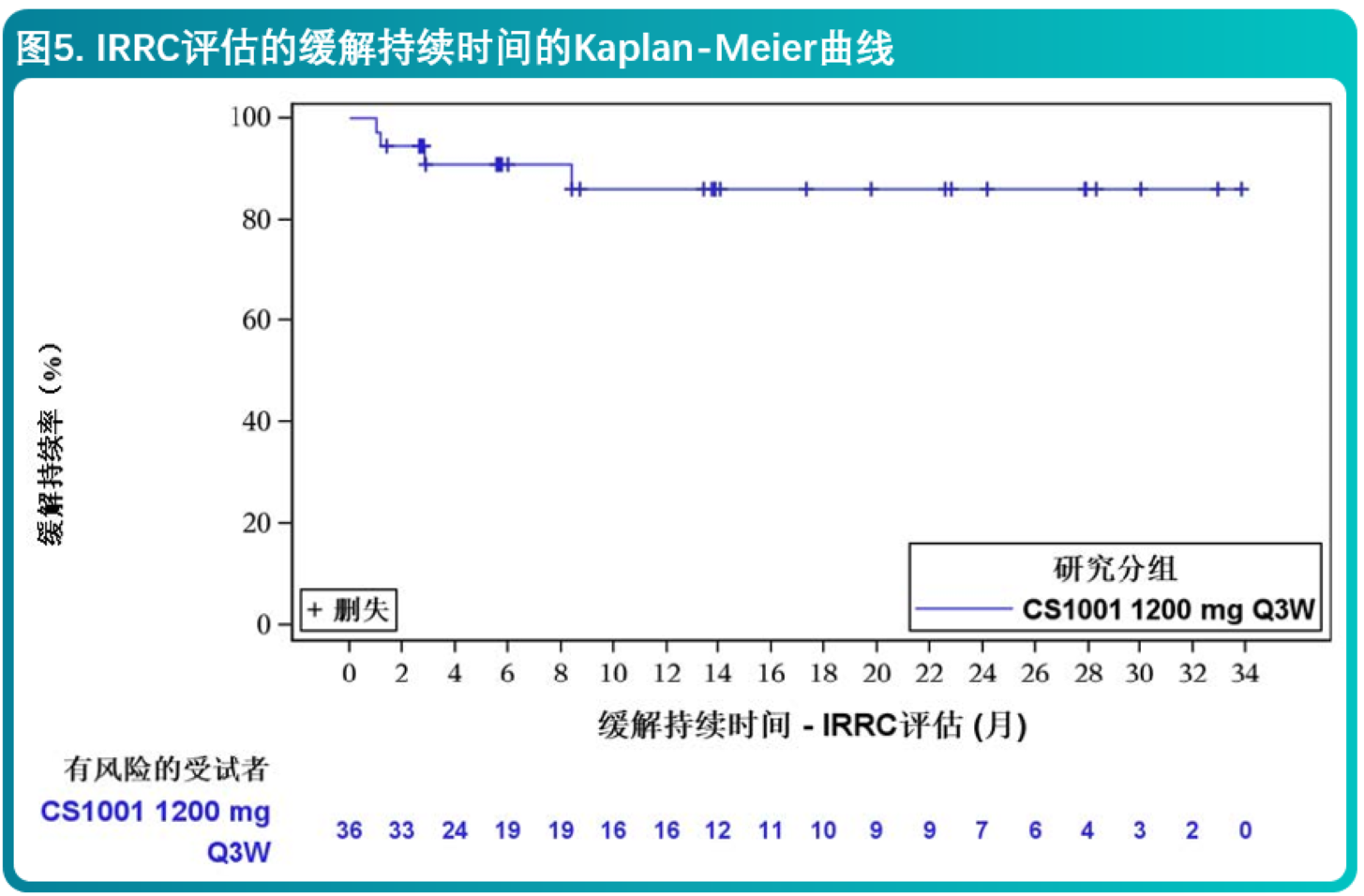
本适应症为基于单臂临床试验的客观缓解率和缓解持续时间结果获得附条件批准,尚待上市后进一步确证。
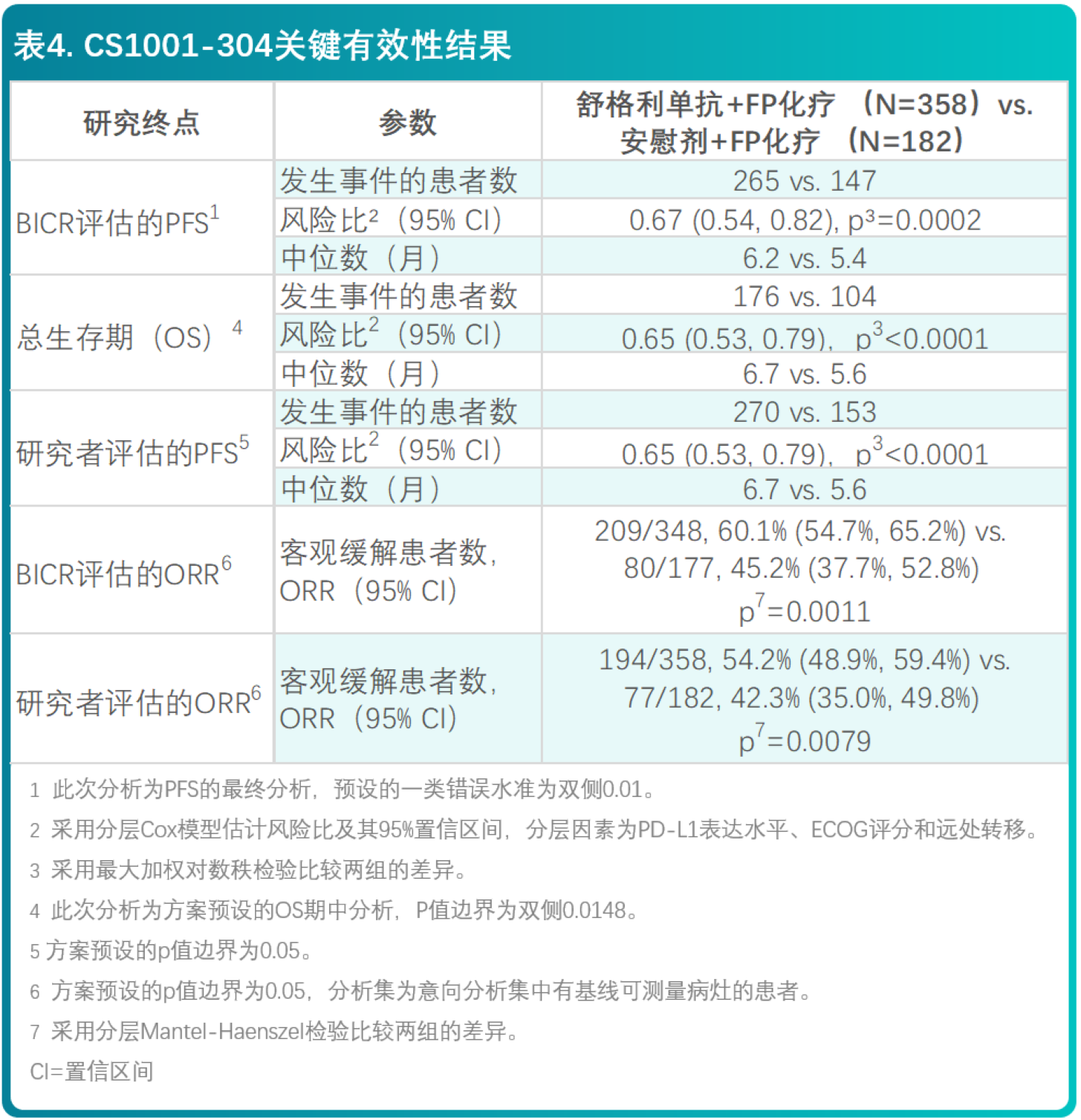
CS1001-304:一项比较舒格利单抗联合氟尿嘧啶和顺铂(FP)方案对比安慰剂联合FP方案一线治疗不可手术切除的局部晚期、复发或转移性食管鳞癌患者的有效性与安全性的随机、双盲、多中心III期临床研究
- 本研究是一项随机、双盲、多中心的III期研究,旨在评价舒格利单抗联合化疗对比安慰剂联合化疗作为一线治疗,在不可手术切除的局部晚期、复发或转移性食管鳞癌患者中的有效性和安全性。符合入组标准的患者,按照2:1的比例随机分组,预设的随机分层因素包括PD-L1 表达 <1% vs. ≥1%且<10% vs. ≥10%(即CPS <1 vs. 1≤ CPS <10 vs. CPS ≥10);ECOG PS评分(0 vs. 1);远处转移(无 vs. 有)。入组患者接受以下治疗方案之一:
- 舒格利单抗1200mg联合顺铂80mg/m2,静脉输注,每3周一次;和氟尿嘧啶800mg/m2/天,每3周的第1至4天持续静脉滴注。
- 安慰剂联合顺铂80mg/m2,静脉输注,每3周一次;和氟尿嘧啶800mg/m2/天,每3周的第1至4天持续静脉滴注。
- 联合治疗至多6个周期,之后分别接受舒格利单抗或安慰剂治疗(剂量与联合治疗相同),直至疾病进展、不可耐受的毒性、撤回知情同意、达到方案规定的最长治疗时间或研究结束。最长治疗期为两年,但届时若患者仍有临床获益,则可继续研究治疗。主要疗效终点指标为盲态独立中心审阅委员会(BICR)评估的PFS(根据RECIST v1.1)和 OS。次要终点包括研究者评估的PFS(根据RECIST v1.1)、BICR和研究者根据RECIST v1.1 评估的客观缓解率(ORR)和缓解持续时间(DOR)等。将从首次给药起至1年内(含)每6周进行一次影像学评估;1年之后,每12周进行一次影像学评估,直至BICR评估的疾病进展、受试者退出研究或研究结束,以先发生者为准。
- 共540例患者随机分配,接受舒格利单抗联合化疗(N=358)或安慰剂联合化疗(N=182)。两组间的基线特征均衡,符合不可手术的局部晚期、复发或转移性食管鳞癌患者的人群特征。所有患者的基线特征为:中位年龄62.0岁(范围:40至75岁),40.4%的患者年龄≥65岁,87.4%的患者为男性。患者的基线ECOG PS评分为0(21.1%)或1(78.9%)。IV期患者的比例为90.4%,有远处转移的患者比例为79.4%。PD-L1表达水平≥1%且<10%的患者比例为45.6%,≥10%的患者比例为43.0%。
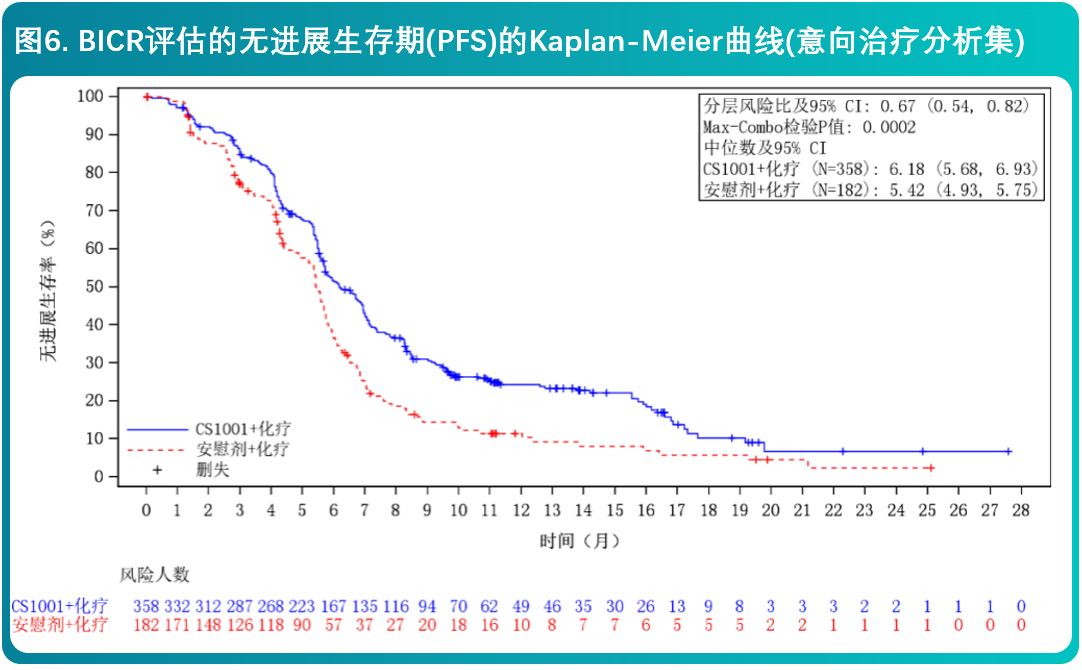
- 研究结果表明,相较于安慰剂联合化疗,舒格利单抗联合化疗作为一线治疗延长了晚期食管鳞癌患者的PFS和OS,研究结果达到统计学显著性,且具有临床意义。亚组分析结果显示,BICR评估的PFS和OS在各个亚组中的获益趋势跟意向治疗人群中获益基本一致。研究者评价的PFS结果与主要研究终点一致。其他次要终点数据也支持主要研究终点结果。
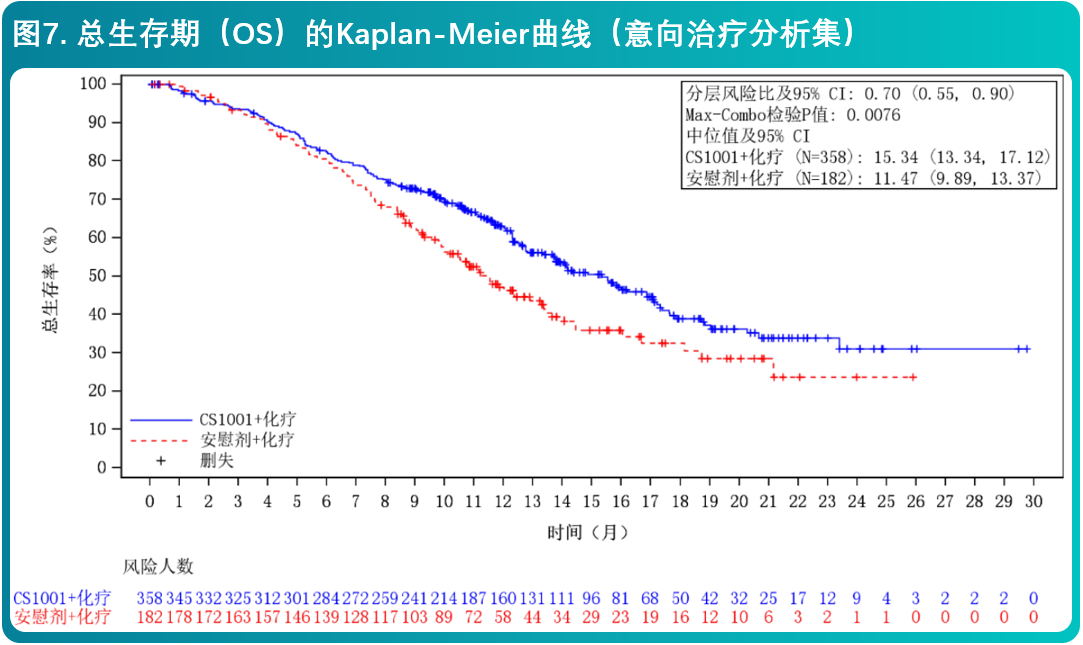
- CS1001-304研究有效性结果总结在表4和图6、7中。
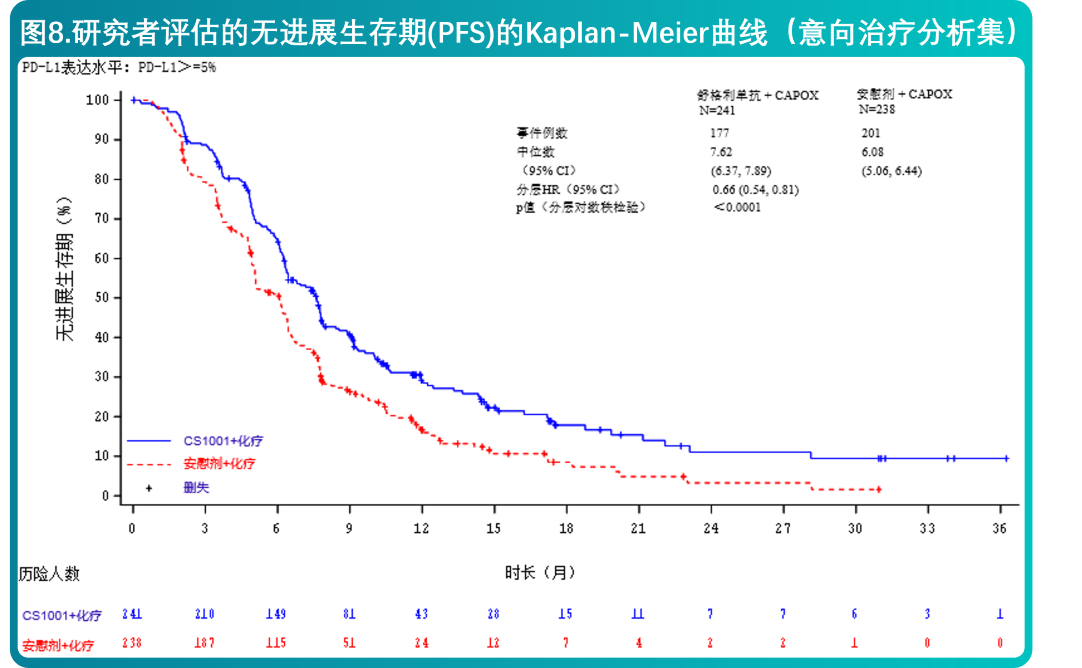
CS1001-303:一项评价舒格利单抗联合化疗对比单独化疗治疗不可手术切除的局部晚期或转移性胃或胃食管结合部腺癌患者的随机双盲研究
- 本研究是一项随机、双盲、多中心的III期研究,旨在评价舒格利单抗联合化疗对比安慰剂联合化疗作为一线治疗,在不可手术切除的局部晚期或转移性胃或胃食管结合部腺癌患者中的有效性和安全性。该研究入组患者包含病理组织学检查证实为单纯性腺癌,根据中心实验室分析结果,肿瘤组织的PD-L1表达≥5%(包含肿瘤细胞和肿瘤浸润免疫细胞中的PD-L1表达,即CPS≥5。本研究排除了已知人表皮生长因子受体 2(HER-2)阳性患者或不稳定性中枢神经系统(CNS)转移患者。患者按照1:1的比例随机分组,预设的随机分层因素包括肿瘤组织 PD-L1 状态(CPS 5-9 vs. CPS≥10)和ECOG 体能状态(0 vs. 1)。入组患者接受以下治疗方案之一:
- 舒格利单抗1200 mg联合奥沙利铂130 mg/m2,静脉输注,每3周一次;和卡培他滨1000 mg/m2餐后口服,每日2次,持续给药14天,每3周为1周期。
- 安慰剂联合奥沙利铂130 mg/m2,静脉输注,每3周一次;和卡培他滨1000 mg/m2餐后口服,每日2次,持续给药14天,每3周为1周期。
- 联合治疗最多6个周期,之后分别接受舒格利单抗或安慰剂治疗(剂量与联合治疗相同),直至疾病进展、不能耐受的毒性反应或方案规定的其他原因。最长治疗期为两年,但届时若患者仍有临床获益则可继续研究治疗。主要疗效终点指标为研究者评估的PFS(根据RECIST v1.1)和 OS。次要终点包括客观缓解率(ORR)、缓解持续时间(DOR)、盲态独立中心审阅委员会(BICR)评估的PFS(根据RECIST v1.1)等。治疗期,在第1年内:首次给药后第9周进行一次影像学评估,此后每6周进行一次影像学评估;1年之后:每12周进行一次影像学评估,直至疾病进展、失访、死亡、或研究结束,以先发生者为准。
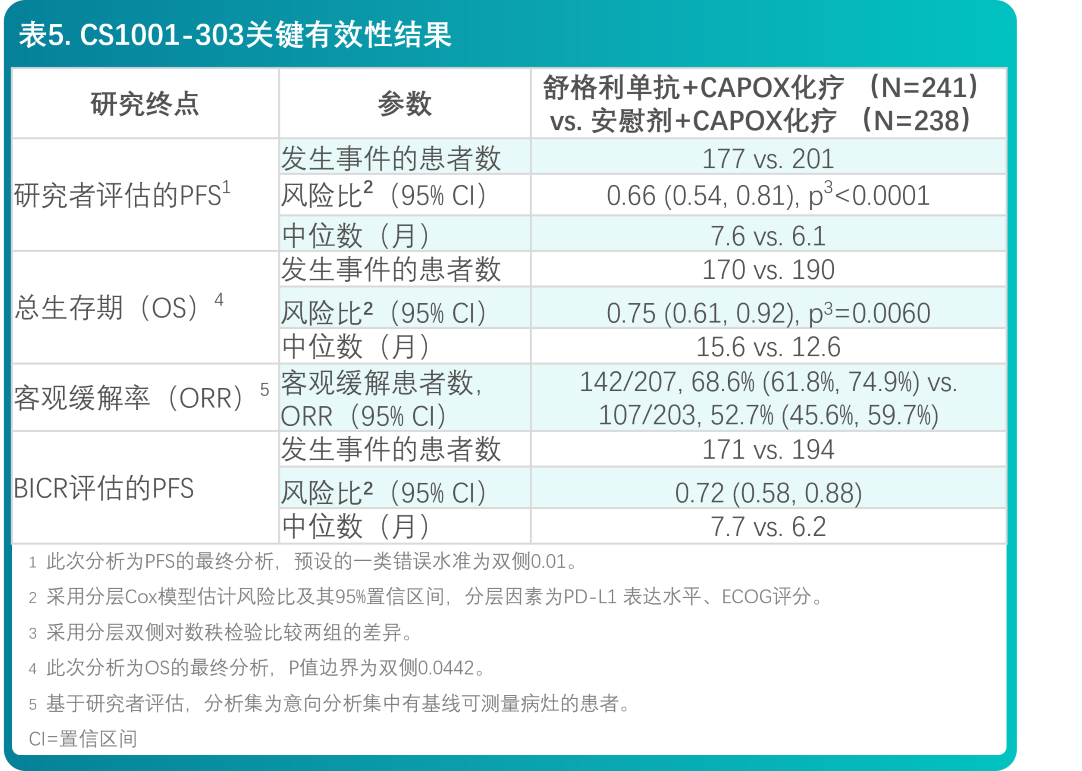
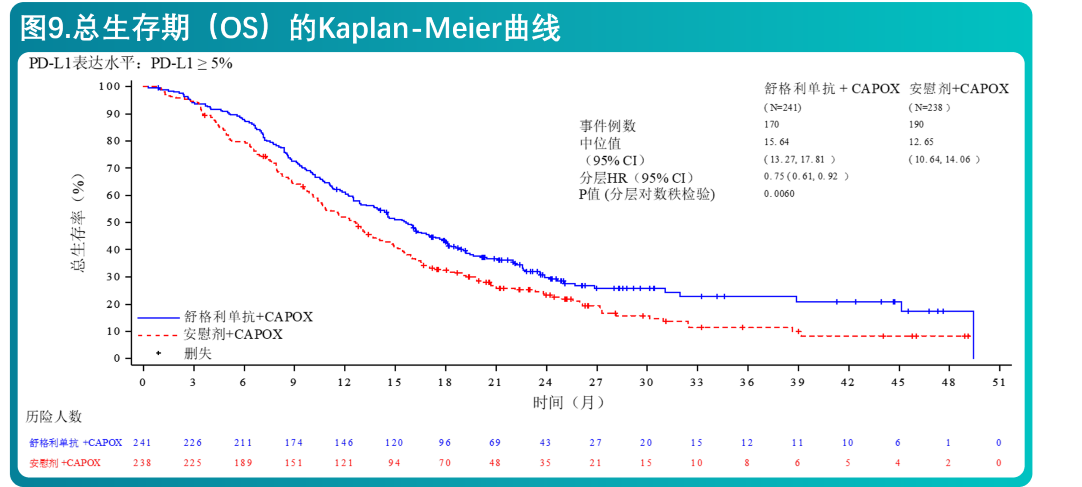
- 共479例患者随机分配,接受舒格利单抗联合化疗(N=241)或安慰剂联合化疗(N=238)。两组间的基线特征均衡,符合晚期或转移性胃或胃食管结合部腺癌患者的人群特征。所有患者的基线特征为:中位年龄63岁(范围:25至75岁),43.2%的患者年龄≥65岁,73.1%的患者为男性。患者的基线ECOG体能状态为0(24.6%)或1(75.4%)。89.6%的患者为胃腺癌,10.4%的患者为胃食管结合部腺癌。46.1%的患者PD-L1 CPS 5-9,53.9%的患者PD-L1 CPS≥10。
- 在肿瘤组织PD-L1表达(CPS≥5)的不可手术切除的局部晚期或转移性胃或胃食管结合部腺癌患者中,舒格利单抗联合化疗相较于安慰剂联合化疗,延长了研究者评估的PFS和OS,达到统计学显著性,且具有临床意义。有效性结果列于表6和图6、7中。
- CS1001-304研究有效性结果总结在表5和图8、9中。
- 舒格利单抗的安全性数据来自于8项临床研究共计1437例接受舒格利单抗单药治疗及联合含铂化疗治疗的患者。其中单药治疗临床研究为5项,共计523例患者,其中包括:CS1001-301研究:255例非小细胞肺癌患者,和CS1001-201研究:80例复发或难治性结外NK/T细胞淋巴瘤患者。舒格利单抗联合含铂化疗治疗的临床研究1项:CS1001-302,为非小细胞肺癌患者(N=320)。CS1001-303,为胃及胃食管结合部腺癌患者(N=241);CS1001-304,为食管鳞癌患者(N=353)。上述研究中1437例患者接受的舒格利单抗用药均为1200 mg固定剂量每3周一次。
- 接受舒格利单抗单药治疗的523例患者中所有级别的不良反应发生率为80.1%,最常见(发生率≥10%)的不良反应包括:贫血、天门冬氨酸氨基转移酶升高、丙氨酸氨基转移酶升高、皮疹、甲状腺功能减退症、发热、肺部炎症、血胆红素升高、蛋白尿、高血糖症、高脂血症。3级及以上不良反应发生率为16.1%,其中发生率>1%的包括:贫血、肺部炎症、血胆红素升高、天门冬氨酸氨基转移酶升高、低钠血症、丙氨酸氨基转移酶升高。
- 接受舒格利单抗联合含铂化疗的914例患者中所有级别的不良反应发生率为95.0%,最常见(发生率≥10%)的不良反应包括:贫血、天门冬氨酸氨基转移酶升高、疲劳、丙氨酸氨基转移酶升高、低钾血症、低钠血症、发热、皮疹、腹泻、高脂血症、甲状腺功能减退症、高血糖症、γ-谷氨酰转移酶升高、血胆红素升高。3级及以上不良反应发生率为29.8%,其中发生率>1%的包括:贫血、低钾血症、低钠血症、疲劳、γ-谷氨酰转移酶升高、肝功能异常、高血糖症和血胆红素升高。
不良事件分级表4
CTCAE术语
- 不良事件是指接受一种医学治疗或产品后出现的任何不利的和非预期的迹象(包括实验室检查异常)、症状、疾病, 该事件不一定与接受的治疗或产品有关。
- 不良事件是一个术语,是用于医疗文件和科学分析的特定事件的独特表示。
- 每个不良事件术语均是MedDRA的最小术语。
分级
分级是把不良事件(AE)的严重程度进行归类。CTCAE 在基于下述基础原则的基础上运用独特的临床描述将不良事件(AE)的严重程度分为1~5级:

*工具性日常生活活动是指做饭、购买杂货或衣服、使用电话、理财等等。
**自理性日常生活活动是指洗澡、穿衣和脱衣、进食、如厕、服用药物,而不是卧床不起。
美国国立癌症研究所的不良事件通用术语评估标准第4.03版(NCI-CTCAE v4.03)
舒格利单抗相关AE分级4
| 甲亢 | 1级 | 无症状;仅临床检查或诊断所见;无需治疗 |
| 2级 | 有症状;甲状腺抑制治疗;影响工具性日常生活活动 | |
| 3级 | 严重;影响个人日常生活活动;需要住院治疗 | |
| 4级 | 危及生命;需要紧急治疗 | |
| 5级 | 死亡 |
| 甲减 | 1级 | 无症状;仅临床检查或诊断所见;无需治疗 |
| 2级 | 有症状;甲状腺激素替代治疗;影响工具性日常生活活动 | |
| 3级 | 严重;影响个人日常生活活动;需要住院治疗 | |
| 4级 | 危及生命;需要紧急治疗 | |
| 5级 | 死亡 |
| 高血糖症 | 1级 | 空腹葡萄糖浓度>正常值上限-160mg/dL; 空腹葡萄糖浓度>正常值上限-8.9mmol/L |
| 2级 | 空腹葡萄糖浓度>160-250mg/dL;>8.9-13.9mmol/L | |
| 3级 | 空腹葡萄糖浓度>250-500mg/dL;>13.9-27.8mmol/L;需要住院治疗 | |
| 4级 | >500mg/dL;>27.8mmol/L;危及生命 | |
| 5级 | 死亡 |
| 痤疮样皮疹 | 1级 | 丘疹和脓包小于10%体表面积,伴有/不伴有瘙痒和敏感 |
| 2级 | 丘疹和脓包10%-30%体表面积,伴有/不伴有瘙痒和敏感,有心理障碍; 影响工具性日常生活活动 | |
| 3级 | 丘疹和脓包大于30%体表面积,伴有/不伴有瘙痒和压痛, 个人自理能力受限,与口服抗生素和抗体药物有关 | |
| 4级 | 丘疹和脓包覆盖在任何体表面积,伴有/不伴有瘙痒和敏感, 有抗生素和抗体药物服用史,危及生命 | |
| 5级 | 死亡 |
| 斑丘疹 | 1级 | 斑丘疹覆盖小于10%体表面积,伴有/不伴有症状(瘙痒,发热,紧凑感) |
| 2级 | 斑丘疹覆盖面积10-30%,伴有/不伴有症状(瘙痒,发热,紧凑感);影响工具性日常生活活动 | |
| 3级 | 斑丘疹覆盖面积大于30%,伴有/不伴有症状,个人自理能力受限 | |
| 4级 | —— | |
| 5级 | —— |
| 病毒性肝炎 | 1级 | 无症状,无需治疗 |
| 2级 | —— | |
| 3级 | 有症状的肝功能障碍;组织活检法发现出现肝纤维化;代偿期肝硬化; 慢性肝炎活动期 | |
| 4级 | 失代偿期肝功能(例如:腹水,凝血障碍,肝性脑病,昏迷) | |
| 5级 | 死亡 |
| 慢性肾脏疾病 | 1级 | 肾小球滤过率或肌酐清除率小于60ml/min/1.73m2,蛋白尿2+; 尿蛋白定量大于0.5 |
| 2级 | 肾小球滤过率或者肌酐清除率 59-30ml/min/1.73m2 | |
| 3级 | 肾小球滤过率或者肌酐清除率 29-15ml/min/1.73m2 | |
| 4级 | 肾小球滤过率或者肌酐清除率小于15ml/min/1.73m2; 需要透析或移植肾脏 | |
| 5级 | 死亡 |
| 心肌炎 | 1级 | 心肌炎无症状,有实验室检查(例如:BNP(利尿肽))或心脏影像学异常 |
| 2级 | 轻度到中等活动或用力时出现症状 | |
| 3级 | 静息状态下或轻微活动或用力便出现症状;需要治疗 | |
| 4级 | 危及生命;需要紧急治疗(例如:连续输液治疗或机械辅助血液循环) | |
| 5级 | 死亡 |
| 肺炎 | 1级 | 无症状;仅临床检查或诊断发现;不需要干预 |
| 2级 | 有症状;需要干预;影响工具性日常生活活动 | |
| 3级 | 重度症状;个人自理能力受限;需要吸氧 | |
| 4级 | 危及生命的呼吸障碍;需要紧急治疗(气管切开或插管) | |
| 5级 | 死亡 |
| 结肠炎 | 1级 | 无症状;仅临床检查或诊断所见;无需治疗 |
| 2级 | 腹痛;粘液便或血便 | |
| 3级 | 剧烈腹痛;排便习惯改变;需要内科治疗;腹膜刺激征阳性 | |
| 4级 | 危及生命;需要紧急治疗 | |
| 5级 | 死亡 |
| 输液相关反应 | 1级 | 轻微的、暂时性反应;无需中断输液;无需治疗 |
| 2级 | 需要治疗或输液中断,但对症治疗(抗组胺NSAIDAS,麻醉品,输液,治疗), 快速收效;预防给药≤24 hrs | |
| 3级 | 症状缓解拖延(例如:对症治疗和/或输液中断,不能快速反应); 症状改善后复发;需要住院治疗后遗症 | |
| 4级 | 危及生命;需要紧急治疗 | |
| 5级 | 死亡 |
注:不良反应严重程度依据美国国立癌症研究所的不良事件通用术语评估标准 第4.03版(NCI-CTCAE v4.03)
声明:关于舒格利单抗更多详细信息请参见完整版药品说明书。
辉瑞公司无法针对个体患者不良事件的诊断和处理提出任何临床建议,应当由临床医生根据患者的具体请况作出合理判断和采取相应措施。
概况1
- 在开放标签研究接受舒格利单抗单药治疗的268例患者中,总计3例(1.1%)患者发生了免疫相关性肺炎,2级为1例(0.4%),3级为2例(0.7%)。至首例事件发生的中位时间为126.0天(范围:72-342天),中位持续时间为570.0天(范围:2-767天)。1例(0.4%)患者终止治疗,1例(0.4%)患者暂停给药。2例(0.7%)患者接受了高剂量(每天≥40 mg强的松等效剂量)皮质类固醇治疗。3例患者中,1例患者病情已恢复,1例患者病情缓解。
- 在CS1001-301安慰剂对照研究(该研究的所有患者在入组前均接受过放化疗)接受舒格利单抗单药治疗的255例患者中,总计41例(16.1%)患者发生了免疫相关性肺炎(安慰剂组中有9例 [7.1%],3级为1例,其余均为1-2级),3级为4例(1.6%),4级为2例(0.8%),5级为1例(0.4%),其余均为1-2级。至首例事件发生的中位时间为117.6天(范围:3-490天),中位持续时间为446.0天(范围:8+-845+天)。13例(5.1%)患者终止治疗, 19例(7.5%)患者暂停给药。31例(12.2%)患者接受了全身皮质类固醇治疗,27例(10.6%)患者接受了高剂量(每天≥40 mg强的松等效剂量)皮质类固醇治疗。41例患者中,有15例患者病情已恢复,14例患者病情缓解。
- 接受舒格利单抗联合含铂化疗的914例患者中,总计17例(1.9%)患者发生了免疫相关性肺炎,其中1级3例(0.3%),2级9例(1.0%),3级3例(0.3%),5级2例(0.2%)。至首例事件发生的中位时间为165.0天(范围:48-604天),中位持续时间未达到(范围:15-838天)。6例(0.7%)患者终止治疗,11例(1.2%)患者暂停给药。13例(1.4%)患者接受了全身皮质类固醇治疗,其中12例(1.3%)患者接受了高剂量(每天≥40 mg强的松等效剂量)皮质类固醇治疗。3例患者病情已恢复,1例患者病情缓解。
处理策略1
- 在接受本品治疗的患者中有免疫相关性肺炎的报告。应监测患者是否有肺炎症状和体征,如呼吸困难、缺氧表现、咳嗽、胸痛等,以及放射学改变(例如局部毛玻璃样混浊、斑块样浸润)。疑似免疫相关性肺炎的病例应采用影像学、肺功能、动脉血氧饱和度等检查进行评估和确认,并排除感染、疾病相关等其他病因。对于2级免疫相关性肺炎的患者,应暂停本品治疗。对于3级或4级或复发性2级免疫相关性肺炎,应永久停止本品治疗。
声明:关于舒格利单抗更多详细信息请参见完整版药品说明书。
辉瑞公司无法针对个体患者不良事件的诊断和处理提出任何临床建议,应当由临床医生根据患者的具体请况作出合理判断和采取相应措施。
概况1
- 接受舒格利单抗单药治疗的523例患者中,总计6例(1.1%)患者发生了免疫相关性肝炎,其中2级为2例(0.4%),3级为3例(0.6%),4级为1例(0.2%)。至首例事件发生的中位时间为98.5天(范围:22-625天),中位持续时间尚未达到(范围:38-875天)。2例(0.4%)患者终止治疗,1例(0.2%)患者暂停给药。4例(0.8%)患者接受了高剂量(每天≥40 mg强的松等效剂量)皮质类固醇治疗。6例患者中,2例患者病情已恢复,2例患者病情缓解。
- 接受舒格利单抗联合含铂化疗的914例患者中,总计12例(1.3%)患者发生了免疫相关性肝炎,其中3级为10例(1.1%),4级为2例(0.2%)。至首例事件发生的中位时间为95.0天(范围:18-652天),中位持续时间59.0天(范围:5-777天)。7例(0.8%)患者终止治疗,6例(0.7%)患者暂停给药。10例患者接受了高剂量(每天≥40 mg强的松等效剂量)皮质类固醇治疗。12例患者中,7例患者病情已恢复,2例患者病情缓解。
处理策略1
- 在接受本品治疗的患者中有免疫相关性肝炎的报告。应定期(每个月)监测患者肝功能的变化及肝炎相应的症状和体征,并排除感染及与基础疾病相关的病因。如发生免疫相关性肝炎,应增加肝功能检测频率。给予皮质类固醇治疗[初始剂量为0.5-1mg/kg/天(针对2级肝炎)和1-2mg/kg/天(针对≥3级肝炎)泼尼松或等效剂量,之后逐渐减少剂量],并根据肝酶升高的严重程度决定是暂时停药还是永久停药。对于2级免疫相关性肝炎,应暂停本品治疗。对于3级或4级免疫相关性肝炎,应永久停止本品治疗。
声明:关于舒格利单抗更多详细信息请参见完整版药品说明书。
辉瑞公司无法针对个体患者不良事件的诊断和处理提出任何临床建议,应当由临床医生根据患者的具体请况作出合理判断和采取相应措施。
甲状腺功能减退1
- 接受舒格利单抗单药治疗的523例患者中,总计87例(16.6%)患者发生了免疫相关性甲状腺功能减退,其中53例(10.1%)为1级,29例(5.5%)为2级,5例(1.0%)为3级。至首例事件发生的中位时间为89.0天(范围:11-683天),中位持续时间为125.0天(范围:8-1018天)。1例患者终止治疗,11例患者暂停给药。1例患者接受全身皮质类固醇治疗,45例患者接受了甲状腺激素替代治疗。87例患者中,28例患者病情已恢复,10例患者病情缓解。
- 接受舒格利单抗联合含铂化疗的914例患者中,总计90例(9.8%)患者发生了免疫相关性甲状腺功能减退,其中1级为35例(3.8%),2级为55例(6.0%),未发生3-5级事件。至首例事件发生的中位时间为141.0天(范围:19-607天),中位持续时间为304.0天(范围:3-788天)。10例(1.1%)患者暂停给药。90例患者中,69例(7.5%)患者接受了甲状腺激素替代治疗,4例(0.4%)患者接受了全身皮质类固醇治疗,其中2例(0.2%)患者接受了高剂量(每天≥40 mg强的松等效剂量)皮质类固醇治疗。18例患者病情已恢复,18例患者病情缓解。
甲状腺功能亢进1
- 接受舒格利单抗单药治疗的523例患者中,总计59例(11.3%)患者发生了免疫相关性甲状腺功能亢进,其中49例(9.4%)为1级,9例(1.7%)为2级,1例(0.2%)为3级。至首例事件发生的中位时间为42.0天(范围:11-303天),中位持续时间为43.0天(范围:15-1000天)。无患者因免疫相关性甲状腺功能亢进终止治疗,3例患者暂停给药。1例患者接受高剂量(每天≥40 mg强的松等效剂量)皮质类固醇治疗,11例患者接受了甲状腺药物治疗。59例患者中,43例患者病情已恢复,2例患者病情已恢复伴后遗症,4例患者病情缓解。
- 接受舒格利单抗联合含铂化疗的914例患者中,总计49例(5.4%)患者发生了免疫相关性甲状腺功能亢进,其中1级为44例(4.8%),2级为5例(0.5%),未发生3-5级事件。2例(0.2%)患者因甲状腺功能亢进暂停给药。至首例事件发生的中位时间为83.0天(范围:41-620天),中位持续时间为48.0天(范围:19-857天)。49例患者中,5例(0.5%)患者接受了甲状腺药物治疗,1例(0.1%)患者接受了全身皮质类固醇治疗。42例患者病情已恢复,1例患者病情缓解。
甲状腺炎1
- 接受舒格利单抗单药治疗的523例患者中,总计5例(1.0%)患者发生了免疫相关性甲状腺炎,均为1级。至首例事件发生的中位时间为42.0天(范围:40-176天),中位持续时间尚未达到(范围:22-246天)。2例(0.4%)患者接受了甲状腺药物治疗。5例患者中,2例患者已恢复。
- 接受舒格利单抗联合含铂化疗的914例患者中,总计13例(1.4%)患者发生了免疫相关性甲状腺炎,其中1级为7例(0.8%),2级为6例(0.7%),未发生3-5级事件。2例(0.2%)患者暂停给药。至首例事件发生的中位时间为83.0天(范围:42-277天),中位持续时间未达到(范围:4-1022天)。5例(0.5%)患者接受了甲状腺药物治疗,1例(0.1%)患者接受高剂量(每天≥40 mg强的松等效剂量)皮质类固醇治疗。13例患者中,5例患者病情已恢复,3例患者病情缓解。
处理策略1
- 在接受本品治疗的患者中有甲状腺功能紊乱的报告,包括甲状腺功能亢进,甲状腺功能减退,甲状腺炎。应密切监测患者甲状腺功能的变化及相应的症状和体征。对于症状性2级或3级甲状腺功能减退,应暂停本品治疗,并根据需要开始甲状腺激素替代治疗。对于症状性2级或3级甲状腺功能亢进,应暂停本品治疗,并根据需要给予抗甲状腺药物治疗。如果怀疑有甲状腺急性炎症,可考虑暂停本品治疗并给予皮质类固醇治疗。当甲状腺功能减退或甲状腺功能亢进的症状改善及甲状腺功能检查恢复,可根据临床需要重新开始本品治疗。对于4级甲状腺功能亢进或甲状腺功能减退,须永久停止本品治疗。应持续监测甲状腺功能,确保恰当的治疗。
垂体炎1
- 接受舒格利单抗单药治疗的523例患者中,总计1例(0.2%)患者发生了免疫相关性垂体炎(首选术语:血促皮质激素减少),为1级。至事件发生的时间为294.0天,持续时间为22天。该患者未因免疫相关性垂体炎终止治疗或暂停给药,未接受全身皮质类固醇治疗,病情已恢复。
- 接受舒格利单抗联合含铂化疗的914例患者中,总计4例(0.4%)患者发生了免疫相关性垂体炎,其中1级为2例(0.2%),2级为2例(0.2%),未发生3-5级事件。至首例事件发生的中位时间为150.0天(范围:95-271天),中位持续时间未达到(范围:44-417天)。4例(0.4%)患者均因免疫相关性垂体炎暂停给药。3例(0.3%)患者接受了高剂量(每天≥40 mg强的松等效剂量)皮质类固醇治疗。1例患者病情已恢复,2例患者病情缓解。
处理策略1
- 接受本品治疗的患者中有垂体炎的报告。应对垂体炎患者的症状和体征进行监测(包括垂体功能减退和继发性肾上腺功能不全),并排除其他病因。监测和评估垂体相关的激素水平,必要时进行功能试验,考虑垂体MRI检查和自身免疫性抗体检查。发生症状性2级或3级垂体炎时应暂停本品治疗,并根据临床需要给予激素替代治疗。如果怀疑急性垂体炎,可给予皮质类固醇治疗。发生4级垂体炎时须永久停止本品治疗。应持续监测垂体功能、肾上腺功能和激素水平,根据临床指征给予皮质类固醇和其他激素替代疗法。
糖尿病1
- 接受舒格利单抗单药治疗的523例患者中,总计7例(1.3%)患者发生了免疫相关性糖尿病,1级为5例(1.0%),2级为2例(0.4%)。至首例事件发生的中位时间为126.0天(范围:20-411天),中位持续时间为48.0天(范围:21-911天)。1例患者暂停给药。无患者接受降糖药物治疗。7例患者中,4例患者病情已恢复,1例患者病情缓解。
- 接受舒格利单抗联合含铂化疗的914例患者中,总计11例(1.2%)患者发生了免疫相关性糖尿病,其中1级为6例(0.7%),2级为1例(0.1%),3级为3例(0.3%),4级为1例(0.1%)。至首例事件发生的中位时间为170.0天(范围:42-891天),中位持续时间为106.0天(范围:10-342天)。1例(0.1%)患者因免疫相关性糖尿病终止治疗,2例(0.2%)患者暂停给药。6例(0.7%)患者接受降糖药物治疗。2例患者病情已恢复,1例患者病情缓解。
处理策略1
- 接受本品治疗的患者报告了高血糖症。应对患者的血糖水平或其他糖尿病症状和体征进行监测。根据临床需要给予胰岛素替代治疗。3级高血糖症或1型糖尿病患者,应暂停本品,给予胰岛素替代治疗直至症状缓解。对于4级高血糖症或1型糖尿病患者,须永久停用本品。应持续监测血糖水平,确保适当的胰岛素替代治疗。
声明:关于舒格利单抗更多详细信息请参见完整版药品说明书。
辉瑞公司无法针对个体患者不良事件的诊断和处理提出任何临床建议,应当由临床医生根据患者的具体请况作出合理判断和采取相应措施。
非严重皮肤不良反应1
- 接受舒格利单抗单药治疗的523例患者中,总计24例(4.6%)患者发生了免疫相关性非严重皮肤不良反应,1级为16例(3.1%),2级为8例(1.5%)。至首例事件发生的中位时间为68.0天(范围:6-1006天),中位持续时间为224.0天(范围:44-646天)。24例患者均未接受系统性皮质类固醇治疗。24例患者中,15例患者病情已恢复,1例患者病情缓解。
- 接受舒格利单抗联合含铂化疗的914例患者中,总计51例(5.6%)患者发生了免疫相关性非严重皮肤不良反应,1级为24例(2.6%),2级为27例(3.0%),未发生3-5级事件。至首例事件发生的中位时间为130.0天(范围:2-909天),中位持续时间为23.0天(范围:1-659天)。1例(0.1%)患者终止治疗,6例(0.7%)患者暂停给药。17例(1.9%)患者接受了全身皮质类固醇治疗,其中2例(0.2%)患者接受了高剂量(每天≥40 mg强的松等效剂量)皮质类固醇治疗。51例患者中,33例患者病情已恢复,9例患者病情缓解。
严重皮肤不良反应1
- 接受舒格利单抗单药治疗的523例患者中,总计6例(1.1%)患者发生了免疫相关性严重皮肤不良反应,均为3级。至首例事件发生的中位时间为13.0天(范围:3-138天),中位持续时间为285.0天(范围:41-544天)。1例(0.2%)患者终止治疗,4例(0.8%)患者暂停给药。3例(0.6%)患者接受了全身皮质类固醇治疗,其中2例(0.4%)患者接受了高剂量(每天≥40 mg强的松等效剂量)皮质类固醇治疗。6例患者中,4例患者病情已恢复。
- 接受舒格利单抗联合含铂化疗的914例患者中,总计6例(0.7%)患者发生了免疫相关性严重皮肤不良反应,均为3级。至首例事件发生的中位时间为116.5天(范围:19-430天),中位持续时间为60.0天(范围:12-522天)。1例(0.1%)患者终止治疗,5例(0.5%)患者暂停给药。4例(0.4%)患者接受了全身皮质类固醇治疗,其中3例(0. 3%)患者接受了高剂量(每天≥40 mg强的松等效剂量)皮质类固醇治疗。5例患者病情已恢复。
处理策略1
- 在接受本品治疗的患者中有免疫相关性皮肤不良反应的报告。应监测患者的重度皮肤不良反应,并应排除其他病因。对于1级或2级皮疹,可继续本品治疗,并对症治疗或进行局部皮质类固醇治疗。发生3级皮疹时应暂停本品治疗,并对症治疗或进行局部皮质类固醇治疗。发生4级皮疹、确诊SJS或TEN时应永久停止本品治疗。
声明:关于舒格利单抗更多详细信息请参见完整版药品说明书。
辉瑞公司无法针对个体患者不良事件的诊断和处理提出任何临床建议,应当由临床医生根据患者的具体请况作出合理判断和采取相应措施。
概况1
- 接受舒格利单抗单药治疗的523例患者中,总计5例(1.0%)患者发生了免疫相关性心肌炎,1级为4例(0.8%),2级为1例(0.2%)。至首例事件发生的中位时间为137.0天(范围:22-251天),中位持续时间尚未达到(范围:8-369天)。1例(0.2%)患者终止治疗,2例(0.4%)患者暂停给药。5例(1.0%)患者均接受了高剂量(每天≥40 mg强的松等效剂量)皮质类固醇治疗。5例患者中,2例患者病情已恢复,1例患者病情缓解。
- 接受舒格利单抗联合含铂化疗的914例患者中,总计3例(0.3%)患者发生了免疫相关性心肌炎,其中2级为2例(0.2%),3级为1例(0.1%)。至首例事件发生的中位时间为143.0天(范围:63-225天),中位持续时间尚未达到(范围:3-99天)。2例(0.2%)患者因免疫相关性心肌炎而暂停给药。2例(0.2%)患者接受了高剂量(每天≥40 mg强的松等效剂量)皮质类固醇治疗。2例患者病情缓解。
处理策略1
在接受本品治疗的患者中有免疫相关性心肌炎的报告。应对心肌炎的症状和体征进行监测,对于疑似免疫相关性心肌炎,应进行充分的评估以确认病因或排除其他病因,并进行心肌酶谱等相关检查。发生2级心肌炎时,应暂停本品治疗,并给予皮质类固醇治疗,心肌炎恢复至0-1级后能否重新开始本品治疗的安全性尚不明确。发生3级或4级心肌炎时,应永久停止本品治疗,并给予皮质类固醇治疗。应密切监测心肌酶谱、心功能等。
声明:关于舒格利单抗更多详细信息请参见完整版药品说明书。
辉瑞公司无法针对个体患者不良事件的诊断和处理提出任何临床建议,应当由临床医生根据患者的具体请况作出合理判断和采取相应措施。
处理策略1
- 小于1%接受舒格利单抗单药治疗的患者发生的免疫相关不良反应,包括1例2级和1例4级免疫相关性结肠炎。小于1%接受舒格利单抗联合化疗的患者发生的免疫相关不良反应,包括6例免疫相关性结肠炎(3例腹泻,结肠炎、直肠炎、免疫介导的小肠结肠炎各1例)。
- 应监测患者是否有免疫相关性结肠炎相关症状和体征,如腹痛、腹泻、粘液便或血样便,并排除感染和基础疾病相关性病因。对于2级或3级免疫相关性腹泻或结肠炎,应暂停本品治疗。对于4级或复发性3级免疫相关性结肠炎,应永久停止本品治疗。应考虑肠穿孔的潜在风险,必要时行影像学和/或内镜检查以确认。
声明:关于舒格利单抗更多详细信息请参见完整版药品说明书。
辉瑞公司无法针对个体患者不良事件的诊断和处理提出任何临床建议,应当由临床医生根据患者的具体请况作出合理判断和采取相应措施。
处理策略
- 在接受本品治疗的患者中有免疫相关性肾炎报告。应定期(每个月)监测患者肾功能的变化及肾炎相应的症状和体征。如发生免疫相关性肾炎,应增加肾功能检测频率。多数出现血清肌酐升高的患者无临床症状。应排除肾功能损伤的其他病因。肾功能变化,排除肾功能损伤的其他病因。对于≥2级肾炎给予皮质类固醇(初始剂量为1-2mg/kg/天泼尼松或等效剂量,之后逐渐减少剂量)。2级血肌酐升高应暂停本品治疗。3级或4级血肌酐升高应永久停止本品治疗。1
- 对于2级肾脏毒性,给予0.5-1mg/(kg·d)泼尼松且最大剂量<60-80mg/d;对于3-4级肾脏毒性,给予泼尼松/甲基泼尼松龙1-2mg/(kg·d)。5
声明:关于舒格利单抗更多详细信息请参见完整版药品说明书。
辉瑞公司无法针对个体患者不良事件的诊断和处理提出任何临床建议,应当由临床医生根据患者的具体请况作出合理判断和采取相应措施。
概况1
- 接受舒格利单抗单药治疗的523例患者中,总计5例(1.0%)患者发生了免疫相关性肌炎,1级为1例(0.2%),2级为3例(0.6%),4级为1例(0.2%)。至首例事件发生的中位时间为64.0天(范围:21-222天),中位持续时间尚未达到(范围:57-468天)。4例(0.8%)患者终止治疗。5例(1.0%)患者均接受了全身皮质类固醇治疗,3例(0.6%)患者接受了高剂量(每天≥40 mg强的松等效剂量)皮质类固醇治疗。5例患者中,2例患者病情已恢复,2例患者病情缓解。
- 接受舒格利单抗联合含铂化疗的914例患者中,未发生免疫相关性肌炎。
处理策略1
- 在接受本品治疗的患者中有免疫相关性肌炎的报告。对于疑似免疫相关性肌炎,应进行充分的评估以确认病因或排除其他病因。发生2-3级肌炎时,应暂停本品治疗至肌炎恢复至0-1级。发生4级肌炎时,应永久停止本品治疗,并给予皮质类固醇治疗。考虑监测肌酸激酶,必要时行肌活检等。
声明:关于舒格利单抗更多详细信息请参见完整版药品说明书。
辉瑞公司无法针对个体患者不良事件的诊断和处理提出任何临床建议,应当由临床医生根据患者的具体请况作出合理判断和采取相应措施。
概况1
- 在接受舒格利单抗单药治疗的523例患者中,总计19例(3.6%)患者报告了输液相关反应。其中,在安慰剂对照研究中接受舒格利单抗单药治疗的255例患者中,总计有1例(0.4%)患者报告了输液相关反应,安慰剂组的126例患者中,有2例(1.6%)患者报告了输液相关反应。
- 在接受舒格利单抗联合含铂化疗的914例患者中,总计35例(3.8%)患者报告了输液相关反应,安慰剂联合含铂化疗的578例患者中,总计有21例(3.6%)患者报告了输液相关反应。
处理策略1
在接受本品治疗的患者中有输液相关反应的报告。本品用药后需密切观察患者的症状和体征,包括寒战,发热,胸闷,瘙痒,皮疹,低血压等。出现2级输液相关反应时,应降低滴速或暂停给药,可考虑给予解热镇痛类抗炎药和抗组胺药治疗,当症状缓解后可考虑恢复用药并密切观察。如果出现3级或4级输液相关反应,须立即停止输液 并永久停止本品治疗,并给予适当的药物治疗。
声明:关于舒格利单抗更多详细信息请参见完整版药品说明书。
辉瑞公司无法针对个体患者不良事件的诊断和处理提出任何临床建议,应当由临床医生根据患者的具体请况作出合理判断和采取相应措施。
剂量调整方案1
| 免疫相关 不良反应 | 严重程度 | 治疗调整 |
|---|---|---|
| 肺炎 | 2级 | 暂停给药,直至不良反应恢复至0-1级 |
| 3级或4级或复发性2级 | 永久停药 | |
| 结肠炎 | 2级或3级 | 暂停给药,直至不良反应恢复至0-1级 |
| 4级或复发性3级 | 永久停药 | |
| 肝炎 | 2级,天冬氨酸氨基转移酶(AST)或丙氨酸氨基转移酶(ALT)在3-5倍正常值上限(ULN)或总胆红素(TBIL)在1.5-3倍ULN | 暂停给药,直至不良反应恢复至0-1级 |
| 3级或4级,AST或ALT>5倍ULN或TBIL>3倍ULN | 永久停药 | |
| 肾炎 | 2级血肌酐升高 | 暂停给药,直至不良反应恢复至0-1级 |
| 3级或4级血肌酐升高 | 永久停药 | |
| 内分泌 疾病 | 症状性2级或3级甲状腺功能减退、2级或3级甲状腺功能亢进、2级或3级垂体炎、2级肾上腺功能不全、3级高血糖症或1型糖尿病 | 暂停给药,直至不良反应恢复至0-1级 |
| 4级甲状腺功能减退;4级甲状腺功能亢进;4级垂体炎;3级或4级肾上腺功能不全;4级高血糖症或1型糖尿病 | 永久停药 | |
| 皮肤 不良反应 | 3级 | 暂停给药,直至不良反应恢复至0-1级 |
| 4级,史蒂文斯-约翰逊综合征(SJS)或中毒性表皮坏死松解症(TEN) | 永久停药 | |
| 其他免疫 相关不良 反应 | 2级胰腺炎1;2级心肌炎2;其他2级或3级首次发生的免疫相关不良反应根据反应的严重程度和类型 | 暂停给药,直至不良反应恢复至0-1级 |
| 3级或4级胰腺炎;3级或4级心肌炎 3级或4级脑炎;4级首次发生的其他免疫相关不良反应 | 永久停药 | |
| 复发的 不良反应 | 复发性3级或4级(内分泌疾病除外) | 永久停药 |
| 持续的 不良反应 | 末次给药后12周内2级或3级不良反应未改善到0-1级(内分泌疾病除外) 末次给药后12周内皮质类固醇未能降至≤10mg/天强的松等效剂量 | 永久停药 |
| 输液 相关反应 | 严重程度 | 治疗调整 |
| 输液 相关反应 | 2级 | 降低滴速或暂停给药,当症状缓解后可考虑恢复用药并密切观察 |
| 3级或4级 | 永久停药 | |
| 1 无症状的胰腺炎或单纯的胰酶/脂肪酶升高建议继续临床监查,但无需暂停给药。 2 心肌炎经治疗改善到 0-1 级后重新开始本品治疗的安全性尚不明确。 | ||
声明:关于舒格利单抗更多详细信息请参见完整版药品说明书。
辉瑞公司无法针对个体患者不良事件的诊断和处理提出任何临床建议,应当由临床医生根据患者的具体请况作出合理判断和采取相应措施。
- Management of Immune-Related Adverse Events in Patients Treated With Immune Checkpoint Inhibitor Therapy:ASCO Guideline Update
- Chest CT Diagnosis and Clinical Management of Drug-Related Pneumonitis in Patients Receiving Molecular Targeting Agents and Immune Checkpoint Inhibitors
- (NCCN) Management of Immunotherapy-Related Toxicities
- (NCCN Guidelines for Patients) Immunotherapy Side Effects
- Expert consensus on perioperative immunotherapy for local advanced non-small cell lung cancer
- Society for Immunotherapy of Cancer (SITC) clinical practice guideline on immune checkpoint inhibitor-related adverse events
- Multinational Association of Supportive Care in Cancer (MASCC) 2020 clinical practice recommendations for the management of immune-related adverse events: pulmonary toxicity
- European recommendations for management of immune checkpoint inhibitors-derived dermatologic adverse events. The EADV task force 'Dermatology for cancer patients' position statement
- Immune Checkpoint Inhibitor-Associated Pneumonitis in Non-Small Cell Lung Cancer: Current Understanding in Characteristics, Diagnosis, and Management
- 非小细胞肺癌围手术期免疫治疗相关不良反应管理的临床诊疗建议
- 免疫检查点抑制剂相关感染诊治建议
- 免疫检查点抑制剂风湿性毒副反应诊治建议
- 免疫检查点抑制剂相关血液毒性处理的临床诊疗建议
- 免疫检查点抑制剂相关肺炎的临床诊治建议
- 免疫检查点抑制剂相关心脏不良反应的临床诊治建议
- 免疫检查点抑制剂相关消化系统不良反应的临床诊治建议
- 免疫检查点抑制剂相关神经系统不良反应的临床诊治建议
- 免疫检查点抑制剂相关肾脏不良反应的临床诊治建议
- 驱动基因阳性晚期非小细胞肺癌免疫治疗专家共识(2023版)
- 免疫检查点抑制剂用于进展期胃癌围手术期治疗的中国专家共识(2024版)
- 非小细胞肺癌围手术期免疫规范化治疗专家共识
- 食管癌免疫检查点抑制剂临床应用全程管理专家共识
- 恶性肿瘤免疫治疗技术应用指南(精简版)
- 非小细胞肺癌放疗联合免疫治疗中国专家共识(2024版)
辉瑞医学信息网站指南版块查阅下载 下载链接
如需指南共识原文,请您联系辉瑞医学信息部:[email protected], 或通过辉瑞医学信息网站在线提问获取。
请注意:我们不建议超出国家药品监督管理局批准的药品说明书的应用或未在中国(不含港澳台)上市药品的应用。如我们所提供的文献信息及指南共识涉及该等内容,系出于传递科学知识的需要,不应视为对未在中国(不含港澳台)上市药品或已在中国上市但超出国家药品监督管理局批准的药品说明书的药品适应症/用法的推广。
GEMSTONE-302研究期刊文献
2023《Nature Cancer》杂志
Interim survival analysis of the randomized phase III GEMSTONE-302 trial: sugemalimab or placebo plus chemotherapy as first-line treatment for metastatic NSCLC
2022《Lancet Oncology》杂志
GEMSTONE-302研究会议报道
2021 WCLC会议
2020 ESMO Asia会议
GEMSTONE-201研究期刊文献
2023《Journal of Clinical Oncology》杂志
GEMSTONE-201研究会议报道
2022 ASCO会议
2019 ASH会议
GEMSTONE-304研究期刊文献
2024《Nature Medicine》杂志
GEMSTONE-304研究会议报道
GEMSTONE-303研究期刊文献
GEMSTONE-303研究会议报道
2023 ESMO会议
2020 ESMO会议
如需核心研究原文,请您联系辉瑞医学信息部:[email protected], 或通过辉瑞医学信息网站在线提问获取。
国内
- 2025年9月10-14日 中国济南
2025年中国临床肿瘤学会(CSCO)年会
- 2025年11月6-9日 中国昆明
2025年中国整合肿瘤学大会(CCHIO)
国外
- 2025年9月6-9日
2025年世界肺癌大会(WCLC)
- 2025年10月9-11日 越南胡志明市
2025年IASLC亚洲肺癌大会(ACLC)
- 2025年10月17-21日 德国柏林
2025年欧洲肿瘤内科学会(ESMO)年会
- 2025年11月6-8日 日本东京
2025年日本肺癌学会(JLCS)年会
- 2025年11月5-9日 美国国家海港
2025年癌症免疫治疗学会(SITC)年会
- 2025年12月5-7日 新加坡
2025年ESMO亚洲年会
- 2025年12月5-7日 美国芝加哥
2025年IASLC北美肺癌大会(NACLC)
- 2025年12月10-12日 英国伦敦
2025年ESMO免疫肿瘤学大会
- 2026年3月12-14日 德国慕尼黑
2026年癌症免疫治疗大会(ITOC)
- 2026年5月29日-6月2日 美国芝加哥
2026年美国临床肿瘤学会(ASCO)年会
请注意:我们不建议超出国家药品监督管理局批准的药品说明书的应用或未在中国(不含港澳台)上市药品的应用。如我们所提供的文献信息及指南共识涉及该等内容,系出于传递科学知识的需要,不应视为对未在中国(不含港澳台)上市药品或已在中国上市但超出国家药品监督管理局批准的药品说明书的药品适应症/用法的推广。
1. 舒格利单抗注射液说明书
2. Abdin SM, et al. Cancers(Basel). 2018;10(2):32.
3. Jifang Gong, et al. Cancer Immunology, Immunotherapy. Published online January 5, 2022.
4. 美国国立癌症研究所的不良事件通用术语评估标准第4.03版(NCI-CTCAE v4.03)
5. 中国临床肿瘤学会(CSCO)免疫检查点抑制剂相关的毒性管理指南2023.



