请仔细阅读说明书并在医师指导下使用
舒坦明 ®适用于3月龄及以上轻度至中度特应性皮炎患者的局部外用治疗 。
每克本品含20 mg克立硼罗(2%)。
将一薄层舒坦明®涂于患处,每日两次。达到临床效果后可减为每日一次(参见【临床试验】)。
舒坦明®仅外用,不宜口服、眼内使用或阴道内给药。
临床试验经验
由于临床试验在不同的条件下完成,在一种药物的临床试验中观察到的不良反应率不能直接和其他药物的临床试验中的不良反应率相比较,且不一定反映实际应用中的不良反应率。
在两项双盲、赋形剂对照临床试验(试验1和试验2)中,1012名2至79岁患有轻度至中度特应性皮炎的受试者接受舒坦明®治疗,每日两次,为期四周。≥1%接受舒坦明®治疗的受试者报告的不良反应列于表1中。
表1:在4周特应性皮炎试验中,≥1%的受试者出现了不良反应
| 不良反应 | 舒坦明® 每日两次 N=1012 n (%) | 赋形剂 每日两次 N=499 n (%) |
|---|---|---|
| 外用药部位疼痛a | 45(4) | 6(1) |
a指皮肤感觉,如灼烧感或刺痛感。
在接受舒坦明®治疗的受试者中,少见(<1%)的不良反应包括接触性荨麻疹(参见【注意事项】)。
在一项含初始开放期的双盲赋形剂对照研究(试验4)中,497例3月龄及以上的轻度至中度特应性皮炎患者先接受了舒坦明®治疗,每日两次,持续最长达8周。随后为双盲期,在此期间,270例受试者中随机135例接受了舒坦明®治疗,另135例接受了赋形剂治疗,每日一次,持续52周或至出现复发。开放期观察到的不良反应与每日两次舒坦明®治疗的已知安全特征相似。每日一次治疗期间舒坦明®组观察到的不良反应与赋形剂组相似(参见【临床试验】)。
上市后经验
在舒坦明®批准后使用期间,发现以下不良反应。由于这些不良反应由未知规模的人群自愿报告,因此无法可靠地估算这些不良反应的频率,也无法建立其与药物暴露之间的因果关系:
皮肤和皮下:过敏性接触性皮炎
舒坦明®禁用于已知对克立硼罗或该制剂任何成分过敏的患者。
超敏反应
曾有患者在接受舒坦明®治疗后出现超敏反应,包括接触性荨麻疹。当外用药部位或远处出现重度瘙痒、肿胀和红斑时,应怀疑超敏。如果出现超敏反应的体征和症状,应立即停用舒坦明®并进行适当的治疗。
妊娠
风险概要
现有的孕妇使用舒坦明®的病例报告数据不足以提供与药物相关的主要出生缺陷、流产或其他母体或胎儿不良结局风险的信息。在动物生殖研究中,在器官形成期间对怀孕大鼠和家兔分别经口给予相当于最大建议人用剂量(MRHD)的3倍和2倍的克立硼罗剂量时未观察到不良发育影响(参见数据)。
适用人群出现主要出生缺陷和流产的背景风险尚不明确。
数据
动物数据(参见【药理毒理】)
哺乳期
风险概要
目前还没有关于人乳中是否存在舒坦明®对母乳喂养婴儿的影响或局部应用该药对哺乳期妇女产乳的影响的资料。舒坦明®可被全身吸收。
目前缺乏哺乳期的临床数据,故无法确定舒坦明®对母乳喂养婴儿的风险。因此,应考虑母乳喂养的发育和健康益处,以及母亲对舒坦明®的临床需求和舒坦明®或母体基础疾病对母乳喂养婴儿的任何潜在不良影响。
已在3月龄及以上儿童患者中证明舒坦明®用于局部治疗轻至中度特应性皮炎的安全性和有效性。两项28天赋形剂对照的安全性和有效性试验(包括1313例2岁至17岁儿童受试者,其中接受舒坦明®治疗的874例)、一项28天开放性的安全性和药代动力学(PK)试验(包含137例3月龄至不足2岁的受试者接受舒坦明®治疗),以及另一项最长达8周的开放性试验(包含497例受试者,其中59例为中国受试者,327例5月龄至不足18岁的儿童受试者接受舒坦明® 治疗)的数据支持在该年龄组每日两次使用舒坦明®。另外一项中国和日本参与的28天赋形剂对照研究(包括140例2岁至17岁中国儿童受试者,其中90例接受舒坦明®治疗)支持在该年龄组每日两次使用舒坦明®。(参见【药代动力学】和【临床试验】)。
尚未确定舒坦明®在3月龄以下儿童患者中的安全性和疗效。
舒坦明®的临床研究未纳入足够数量的老年患者(满65岁),尚不能确定他们与年轻患者对本品的反应是否不同。
药物间相互作用研究
使用人肝微粒体进行的体外研究表明,在临床使用条件下,预计克立硼罗和代谢物1不抑制细胞色素P450(CYP)1A2、2B6、2C8、2C9、2C19、2D6和3A4。
代谢物2的体外人肝微粒体研究显示,其未抑制CYP2C19、2D6和3A4的活性;是CYP1A2和2B6的一种弱抑制剂;以及CYP2C8和2C9的一种中等抑制剂。最敏感的酶是CYP2C9,在临床试验中使用华法林作为CYP2C9的底物,对其进行了进一步研究。这项研究的结果没有显示药物间相互作用的潜在可能性。
在人肝细胞中进行的体外研究显示,在临床使用条件下,预计克立硼罗及代谢物1和2不会诱导CYP酶。
体外研究表明,克立硼罗与代谢物1并未抑制尿苷二磷酸(UDP)葡糖醛酸基转移酶(UGT)1A1、1A4、1A6、1A9、2B7和2B15的活性。代谢物2不抑制UGT1A4、1A6、2B7和2B15。代谢物2对UGT1A1存在弱抑制,但是,预计治疗浓度下的克立硼罗(及其代谢产物)与UGT1A1底物之间不会出现临床显著的药物间相互作用。代谢物2对UGT1A9存在中等抑制,可能造成UGT1A9敏感底物的浓度出现中等增加。
体外研究表明,在临床使用条件下,预计克立硼罗及其代谢物1和2与P-糖蛋白以及有机阴离子或阳离子转运蛋白之间,不产生临床显著的药物间相互作用。预计克立硼罗与代谢物1不抑制乳腺癌耐药蛋白(BCRP);预计治疗浓度下代谢物2抑制BCRP。
尚无药物过量的报道。
国外两项多中心、随机、双盲、平行组、赋形剂对照试验(试验1和2)共纳入1522例受试者,年龄为2至79岁(86.3%的受试者年龄在2至17岁之间),可治疗体表面积(BSA)为5%至95%。采用研究者静态整体评估量表(ISGA,以0-4分评价严重程度)对受试者的特应性皮炎(红斑、硬结/丘疹、渗出/结痂)进行评价,基线时,38.5%受试者的ISGA为轻度(2分),61.5%受试者的ISGA为中度(3分)。
在这两项试验中,受试者以2:1的比例随机分配接受舒坦明®或赋形剂,每日2次,共28天。主要疗效终点是比较舒坦明®治疗组和赋形剂治疗组第29天获得治疗成功的受试者比例,治疗成功定义为ISGA评级为清除(0分)或几乎清除(1分),且较基线有2级或更高的改善。
两项试验的疗效结果如表2所示。
表2:患有轻度至中度特应性皮炎的受试者在第29天的主要疗效结果
| 试验1 | 试验2 | |||
|---|---|---|---|---|
| 舒坦明® 每日两次 (N=503) | 赋形剂 每日两次 (N=256) | 舒坦明® 每日两次 (N=513) | 赋形剂 每日两次 (N=250) | |
| ISGA成功a | 32.8% | 25.4% | 31.4% | 18.0% |
a 定义为ISGA为清除(0)或几乎清除(1),且相对于基线至少改善2个等级。
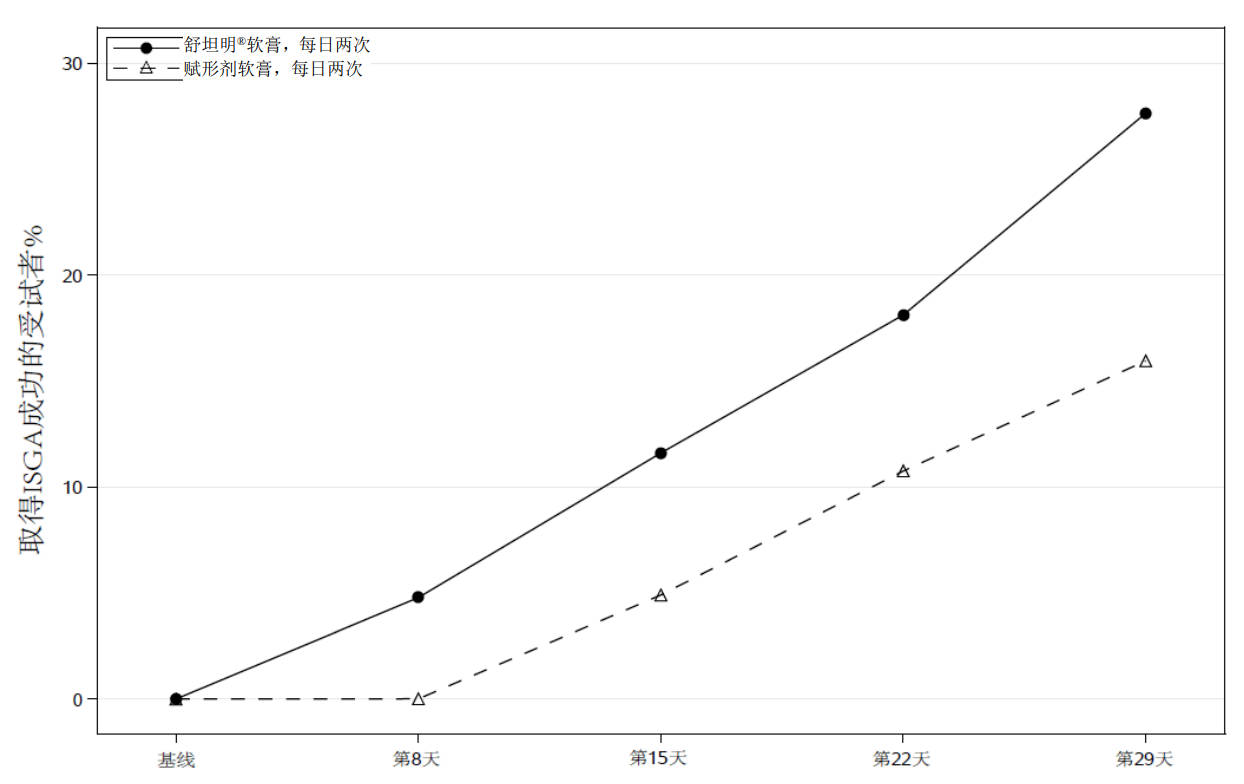
成功率随时间的变化见图1
图1:随着时间的推移,取得ISGA成功a的轻度至中度特应性皮炎患者比例
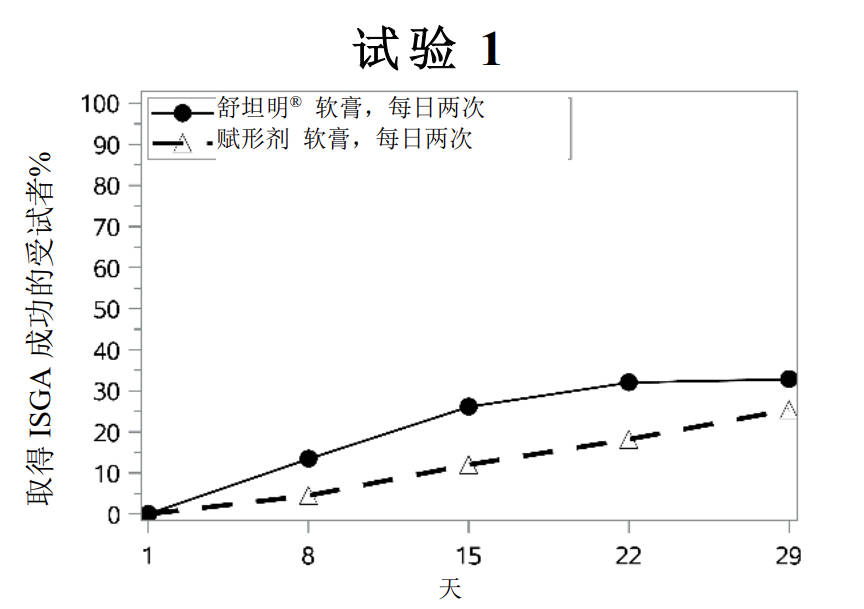
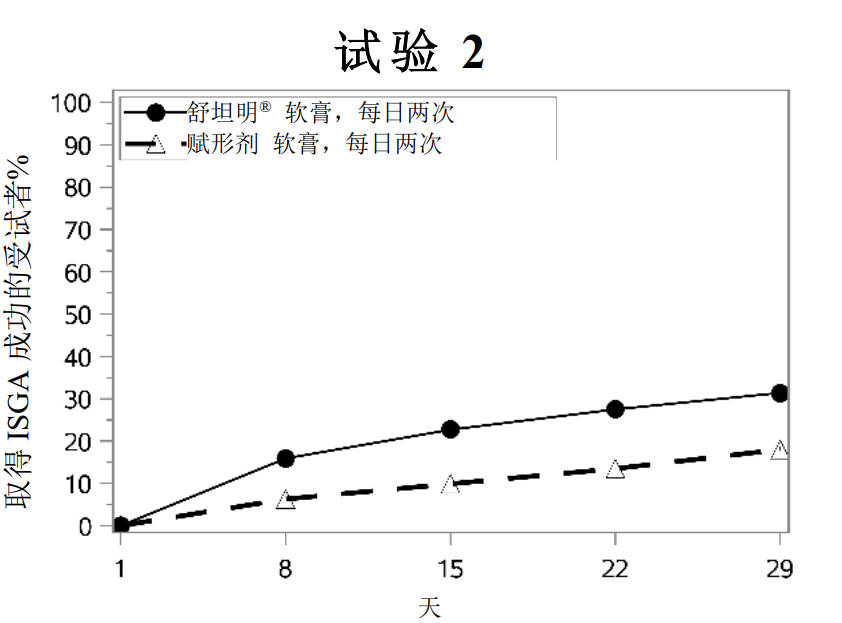
a 成功定义为ISGA评分为清除(0)或几乎清除(1),且相对于基线至少改善2个等级。
一项多中心、随机、双盲、赋形剂对照的III期临床试验(试验3)共纳入391例中国和日本受试者,年龄为2-71岁(59.3%的受试者年龄在2至17岁之间),可治疗BSA至少为5%(除外头皮),其中237例为中国受试者。采用湿疹面积和严重程度指数(EASI)对受试者的特应性皮炎(基于皮损临床表现和受累体表面积所占百分比,0-72分)进行评价,基线时受试者的EASI均值为10.36分。采用ISGA(0-4分评价严重程度)对受试者的特应性皮炎(红斑、硬结/丘疹、渗出/结痂)进行评价,基线时,42.5%受试者的ISGA评分为2分(轻度),57.5%受试者的ISGA评分为3分(中度)。
在这项试验中,受试者以2:1的比例随机分配接受舒坦明®或赋形剂每日2次治疗,共28天。主要疗效终点是第29天时EASI总分较基线的变化百分比,关键次要疗效终点是比较舒坦明®治疗组和赋形剂治疗组第29天获得治疗成功的受试者比例,治疗成功定义为ISGA评级为清除(0分)或几乎清除(1分),且较基线有2级或更高的改善。
试验的疗效结果如表3和表4所示。中国亚组人群和总体人群呈现出一致的疗效结果。
表3: 患有轻度至中度特应性皮炎的受试者在第29天的主要疗效结果
试验3 | ||
|---|---|---|
| 舒坦明® (N=260) | 赋形剂 (N=131) | |
| EASI总分较基线的变化百分比 | -59.92% | -42.79% |
表4: 患有轻度至中度特应性皮炎的受试者在第29天的关键次要疗效结果
试验3 | ||
|---|---|---|
| 舒坦明® (N=260) | 赋形剂 (N=131) | |
| ISGA成功a | 27.6% | 15.9% |
a 定义为ISGA评分为清除(0)或几乎清除(1),且相对于基线至少改善2个等级
EASI总分较基线的变化百分比和成功率随时间的变化见图2和图3。
图2:随着时间的推移,轻度至中度特应性皮炎患者EASI总分随时间较基线变化的百分比
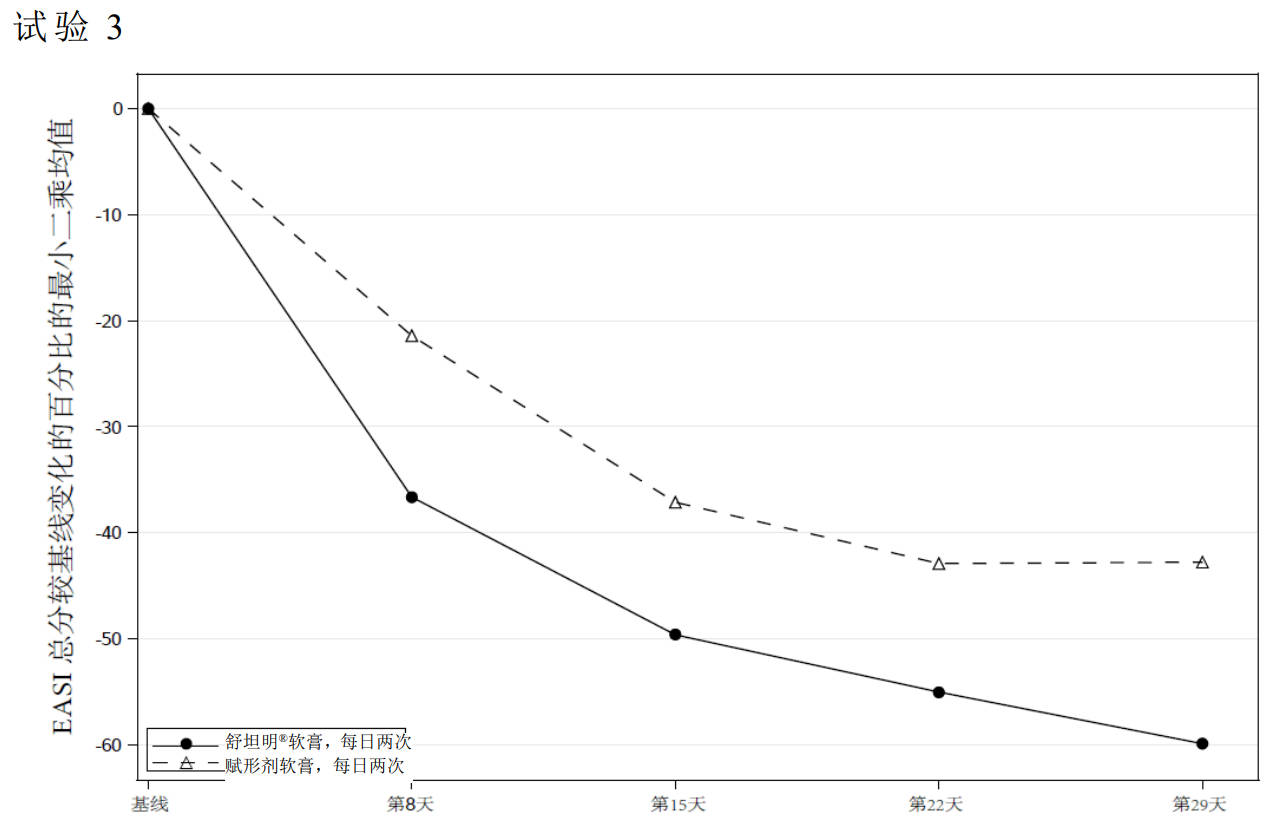
图3:随着时间的推移,取得ISGA成功a的轻度至中度特应性皮炎患者比例
试验3
a 定义为ISGA评分为清除(0)或几乎清除(1),且相对于基线至少改善2个等级
一项随机、双盲、赋形剂对照试验(试验4)在儿童(3月龄至不足18岁)和成人轻度至中度特应性皮炎受试者中评估了舒坦明®的疗效和安全性,每日一次持续52周,这些受试者曾接受最长达8周的舒坦明®每日两次开放性治疗并达到ISGA成功。
共计497例受试者进入开放性治疗期,年龄3月龄及以上且可治疗BSA为2%-90%,接受每日两次舒坦明®治疗,持续最长达8周。基线时,327例(66%)受试者为3月龄至不足18岁,特应性皮炎(红斑、硬结/丘疹、渗出/结痂)总体评估严重程度为0-4分,其中66%的受试者的ISGA为中度(3分),34%的受试者为轻度(2分)。
在497例受试者中,共有254例3月龄及以上达到ISGA治疗成功(评分为清除[0]或几乎清除[1],且较基线改善≥2级)和EASI-50缓解(EASI评分较基线改善至少50%)的受试者被纳入双盲期,1:1随机分组接受舒坦明®或赋形剂每日一次治疗,持续52周或至出现复发。在双盲期开始时,59%的受试者的ISGA为几乎清除(1),41%的受试者的ISGA为清除(0)。
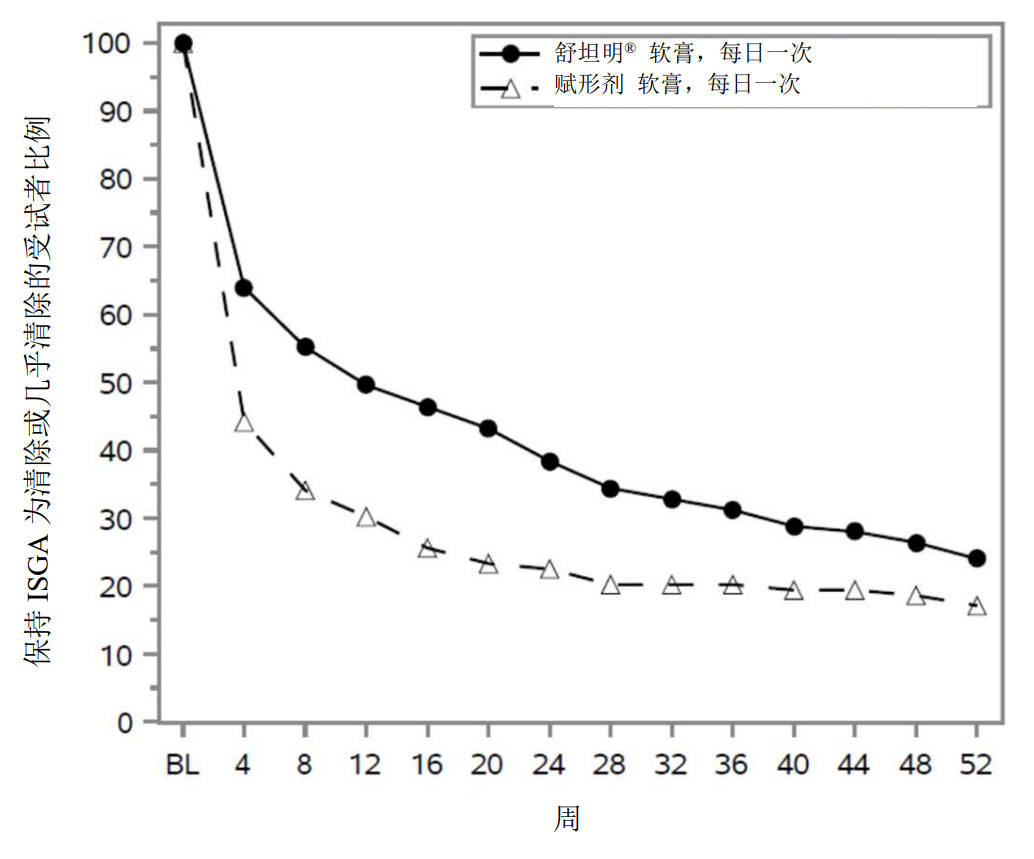
至第52周保持ISGA为清除或几乎清除的受试者百分比如图4所示。本研究有59例中国受试者被纳入开放性治疗期,其中30例进入双盲期,中国亚组人群和总体人群呈现出一致的疗效结果。
图4:至第52周保持ISGA为清除或几乎清除的受试者百分比
试验4
药理作用
克立硼罗是一种磷酸二酯酶4(PDE-4)抑制剂。PDE-4受抑制可导致细胞内环腺苷酸(cAMP)水平升高。克立硼罗治疗特应性皮炎的具体作用机制尚不明确。
毒理研究
遗传毒性
克立硼罗在Ames试验、人淋巴细胞体外染色体畸变试验和大鼠体内微核试验中结果均为阴性。
生殖毒性
在大鼠生育力和早期胚胎发育性试验中,经口给予克立硼罗达600mg/kg/天(以AUC计,约为临床最大推荐剂量[MRHD]的13倍),未见对雌、雄大鼠生育力的影响。
在大鼠胚胎-胎仔发育毒性试验中,妊娠大鼠于器官生成期经口给予克立硼罗300mg/kg/天(以AUC计,约为MRHD的3倍),未见对胎仔的不良影响;经口给予克立硼罗600mg/kg/天(以AUC计,约为MRHD的13倍),可见与母体毒性相关的胎仔体重下降和骨骼骨化延迟,未见与克立硼罗给药相关的胎仔畸形。妊娠兔于器官生成期经口给予克立硼罗达100mg/kg/天(以AUC计,约为MRHD的2倍),未见对胎仔的不良影响。
在围产期毒性试验中,大鼠自妊娠第7天至哺乳期第20天经口给予克立硼罗150、300和600mg/kg/天,在≤300mg/kg/天(以AUC计,约为MRHD的3倍)剂量下,对胎仔发育未见明显影响;在600mg/kg/天剂量下,可见与母体毒性相关的死胎、幼仔死亡和幼仔体重下降。
致癌性
在一项SD大鼠经口给药致癌性试验中,大鼠每天一次经口给予克立硼罗30、100和300mg/kg/天,在300mg/kg/天(以AUC计,约为MRHD的2倍)剂量组雌性大鼠中,可见与克立硼罗给药相关的子宫(包括子宫颈)和阴道(合并)良性颗粒细胞肿瘤发生率增加。尚不清楚该研究结果的临床相关性。
在CD-1小鼠皮肤给药致癌性试验中,每天一次局部涂抹2%、5%和7%的克立硼罗软膏(以AUC计,最高剂量约为MRHD的1倍),未见给药相关的肿瘤。
吸收
在33例2至17岁患有轻度至中度特应性皮炎且累及BSA(平均值±标准差(SD))为49%±20%(范围为27%至92%)的儿童受试者中,研究了舒坦明®软膏的PK。在该研究中,给受试者涂抹约3 mg/cm2的舒坦明®软膏(剂量范围为每次施用约6 g至30 g),每日2次,连续8天。
在所有受试者中血药浓度均可定量。第8天,克立硼罗的最大血浆浓度(Cmax)和给药后0至12小时的浓度时间曲线下面积(AUC0-12)(平均值±SD)分别为127±196 ng/mL和949±1240 ng∙h/mL。到第8天,克立硼罗的全身浓度达到稳态。基于第8天和第1天之间AUC0-12的比值,克立硼罗的平均累积因子为1.9。
在4月龄至不足24月龄的13例受试者中,开展对舒坦明®软膏的PK研究。克立硼罗的Cmax与AUC0-12的平均值±SD分别为188±100 ng/mL与1164±550 ng∙h/mL。
分布
基于体外研究,97%的克立硼罗与人血红蛋白结合。
消除
代谢
克立硼罗基本上代谢为无活性代谢物。主要代谢物5-(4-氰基苯氧基)-2-羟基苄醇(代谢物1)通过水解形成;该代谢物进一步代谢为下游代谢物,其中通过氧化形成的5-(4-氰基苯氧基)2-羟基苯甲酸(代谢物2)也是主要代谢物。
在上述PK研究中对代谢物1和2的PK进行评估,而且全身浓度到第8天达到稳态或接近稳态。基于第8天和第1天之间AUC0-12的比值,代谢物1和2的平均蓄积因子分别为1.7和6.3。
排泄
代谢物主要经肾脏排泄消除。
密封,25℃ 以下保存,不可冷冻
层压管。
2.5g/支,6支/盒
30g/支,1支/盒
60g/支,1支/盒
36个月
JX20200084
国药准字HJ20200022
名 称:Anacor Pharmaceuticals, LLC.
注册地址:66 Hudson Boulevard East, New York, NY 10001 United States of America
名称:Pharmacia and Upjohn Company LLC
生产地址:7000 Portage Road, Kalamazoo, MI 49001 United States of America
名称:辉瑞投资有限公司
地址:上海市南京西路1168号中信泰富广场36层
联系方式:400 910 0055
2020年07月29日
2020年11月24日;2021年02月07日;2021年03月15日;2021年09月18日;2023年06月26日;2023年08月01日;2023年11月02日;2024年03月27日;2025年07月01日;2026年01月01日