请仔细阅读说明书并在医师指导下使用
本品用于治疗成人转甲状腺素蛋白淀粉样变性多发性神经病 I 期症状患者,延缓周围神经功能损害。
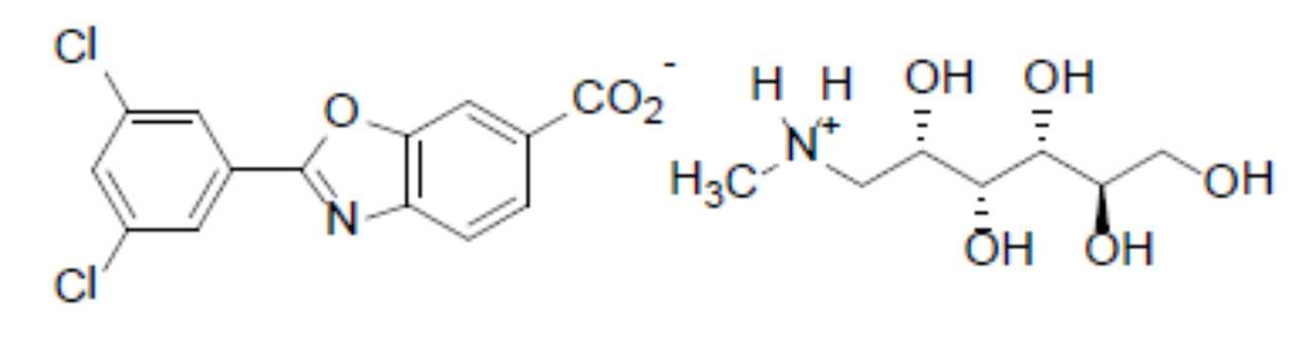
20 mg(按C14H7Cl2NO3·C7H17NO5计)
应由具有转甲状腺素蛋白淀粉样变性多发性神经病(ATTR-PN)患者治疗经验的医师启动治疗,并在其监督下进行。
用量
氯苯唑酸葡胺的推荐剂量为 20 mg,每日一次,口服。
氯苯唑酸和氯苯唑酸葡胺不能按 1 mg 互换。
如果在给药后发生呕吐,且呕吐物中含完整的氯苯唑酸葡胺胶囊,则应尽可能给再口服一粒氯苯唑酸葡胺胶囊。如果呕吐物不含有胶囊,则不需要额外服用药物,第二天继续照常量服药。
给药方法
口服用药。
软胶囊应整粒吞服,不能压碎或切碎,本品在空腹或餐后服用均可。
特殊人群
肝功能损害和肾功能损害
肾功能损害或轻度和中度肝功能损害患者无需调整剂量。关于重度肾功能损害(肌酐清除率小于或等于30 mL/min)患者的数据有限。尚未在重度肝功能损害患者中研究过氯苯唑酸葡胺,因此建议慎用(见【临床药理】)。
安全性特征汇总
总体临床数据反映了 127 名转甲状腺素蛋白淀粉样变性多发性神经病(ATTR-PN)患者每天服用20 mg氯苯唑酸葡胺,平均 538 天(范围 15 - 994 天)的暴露量。不良反应的严重程度通常为轻度或中度。
不良反应列表
不良反应按照 MedDRA 系统器官分类(SOC)和标准惯例频率列出:非常常见(≥1/10)、常见(≥1/100 - <1/10)和偶见(≥1/1,000 - <1/100)。在每个频率分组中,不良反应以严重性递减的次序排列。下表为 Ⅲ 期、双盲、安慰剂对照临床研究(Fx-005)中不良反应的发生率。
| 系统器官分类(SOC) | 非常常见 |
| 感染及侵染类疾病 | 尿路感染 |
| 胃肠系统疾病 | 腹泻 |
| 上腹痛 |
对活性成份或其中的任何辅料过敏者禁用。
有生育能力的女性应在接受氯苯唑酸葡胺期间使用适当的避孕措施,并在停止氯苯唑酸葡胺治疗后继续使用适当的避孕措施 1 个月(见【孕妇及哺乳期妇女用药】)。
氯苯唑酸葡胺应加入转甲状腺素蛋白淀粉样变性多发性神经病(ATTR-PN)患者的标准治疗中。作为标准治疗的一部分,医生应该监测患者并继续评估其他治疗的必要性,包括是否需要肝移植。由于目前没有关于在肝移植后使用氯苯唑酸葡胺的数据,因此接受肝移植的患者应停用氯苯唑酸葡胺。
每粒本品胶囊含不超过 44 mg 山梨糖醇。山梨糖醇是果糖的来源。
应考虑同时使用含山梨糖醇(或果糖)的产品与膳食摄入山梨糖醇(或果糖)的累加效应。
本品中的山梨糖醇成份可能会影响其他合并口服用药的生物利用度。
对驾驶和使用机器能力的影响
基于药效学和药代动力学特征,氯苯唑酸葡胺对驾驶或使用机器的能力没有影响或影响可忽略不计。
有生育能力的女性
由于本品半衰期长,在氯苯唑酸葡胺治疗期间以及停止治疗后一个月,有生育能力的女性应使用避孕措施。
妊娠
尚无妊娠女性使用本品的数据。动物研究表明本品有发育毒性(见【药理毒理】)。不建议妊娠期和有生育能力但未采取避孕措施的女性使用本品。
哺乳
动物研究的数据已经表明氯苯唑酸在乳汁中分泌。由于无法排除对新生儿/婴儿的风险,哺乳期应当禁用本品。
生育力
在非临床研究中未观察到生育能力损害(见【药理毒理】)。
尚未在儿童人群进行研究。
老年患者的使用数据非常有限。
老年患者(≥ 65岁)不需要调整剂量(见【临床药理】)。
在健康志愿者的临床研究中,氯苯唑酸葡胺 20 mg 对细胞色素 P450 酶 CYP3A4 无诱导或抑制作用。
体外氯苯唑酸葡胺抑制外排转运蛋白BCRP(乳腺癌耐药蛋白),IC50=1.16 µM,在临床相关浓度下可能与该转运蛋白的底物(例如甲氨蝶呤、瑞舒伐他汀、伊马替尼)发生药物相互作用。在一项健康受试者参与的临床研究中,以每日 61 mg 的剂量多次给药后,BCRP的底物瑞舒伐他汀的暴露量增加了约 2 倍。
同样,氯苯唑酸葡胺也抑制摄取转运体,有机阴离子转运体 1(OAT1)和 3(OAT3),IC50 分别为 2.9 µM 和2.36 µM,在临床相关浓度下可能与这些转运体的底物(例如非甾体类抗炎药、布美他尼、呋塞米、拉米夫定、甲氨蝶呤、奥司他韦、替诺福韦、更昔洛韦、阿德福韦、西多福韦、齐多夫定、扎西他滨)发生药物相互作用。根据体外数据,在氯苯唑酸葡胺 20 mg 给药时,OAT1 和 OAT3 底物AUC的最大预测变化小于 1.25,因此,氯苯唑酸对 OAT1 或 OAT3 转运蛋白的抑制预计不会产生有临床意义的相互作用。
尚未进行其他药品对氯苯唑酸葡胺影响的相互作用研究。
实验室检查异常
氯苯唑酸可能会降低总甲状腺素的血清浓度,但游离甲状腺素(T4)或促甲状腺激素(TSH)不会随之变化。在总甲状腺素值中观察到的此情况可能由甲状腺素与转甲状腺素蛋白(TTR)的结合力减弱或从 TTR 上被置换(因为氯苯唑酸具有与 TTR 甲状腺素受体结合的较高亲合力)导致。未观察到与甲状腺功能不全相一致的相应临床表现。
症状
关于药物过量方面的临床经验极为有限。在临床试验期间,两名经诊断患有转甲状腺素蛋白淀粉样变性心肌病(ATTR‑CM)的患者意外摄入了一剂 160 mg 氯苯唑酸葡胺,未发生任何相关不良事件。临床试验中健康志愿者接受氯苯唑酸葡胺给药的最高剂量为单剂量 480 mg。该剂量下报告了 1 例轻度睑腺炎的治疗相关不良事件。
治疗
一旦发生药物过量,应按要求给予标准支持治疗。
吸收
氯苯唑酸葡胺软胶囊在空腹状态下每日一次口服给药后,中位达峰时间(tmax)4 小时内达到最高峰浓度(Cmax)。与高脂、高热量餐一起给药降低了吸收速率,但未影响吸收程度。这些结果支持氯苯唑酸在空腹或餐后给药。
分布
氯苯唑酸与血浆蛋白高度结合(>99%)。表观稳态分布容积为 16 L。
使用动物和人血浆对氯苯唑酸与血浆蛋白的结合程度进行了评估。氯苯唑酸对TTR的亲和力高于其对白蛋白的亲和力。因此,在血浆中,尽管白蛋白的浓度(600 μM)显著高于TTR浓度(3.6 μM),氯苯唑酸更可能优先结合 TTR。
生物转化和消除
没有明确证据表明在人体中氯苯唑酸经胆汁排泄。根据临床前数据,提示氯苯唑酸通过葡萄糖醛酸化代谢,并通过胆汁排泄。这种生物转化途径在人体中是合理的,因为约59%的总给药剂量在粪便中回收,约22%在尿液中回收。根据群体药代动力学结果,氯苯唑酸葡胺的表观口服清除率为0.228 L/h,群体平均半衰期约为49小时。
剂量和时间线性
每日一次氯苯唑酸葡胺的暴露量随剂量增加而增加(单剂量最高480 mg,多剂量最高80 mg/天)。通常,暴露量增加与剂量成正比或接近正比,氯苯唑酸清除率随时间推移呈平衡状态。
氯苯唑酸葡胺20 mg单剂量和重复给药后药代动力学参数相似,表明多剂量给药未诱导或抑制氯苯唑酸的代谢。
氯苯唑酸葡胺口服溶液15 mg至60 mg每日一次给药14天的结果显示,在第14天达到稳态。
特殊人群
肝功能损害
药代动力学数据表明与健康受试者相比,中度肝功能损害(Child-Pugh评分为7-9)患者中氯苯唑酸葡胺的全身暴露降低(约40%),总清除率增加(0.52 L/h vs. 0.31 L/h),这是由于氯苯唑酸在中度肝功能损害患者中的未结合部分更高。由于中度肝功能损害患者的TTR水平比健康受试者低,氯苯唑酸与其靶蛋白TTR的化学计量足以稳定TTR四聚体,因此不需要调整剂量。重度肝功能损害患者中氯苯唑酸的暴露量未知。
肾功能损害
尚未在肾功能损害患者中评估过氯苯唑酸,在肌酐清除率大于18 mL/min的患者中,通过群体药代动力学分析评估了肌酐清除率对氯苯唑酸药代动力学的影响。药代动力学评估表明,肌酐清除率小于80 mL/min的患者与肌酐清除率大于或等于80 mL/min的患者相比,氯苯唑酸表观口服清除率无差异。因此认为肾功能损害患者无需剂量调整。
老年人
根据群体药代动力学结果,与65岁以下的受试者相比,65岁及以上的受试者稳态表观口服清除率的估计值平均降低15%。然而,与较年轻受试者相比的这种清除率差异导致平均Cmax和AUC增加<20%,无临床意义。
药代动力学/药效学关系
体外数据表明,氯苯唑酸不会显著抑制细胞色素P450酶CYP1A2、CYP3A4、CYP3A5、CYP2B6、CYP2C8、CYP2C9、CYP2C19和CYP2D6。氯苯唑酸预计不会因诱CYP1A2、CYP2B6或CYP3A4而导致临床相关的药物间相互作用。
体外研究表明,氯苯唑酸在临床相关浓度下不太可能与UDP葡萄糖醛酸基转移酶(UGT)的底物发生全身性药物间相互作用。氯苯唑酸可能抑制UGT1A1的肠道活性。
在临床相关浓度下,氯苯唑酸全身性抑制多药耐药蛋白(MDR1)(也称为P糖蛋白、P-gp)以及在胃肠道(GI)中抑制有机阳离子转运蛋白2(OCT2)、多药和毒素外排蛋白1(MATE1)和MATE2K、有机阴离子转运多肽1B1(OATP1B1)及OATP1B3的可能性较低。
临床疗效和安全性
氯苯唑酸葡胺用于I期转甲状腺素蛋白淀粉样变性多发性神经病(ATTR-PN)患者的关键研究是一项18个月、多中心、随机、双盲、安慰剂对照研究。该研究在128名携带Val30Met突变且主要是Ⅰ期疾病的 ATTR-PN患者(128名患者中有126名不需要辅助行走)中评估20 mg氯苯唑酸葡胺每日一次给药的安全性和疗效。主要终点指标是下肢神经病变损伤评分(NIS-LL – 医生对下肢神经系统检查的评估)和诺福克生活质量 - 糖尿病神经病变(Norfolk QOL-DN – 患者报告结果,总生活质量评分[TQOL])。其他终点指标包括大神经纤维功能(神经传导、振动阈值和心率对深呼吸的反应 - HRDB)、小神经纤维功能(热痛和冷阈值及HRDB)综合评分和利用改良的体重指数(mBMI - BMI乘以血清白蛋白[单位为g/L])进行的营养评估。完成18个月治疗期的91名患者中86名患者随后入组开放标签扩展研究,接受延长期12个月的每日一次20 mg氯苯唑酸葡胺治疗。
治疗18个月后,更多接受氯苯唑酸葡胺的患者出现NIS-LL应答(NIS-LL变化小于2分),下表提供了主要终点的结果(预先指定分析):
| 氯苯唑酸葡胺相比安慰剂:第18个月时NIS-LL和TQOL(研究Fx-005) | ||
| 安慰剂 | Vyndaqel | |
| 预先指定的ITT分析 | N=61 | N=64 |
| NIS-LL应答者(%患者) 差异(氯苯唑酸葡胺减去安慰剂) 差异的95% CI(p值) | 29.5% | 45.3% |
| 15.8% -0.9%, 32.5% (0.068) | ||
| TQOL相对于基线的变化LS平均值(SE) LS平均值(SE)的差异 差异的95% CI(p值) | 7.2 (2.36) | 2.0 (2.31) |
| -5.2 (3.31) -11.8, 1.3 (0.116) | ||
| 预先指定的疗效可评价分析 | N=42 | N=45 |
| NIS-LL应答者(%患者) 差异(氯苯唑酸葡胺减去安慰剂) 差异的95% CI(p值) | 38.1% | 60.0% |
| 21.9% 1.4%, 42.4% (0.041) | ||
| TQOL相对于基线的变化LS平均值(SE) LS平均值(SE)的差异 差异的95% CI(p值) | 8.9 (3.08) | 0.1 (2.98) |
| -8.8 (4.32) -17.4, -0.2 (0.045) | ||
| 在预先指定的ITT NIS-LL应答者分析中,因肝移植而在18个月时间点之前停药的患者归类为无应答者。使用根据方案完成18个月治疗的患者的观察数据进行预先指定的疗效可评价分析。 | ||
次要终点证明氯苯唑酸葡胺治疗与安慰剂相比,减少神经功能恶化并改善营养状况(mBMI)。
如下表所示。
| 第18个月次要终点相对于基线的变化,LS平均值(标准误)(ITT)(研究Fx-005) | ||||
| 安慰剂 N=61 | 氯苯唑酸葡胺 N=64 | P值 | 氯苯唑酸葡胺相对于安慰剂的变化% | |
| NIS-LL相对于基线的变化 LS平均值(SE) | 5.8 (0.96) | 2.8 (0.95) | 0.027 | -52% |
| 大纤维相对于基线的变化 LS平均值(SE) | 3.2 (0.63) | 1.5 (0.62) | 0.066 | -53% |
| 小纤维相对于基线的变化 LS平均值(SE) | 1.6 (0.32) | 0.3 (0.31) | 0.005 | -81% |
| mBMI相对于基线的变化 LS平均值(SE) | -33.8 (11.8) | 39.3 (11.5) | <0.0001 | NA |
| mBMI由血清白蛋白乘以体重指数得出。 | ||||
| NA=不适用 基于重复测量方差分析,模型中较基线变化为因变量,固定效应因素包括治疗组、访视月份、治疗组和访视月份的相互作用,受试者为随机效应,采用非结构化协方差矩阵。 | ||||
在开放标签扩展研究中,治疗12个月期间NIS-LL的变化率与在之前的双盲18个月期间接受氯苯唑酸治疗的患者相似。
在21名患者的一项支持性开放标签研究和39名患者的一项上市后观察性研究中评估了氯苯唑酸在非 Val30Met 的ATTR-PN 患者中的疗效。基于这些研究的试验结果,氯苯唑酸的作用机制和TTR稳定化的结果,氯苯唑酸葡胺预计对非Val30Met突变导致的Ⅰ期ATTR-PN患者有益。
一项在441例野生型或遗传性转甲状腺素蛋白淀粉样变性心肌病(ATTR-CM)患者中开展的双盲、安慰剂对照、随机3组研究评估了氯苯唑酸的作用。对氯苯唑酸葡胺(20 mg和80 mg)与安慰剂的初步汇总分析显示,氯苯唑酸葡胺的全因死亡率和心血管相关的住院率均显著降低(p=0.0006)。
在健康志愿者中,超治疗剂量(400 mg)的氯苯唑酸葡胺溶液单剂量口服给药显示QTc间期未延长。
药理作用
氯苯唑酸为转甲状腺素蛋白(TTR)的选择性稳定剂。氯苯唑酸在甲状腺素结合位点与TTR结合,稳定四聚体并减缓其解离成单体(其为淀粉样蛋白形成过程的限速步骤)。
毒理研究
遗传毒性
氯苯唑酸葡胺Ames试验、体外人外周血淋巴细胞染色体畸变试验、大鼠体内骨髓微核试验结果为阴性。
生殖毒性
大鼠经口给予氯苯唑酸葡胺15、30、45 mg/kg/天,雄性大鼠于交配前28天至交配期间,雌性大鼠于交配前15天至妊娠第 7 天给药,未见亲代大鼠毒性,未见对生育力、生殖功能或交配行为的影响,未见不良影响剂量为30 mg/kg/天[以体表面积计,相当于人(TTR淀粉样变性多发性神经病患者)推荐剂量20 mg/天的15倍]。
妊娠SD大鼠于器官发生期经口给予氯苯唑酸葡胺15、30、45 mg/kg/天,剂量≥30 mg/kg/天(以AUC计,约相当于人推荐剂量20 mg/天时暴露量的32倍)时可致胎仔体重降低,大鼠胚胎/胎仔发育的NOAEL为15 mg/kg/天(以AUC计,约相当于人推荐剂量20 mg/天时暴露量的22倍)。
妊娠兔于器官发生期经口给予氯苯唑酸葡胺0.5、2、8 mg/kg/天,8 mg/kg/天(以AUC计,约相当于人推荐剂量20 mg/天时暴露量的31倍)剂量可导致胚胎/胎仔死亡率升高、胎仔体重降低和胎仔畸形发生率升高,该剂量也可见母体毒性;≥0.5 mg/kg/天(以AUC计,约相当于人推荐剂量20 mg/天时暴露量的3倍)剂量可致胎仔骨骼变异发生率升高。
大鼠围产期发育毒性试验中,妊娠大鼠于妊娠第7天至哺乳期第20天经口给予氯苯唑酸葡胺5、15、30 mg/kg/天,15 mg/kg/天剂量(以体表面积计,约相当于人推荐剂量20 mg/天的7倍)时观察到子代存活率降低和体重下降、雄性性成熟延迟和神经行为影响(学习和记忆障碍)。大鼠围产期发育的NOAEL为5 mg/kg/天(以体表面积计,约相当于人推荐剂量20 mg/天的2.5倍)。
致癌性
转基因Tg.rasH2小鼠连续26周经口给予氯苯唑酸葡胺10、30、90 mg/kg/天,未见肿瘤发生率增加。大鼠经口给药2年致癌性试验中,最高剂量为30 mg/kg/天(以AUC计,相当于人推荐剂量20 mg/天时暴露量的61倍),未见肿瘤发生率增加。
在25°C 以下密封保存。
铝塑泡罩包装(泡罩材料:PVC/铝箔/oPA/PVC;盖板材料:铝箔/PET/纸)。
包装规格:30粒/盒
24个月
进口药品注册标准:JX20190246
国药准字HJ20200001
名 称:Pfizer Europe MA EEIG
注册地址:Boulevard de la Plaine 17, 1050 Bruxelles, Belgium
企业名称:Catalent Pharma Solutions, LLC
生产地址:2725 Scherer Drive, St Petersburg, FL 33716, USA
包装企业(初级包装厂):AndersonBrecon, Inc.
包装地址:4545 Assembly Drive, Rockford,IL 61109, USA
包装企业(次级包装厂):AndersonBrecon (UK) Limited
包装地址:Units 2-7, Wye Valley Business Park, Brecon Road, Hay-on-Wye, Hereford, Herefordshire, HR3 5PG, United Kingdom
名 称:辉瑞投资有限公司
地 址:上海市南京西路1168号中信泰富广场36层
联系方式:400 910 0055
2020年02月05日
2020年12月01日,2020年12月03日,2022年1月27日,2023年7月19日,2024年03月06日,2024年06月28日,2025年07月01日