简要介绍
前列腺癌
1. J Clin Oncol:大分割剂量递增放疗对比常规分割放疗治疗局限性前列腺癌:一项III期前瞻性随机对照试验的长期更新
2. Ann Oncol:循环脂质谱PCPro与转移性去势敏感性前列腺癌临床结局的关联:ENZAMET III期随机试验(ANZUP 1304)的事后分析
3. Ann Oncol:高瘤负荷与低瘤负荷转移性去势敏感性前列腺癌中BRCA1/2及同源重组修复基因变异:发生率及对结局的影响
4. Ann Oncol:恩扎卢胺联合镭-223治疗转移性去势抵抗性前列腺癌:EORTC 1333/PEACE-3试验结果
5. Lancet Oncol:[177Lu]Lu-PSMA-617治疗进展性转移性去势抵抗性前列腺癌的健康相关生活质量、疼痛及症状性骨骼事件:PSMAfore开放标签随机III期试验
6. Eur Urol:前列腺特异性膜抗原正电子发射断层扫描在根治性治疗后前列腺癌生化复发患者局部复发和远处转移评估中的作用:系统综述与Meta分析
7. J Clin Oncol:镭-223联合立体定向消融放疗对比单纯立体定向消融放疗治疗寡转移性前列腺癌:RAVENS II期随机试验
肾癌
8. Nat Cancer:原位工程化嵌合IL-2受体增强促炎CAR巨噬细胞在肾细胞癌中的杀瘤活性
尿路上皮癌
9. Ann Oncol:阿维鲁单抗联合Sacituzumab Govitecan对比阿维鲁单抗单药作为晚期尿路上皮癌一线维持治疗:JAVELIN Bladder Medley中期分析
10. Ann Oncol:恩福妥昔单抗联合帕博利珠单抗治疗未经治疗的局部晚期或转移性尿路上皮癌:III期EV-302/KEYNOTE-A39试验2.5年中位随访结果
前列腺癌
1.大分割剂量递增放疗对比常规分割放疗治疗局限性前列腺癌:一项III期前瞻性随机对照试验的长期更新
发表期刊:J Clin Oncol
MD安德森癌症中心的剂量递增大分割前列腺放疗研究是一项III期随机试验,比较了常规分割调强放疗(CIMRT,75.6 Gy,1.8 Gy/次)与剂量递增型大分割调强放疗(HIMRT,72 Gy,2.4 Gy/次)在局限性前列腺癌(主要为低危和中危疾病)患者中的疗效。初始研究显示HIMRT组的治疗失败率在统计学上显著更低。我们在此呈现13年长期随访结果,以确定癌症控制获益是否持续,并事后评估远处转移情况。中位随访13.2年(IQR:8.8-15.9年),HIMRT组治疗失败例数(n=13)少于CIMRT组(n=22),但差异不再具有统计学意义(P=0.08)。远处转移罕见,两组无统计学差异(P=0.2)。晚期胃肠道≥2级毒性(10年发生率:HIMRT组10% vs CIMRT组4%,P=0.09)和泌尿生殖系统≥2级毒性(10年发生率:26% vs 23%,P=0.5)亦无显著差异。
2. 循环脂质谱PCPro与转移性去势敏感性前列腺癌临床结局的关联:ENZAMET III期随机试验(ANZUP 1304)的事后分析
发表期刊:Ann Oncol
背景:恩扎卢胺显著改善转移性去势敏感性前列腺癌(mHSPC)患者的总生存期(OS),但约10%患者会在2年内死亡。PCPro是一种血浆脂质谱,与转移性去势抵抗性前列腺癌(mCRPC)的OS缩短相关。本研究通过对ENZAMET试验(比较恩扎卢胺与非甾体类抗雄激素药物[NSAA]的里程碑III期试验)进行事后分析,评估PCPro与mHSPC临床结局的关联。
患者与方法:通过液相色谱-质谱法分析866例参与者(占ENZAMET队列的77%)治疗前(n=866)和首次进展时(n=282)的血浆样本,确定PCPro状态。研究结局为OS和临床无进展生存期(clinPFS)。
结果:基线PCPro阳性患者(13.4%)的OS(见图1)和clinPFS显著短于阴性患者(OS HR=1.81;clinPFS HR=1.65;p<0.0001)。与关键临床预后因素联合建模时,PCPro是独立预后因子(p<0.001)。恩扎卢胺(对比NSAA)改善了PCPro阴性患者的OS(HR=0.61,p<0.0001),但未改善PCPro阳性患者的生存(HR=1.10,p=0.69;交互作用p=0.024)。无论基线状态如何,进展时PCPro阳性患者的OS短于阴性患者(中位OS:24-28个月 vs 42-45个月)。
结论:PCPro状态是mHSPC的预后生物标志物,可预测恩扎卢胺对比NSAA无OS获益。这些发现为测试可调节循环脂质谱的治疗药物提供了理论依据。
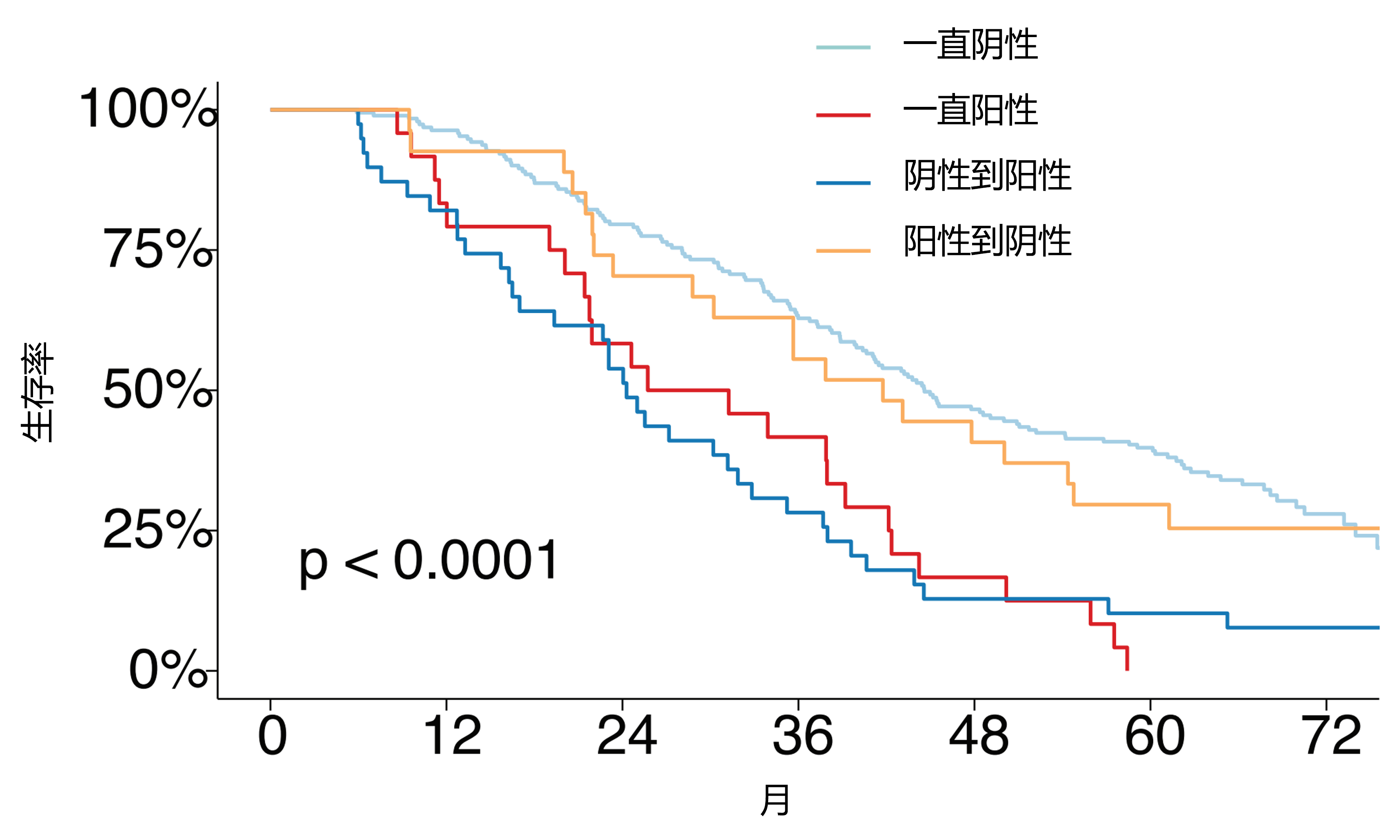
图1.不同基线到进展PCPro水平患者的生存
3. 高瘤负荷与低瘤负荷转移性去势敏感性前列腺癌中BRCA1/2及同源重组修复基因变异:发生率及对结局的影响
发表期刊:Ann Oncol
背景:BRCA1/2(BRCA)和其他同源重组修复(HRR)基因变异对转移性去势抵抗性前列腺癌(mCRPC)患者的结局有不良影响。聚腺苷二磷酸核糖聚合酶抑制剂被证实可改善BRCA /HRR突变mCRPC患者预后,现也在开发用于转移性去势敏感性前列腺癌(mHSPC)。为充分评估其在此场景中的潜在获益,必须了解BRCA和HRR缺陷如何影响常规治疗的低瘤负荷和高瘤负荷疾病患者的预后。
患者与方法:2018年1月至2023年12月期间诊断的合格mHSPC患者接受配对的体系/胚系DNA测序。将≥1个HRR基因变异的病例分为BRCA、HRR非BRCA。报告所有亚组的影像学无进展生存期、去势抵抗时间和总生存期;使用治疗权重逆概率模型控制治疗方式和基线特征后,评估突变与结局的关联。
结果:556例患者中,159例(28.6%)存在HRR基因变异:69例(12.4%)为BRCA变异,90例(16.2%)为HRR非BRCA变异。451例(81.1%)mHSPC为同步转移,306例(55%)按CHAARTED标准分类为高瘤负荷疾病。HRR亚组中,BRCA变异患者的所有终点结局均显著更差(所有比较P<0.005)。BRCA和HRR状态的预后差异在低瘤负荷和高瘤负荷亚组中均可见,且独立于雄激素受体通路抑制剂或紫杉类药物治疗。
结论:HRR突变(尤其是BRCA变异)显著恶化预后,与疾病负荷或治疗方案无关。这些发现强调了整合肿瘤生物学以实现mHSPC准确风险分层及设计新治疗策略和随访方案的重要性。
4. 恩扎卢胺联合镭-223治疗转移性去势抵抗性前列腺癌:EORTC 1333/PEACE-3试验结果
发表期刊:Ann Oncol
背景:EORTC 1333“PEACE-3”研究探讨了恩扎卢胺联合每6个月注射一次镭-223(Ra223)在伴骨转移的转移性去势抵抗性前列腺癌(mCRPC)患者中的应用。
材料与方法:2015年11月至2023年3月,446例患者(包括11例接受阿比特龙的患者)随机分配至恩扎卢胺单药组(无安慰剂)或恩扎卢胺联合6周期Ra223组。自2018年3月起,强制联合唑来膦酸或地舒单抗。主要终点为研究者评估的影像学无进展生存期(rPFS),关键次要终点包括总生存期(OS)、后续系统治疗时间、疼痛进展和症状性骨骼事件。
结果:rPFS风险比(HR)为0.69[95%置信区间(CI)0.54-0.87,P=0.0009],恩扎卢胺组中位rPFS为16.4个月(95% CI 13.8-19.2个月),联合组为19.4个月(95% CI 17.1-25.3个月)。如图2,在计划的OS事件80%时进行的中期分析中,OS HR为0.69(95% CI 0.52-0.90,P=0.0031),恩扎卢胺组中位OS为35.0个月(95% CI 28.8-38.9个月),联合组为42.3个月(95% CI 36.8-49.1个月)。由于风险比例不恒定,将在最终OS分析中进一步检验。治疗期间不良事件(TEAEs)≥3级发生率在恩扎卢胺组和联合组分别为55.8%和65.6%。联合组最常见的≥3级TEAEs为高血压(34%)、疲劳(6%)、骨折(5%)、贫血(5%)和中性粒细胞减少(5%)。恩扎卢胺组和联合组报告的骨折(无论治疗期间或治疗后、症状性或病理性、是否使用骨保护剂)分别为30例(13.4%)和53例(24.3%)。
结论:PEACE-3试验显示,恩扎卢胺联合Ra223作为mCRPC一线治疗可显著改善rPFS。尽管OS中期分析达到统计学显著边界,但研究将持续至最终OS分析。
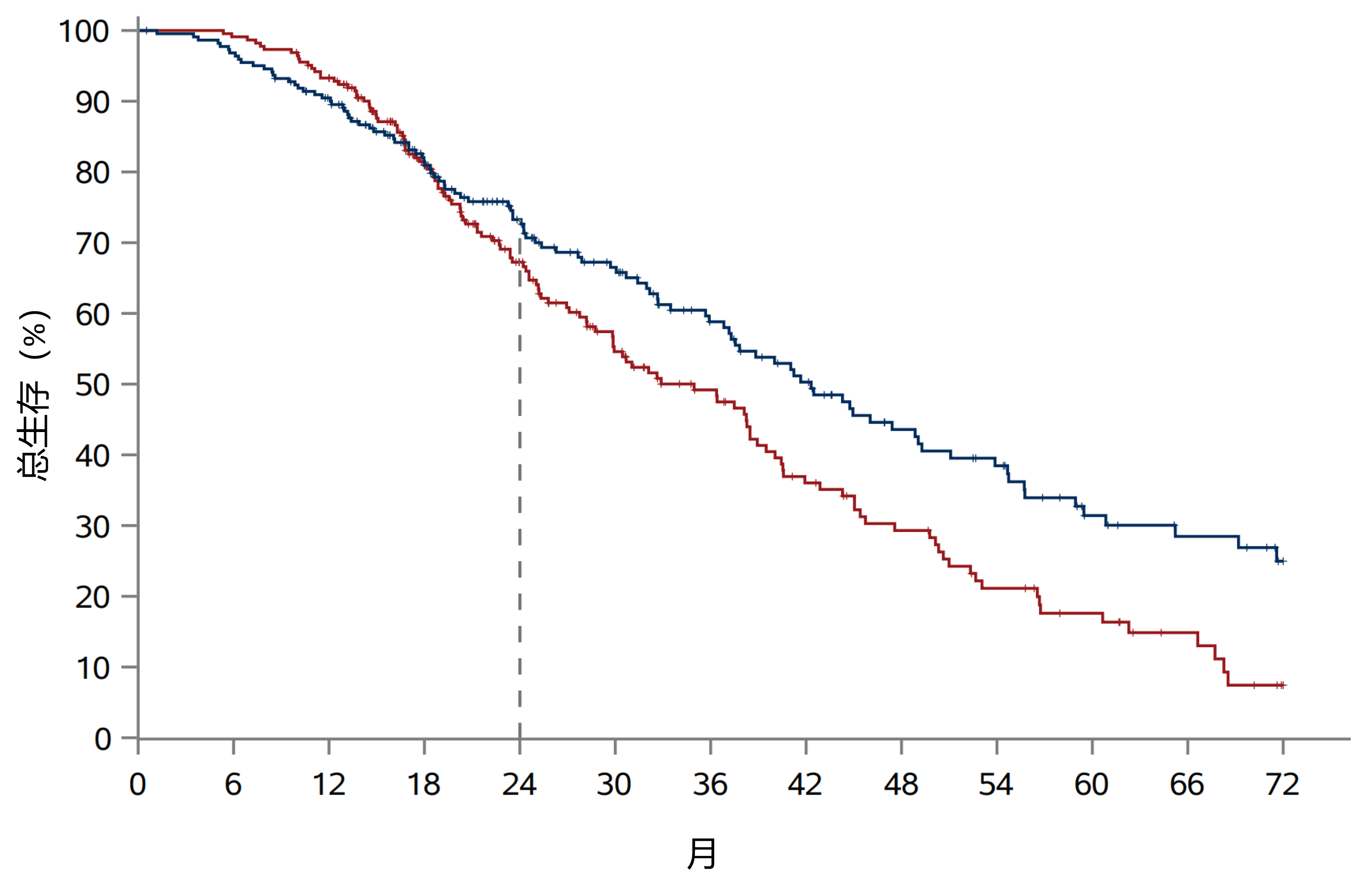
图2.意向治疗人群的总生存
5. [177Lu]Lu-PSMA-617治疗进展性转移性去势抵抗性前列腺癌的健康相关生活质量、疼痛及症状性骨骼事件:PSMAfore开放标签随机III期试验
发表期刊:Lancet Oncol
背景:在PSMAfore研究中,对于未接受过紫杉类治疗且前列腺特异性膜抗原(PSMA)阳性的转移性去势抵抗性前列腺癌患者,镥-177[¹⁷⁷Lu]Lu-PSMA-617(vipivotide tetraxetan)对比更换雄激素受体通路抑制剂(ARPI)显著改善了影像学无进展生存期。本文深入分析健康相关生活质量(HRQOL)和疼痛恶化时间,以及首次症状性骨骼事件时间。
方法:PSMAfore是一项开放标签随机III期试验,在14个国家的74个研究中心(包括设有核医学科的医院和招募患者的研究机构)开展。符合条件的患者为转移性去势抵抗性前列腺癌,在既往ARPI治疗进展后适合更换ARPI,经镓-68[⁶⁸Ga]Ga-PSMA-11 PET-CT证实至少有1个PSMA阳性且无排除性PSMA阴性转移灶,年龄≥18岁,东部肿瘤协作组体能状态0-1分。患者按1:1随机分配至[¹⁷⁷Lu]Lu-PSMA-617组(7.4GBq,每6周1次,共6周期)或更换ARPI组(口服阿比特龙或恩扎卢胺)。主要终点为影像学无进展生存期,次要终点包括自我报告的HRQOL(使用癌症治疗功能评估-前列腺量表[FACT-P]和EQ-5D-5L评估)和疼痛(使用简明疼痛Inventory-Short Form [BPI-SF]评估)恶化时间,以及首次症状性骨骼事件时间。所有分析均按意向治疗原则进行。研究已达到影像学无进展生存期主要终点(先前已报告),总生存期随访仍在进行;本分析来自总生存期第三次中期分析。本试验在ClinicalTrials.gov注册,NCT04689828。
结果:2021年6月15日至2022年10月7日,468例患者(426例[91%]为白人,12例[3%]为黑人或非裔美国人)随机分配至[¹⁷⁷Lu] Lu-PSMA-617组(n=234)或更换ARPI组(n=234)。从随机化至第三次中期分析数据截止日期(2024年2月27日)的中位随访时间在[¹⁷⁷Lu] Lu-PSMA-617组为24.11个月(IQR 20.24-27.60),更换ARPI组为24.13个月(20.24-27.37)。与更换ARPI相比,[¹⁷⁷Lu] Lu-PSMA-617延迟了所有评估的FACT-P、EQ-5D-5L和BPI-SF量表及子量表的恶化时间。[¹⁷⁷Lu]Lu-PSMA-617组与更换ARPI组的FACT-P总分中位恶化时间分别为7.46个月(95% CI 6.08-8.54) vs 4.27个月(3.45-4.50;风险比[HR]0.61 [95% CI 0.50-0.75])(见图3),EQ-5D-5L效用评分中位恶化时间为6.28个月(4.70-7.89)vs 3.88个月(3.25-4.44;0.67 [0.54-0.82]),BPI-SF疼痛强度中位恶化时间为5.03个月(4.40-6.80) vs 3.65个月(3.09-4.37;0.72 [0.59-0.88])。[¹⁷⁷Lu] Lu-PSMA-617还延迟了症状性骨骼事件发生:[¹⁷⁷Lu] Lu-PSMA-617组首次症状性骨骼事件中位时间未达到(95% CI不可估计[NE]-NE),更换ARPI组为17.97个月(14.26-NE;HR 0.41 [0.26-0.63])。最常见的≥3级治疗期间出现的不良事件为贫血([¹⁷⁷Lu] Lu-PSMA-617组227例中14例[6%] vs 更换ARPI组232例中16例[7%])。[¹⁷⁷Lu] Lu-PSMA-617组无治疗相关死亡,更换ARPI组有1例(脑血管意外)。
解释:对于未接受过紫杉类治疗且既往ARPI治疗进展的PSMA阳性转移性去势抵抗性前列腺癌患者,[¹⁷⁷Lu] Lu-PSMA-617对比更换ARPI可能延迟患者报告结局的恶化并预防症状性骨骼事件。
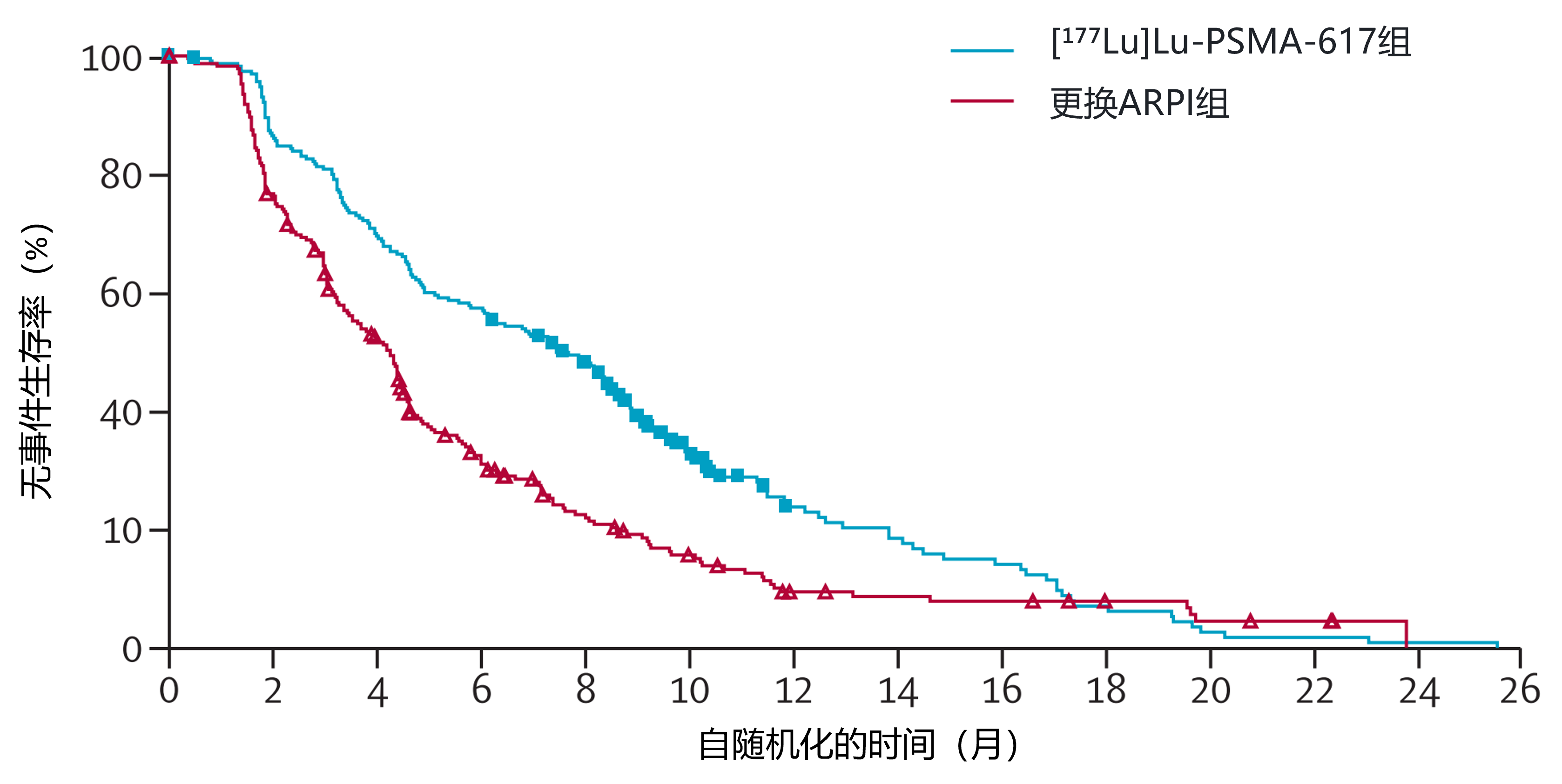
图3.[¹⁷⁷Lu]Lu-PSMA-617组与更换ARPI组的FACT-P总分中位恶化时间
6. 前列腺特异性膜抗原正电子发射断层扫描在根治性治疗后前列腺癌生化复发患者局部复发和远处转移评估中的作用:系统综述与Meta分析
发表期刊:Eur Urol
背景与目的:前列腺特异性膜抗原(PSMA)放射性配体正电子发射断层扫描(PET)在前列腺癌(PC)初始治疗后复发评估中已确立作用。然而,鉴于复发性PC新兴靶向和系统治疗方案的出现,需更新其诊断效用的认识。我们的目的是评估PSMA PET在PC根治性治疗后生化复发(BCR)患者中分期及检测局部或转移病灶的诊断性能。
方法:我们进行了系统综述(Web of Science/MEDLINE、Cochrane Library和EMBASE,从建库至2024年4月25日)和Meta分析。符合条件的回顾性和前瞻性研究需包含PSMA PET在根治性前列腺切除术(RP)或放疗(RT)后BCR患者中的可提取数据。使用QUADAS-2工具评估偏倚风险。采用随机效应模型评估按PSA、初始治疗、PSMA PET放射性配体和解剖病灶部位分层的临床亚组中PSMA PET阳性率。
关键发现与局限性:共纳入43项研究(8119例患者)。根治性治疗后BCR患者的PSMA PET阳性率差异显著,研究异质性大(τ’>0.6;p<0.001),按PSA类别分层后部分缓解。RT后阳性率(92%)显著高于RP后(60%;p<0.001)。按解剖部位,PSMA PET阳性率为:局部复发23%,盆腔淋巴结32%,盆腔外淋巴结14%,骨转移16%,内脏转移仅1%。阳性率随PSA升高而增加,从PSA 0.2-0.5 ng/ml时的48%升至PSA>2 ng/ml时的>90%。RP时的Gleason评分(GS)对阳性率无显著影响(GS<7为50% vs GS 8-10为62%;p=0.08)。异质性限制了我们发现的普遍性。
结论与临床意义:由于研究异质性显著(主要与治疗类型、PSA和解剖部位差异有关),我们观察到BCR中PSMA PET阳性率存在显著变异性。在RP后BCR中,约半数接受PSMA PET的患者有阳性发现,即使在低PSA(0.2-0.5 ng/ml)时也是如此。在RT后场景中,PSMA PET的使用通常符合Phoenix标准定义的BCR,多数研究在PSA>2 ng/ml时进行PSMA PET。需要进一步研究来优化PSMA PET的PSA阈值,尤其是在RT后场景中,并评估其在指导挽救治疗决策中的作用。
7. 镭-223联合立体定向消融放疗对比单纯立体定向消融放疗治疗寡转移性前列腺癌:RAVENS II期随机试验
发表期刊:J Clin Oncol
目的:随机临床试验(RCT)已显示,对于寡转移性去势敏感性前列腺癌(omCSPC),无雄激素剥夺治疗的转移灶导向治疗(MDT)可改善无进展生存期(PFS)。多数伴骨转移(BM)的omCSPC患者在MDT后会因新增骨病灶复发。我们假设靶向骨转移的α发射体二氯化镭-223(Ra223)可靶向亚临床骨病灶并延迟进展。
方法:这是一项研究者发起的多中心开放标签II期RCT。符合条件的复发性omCSPC伴≥1个骨转移(常规影像≤3个和/或分子影像≤5个)的男性患者按1:1随机分配至单纯立体定向消融放疗(SABR)MDT组或SABR MDT联合Ra223组(6周期)。主要终点为PFS。
结果:2019年8月9日至2023年3月2日,64例患者随机分配,33例至SABR MDT组,31例至SABR MDT/Ra223组,关键协变量平衡。多数SABR MDT/Ra223组患者(87%)接受了6周期Ra223。如图4,SABR MDT组和SABR MDT/Ra223组的中位PFS分别为11.8个月和10.5个月(调整后风险比[aHR] 1.42[95% CI 0.79-2.56];P=0.24)。7例患者(11%)发生≥3级治疗相关不良事件(无4-5级),SABR组33例中2例(6%),SABR MDT/Ra223组30例中5例(17%)。ATM、BRCA1/2、RB1或TP53高风险(HiRi)致病性突变患者的PFS更差(HR 5.95[95% CI 1.83-19.3];P=0.003)。更高的T细胞受体(TCR)独特有效重排数是改善PFS的预后因子,独立于治疗组(aHR 0.45[95% CI 0.21-0.96];P=0.04)。
结论:在伴骨转移的omCSPC中,SABR MDT联合Ra223未延迟疾病进展。我们提供了HiRi突变特征和TCR repertoire作为SABR MDT治疗omCSPC的预后生物标志物的证据,强调了在omCSPC RCT中收集生物标志物相关性数据的重要性。
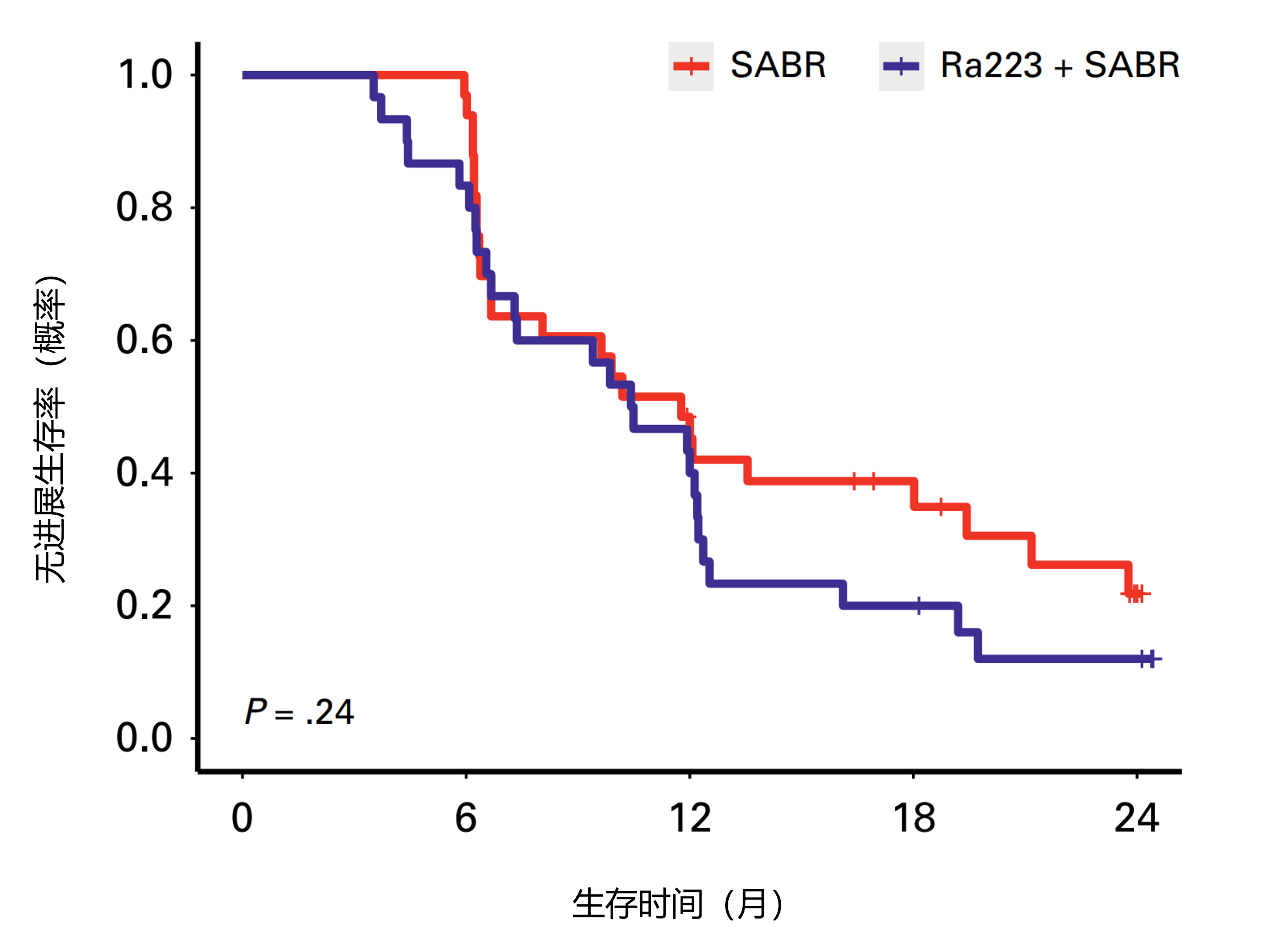
图4.SABR MDT组和SABR MDT/Ra223组的中位无进展生存期
肾癌
8. 原位工程化嵌合IL-2受体增强促炎CAR巨噬细胞在肾细胞癌中的杀瘤活性
发表期刊:Nat Cancer
嵌合抗原受体巨噬细胞(CAR-M)疗法在实体瘤中显示出巨大潜力,然而CAR-M在免疫抑制性肿瘤微环境中的表型“再驯化”限制了其抗肿瘤免疫。我们在此报告一种原位工程化嵌合白细胞介素(IL)-2信号受体(CSR),用于可控调节CAR-M的促炎表型,增强其持续杀瘤免疫。具体而言,我们内部定制的脂质纳米颗粒可高效将双环RNA导入巨噬细胞,生成CSR功能化的CAR-M。CAR-M的细胞内炎症信号通路可通过合成IL-2受体与IL-2治疗剂刺激,诱导CAR-M的抗肿瘤表型转换。此外,水凝胶介导的脂质纳米颗粒与IL-2联合治疗可重塑免疫抑制性肿瘤微环境,并促进肾癌动物模型中的肿瘤消退。总之,我们的发现证实,CAR-M的促炎表型可通过合成IL-2受体调节,这有利于CAR-M的抗肿瘤免疫治疗,并在其他实体瘤中具有广泛应用前景。
尿路上皮癌
9. 阿维鲁单抗联合Sacituzumab Govitecan对比阿维鲁单抗单药作为晚期尿路上皮癌一线维持治疗:JAVELIN Bladder Medley中期分析
发表期刊:Ann Oncol
背景:阿维鲁单抗一线维持治疗是局部晚期或转移性尿路上皮癌(la/mUC)患者在铂类化疗(PBC)后无进展的推荐治疗选择。JAVELIN Bladder Medley II期试验正在研究阿维鲁单抗联合其他抗肿瘤药物对比阿维鲁单抗单药维持治疗的疗效和安全性。我们报告阿维鲁单抗联合Sacituzumab Govitecan(SG)对比阿维鲁单抗单药的中期分析。
患者与方法:la/mUC患者在一线PBC后无进展,按2:1随机分配至阿维鲁单抗(800 mg每2周)联合SG(10 mg/kg第1和8天,21天周期)或阿维鲁单抗单药(800 mg 每2周)。主要终点为研究者评估的无进展生存期(PFS)和安全性。对于PFS和总生存期(OS),阿维鲁单抗单药组数据按方案使用倾向评分加权的JAVELIN Bladder 100数据进行扩展。
结果:数据截止时(2024年9月16日),阿维鲁单抗联合SG组74例中38例(51.4%)和阿维鲁单抗单药组37例中10例(27.0%)仍在接受研究治疗。阿维鲁单抗联合SG与单药组的中位PFS分别为11.17个月vs 3.75个月[风险比(HR)0.49,95%置信区间(CI)0.31-0.76;预设疗效边界:HR≤0.60]。如图5,OS数据尚不成熟,中位OS未达到 vs 23.75个月(HR 0.79,95% CI 0.42-1.50)。阿维鲁单抗联合SG或单药治疗患者中,任何级别治疗相关不良事件(TRAEs)发生率分别为97.3% vs 63.9%(≥3级为69.9% vs 0%)。
结论:对于一线PBC后无进展的la/mUC患者,阿维鲁单抗联合SG作为维持治疗较单药延长PFS。联合治疗的TRAEs更常见,且与SG和阿维鲁单抗的已知安全性特征一致。阿维鲁单抗联合抗Trop-2抗体偶联药物可能是改善la/mUC患者结局的有前景策略。
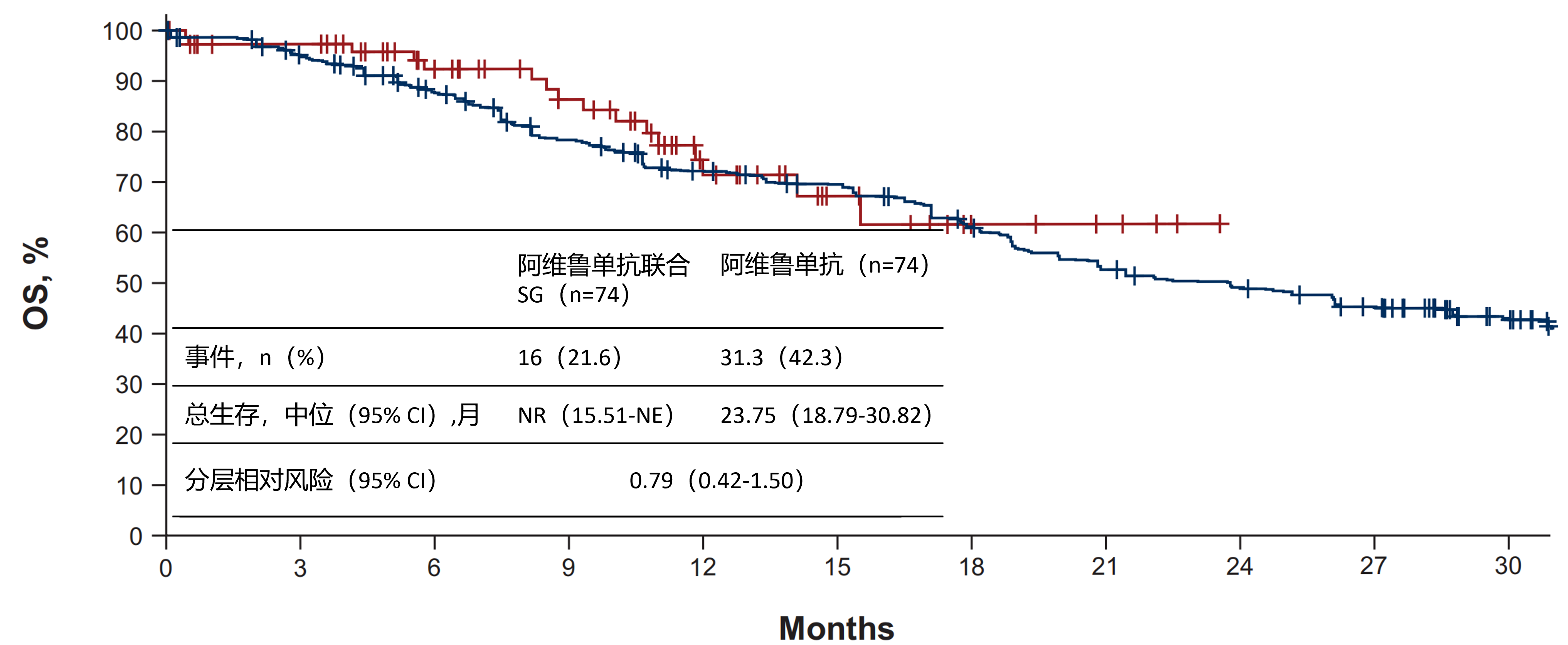
图5.阿维鲁单抗联合SG组对比阿维鲁单抗单药组生存期
10. 恩福妥昔单抗联合帕博利珠单抗治疗未经治疗的局部晚期或转移性尿路上皮癌:III期EV-302/KEYNOTE-A39试验2.5年中位随访结果
发表期刊:Ann Oncol
背景:在EV-302试验的初步分析中,恩福妥昔单抗联合帕博利珠单抗(EV+P)对比化疗在既往未治疗的局部晚期或转移性尿路上皮癌(la/mUC)患者中显示出统计学显著且临床有意义的无进展生存期(PFS)和总生存期(OS)改善。
患者与方法:本文报告总体人群的疗效和安全性更新分析,中位随访2.5年,较初步分析增加了1年随访。
结果:盲态独立中心审查的中位PFS在EV+P组为12.5个月(95% CI 10.4-16.6),化疗组为6.3个月(95% CI 6.2-6.5)(HR 0.48[95% CI 0.41-0.57])。中位OS在EV+P组为33.8个月(95% CI 26.1-39.3),化疗组为15.9个月(95% CI 13.6-18.3)(HR 0.51[95% CI 0.43-0.61])。增加1年随访的安全性数据与初步分析一致。
结论:本次更新分析中,EV+P对比化疗的持续生存获益进一步巩固了EV+P作为la/mUC一线治疗标准的地位。
参考文献
- Hassanzadeh C, Kuban D, Pasyar S, et al. Hypofractionated, Dose-Escalated Radiation Versus Conventionally Fractionated Radiation for Localized Prostate Cancer: Long-Term Update of a Phase III, Prospective, Randomized Controlled Trial [J]. J Clin Oncol. 2025 Jun 20;43(18):2044-2048.
- Lin HM, Scheinberg T, Portman N, et al. Association of the circulating lipid panel, PCPro, with clinical outcomes in metastatic hormone-sensitive prostate cancer: post hoc analysis of the ENZAMET phase III randomised trial (ANZUP 1304) [J]. Ann Oncol. 2025 May 20:S0923-7534(25)00732-X.
- Olmos D, Lorente D, Jambrina A, et al. BRCA1/2 and homologous recombination repair alterations in high- and low-volume metastatic hormone-sensitive prostate cancer: prevalence and impact on outcomes [J]. Ann Oncol. 2025 Jun 2:S0923-7534(25)00739-2.
- Tombal B, Choudhury A, Saad F, et al. Enzalutamide plus radium-223 in metastatic castration-resistant prostate cancer: results of the EORTC 1333/PEACE-3 trial [J]. Ann Oncol. 2025 May 30:S0923-7534(25)00203-0.
- Fizazi K, Morris MJ, Shore ND, et al. Health-related quality of life, pain, and symptomatic skeletal events with [177Lu]Lu-PSMA-617 in patients with progressive metastatic castration-resistant prostate cancer (PSMAfore): an open-label, randomised, phase 3 trial [J]. Lancet Oncol. 2025 May 26:S1470-2045(25)00189-5.
- Mazzone E, Thomson A, Chen DC, et al. The Role of Prostate-specific Membrane Antigen Positron Emission Tomography for Assessment of Local Recurrence and Distant Metastases in Patients with Biochemical Recurrence of Prostate Cancer After Definitive Treatment: A Systematic Review and Meta-analysis [J]. Eur Urol. 2025 May 19:S0302-2838(25)00285-4.
- Wang JH, Sherry AD, Bazyar S,et al. Outcomes of Radium-223 and Stereotactic Ablative Radiotherapy Versus Stereotactic Ablative Radiotherapy for Oligometastatic Prostate Cancers: The RAVENS Phase II Randomized Trial [J]. J Clin Oncol. 2025 Jun 20;43(18):2059-2068.
- Jing W, Han M, Wang G,et al.An in situ engineered chimeric IL-2 receptor potentiates the tumoricidal activity of proinflammatory CAR macrophages in renal cell carcinoma [J]. Nat Cancer. 2025 May;6(5):838-853.
- Hoffman-Censits J, Tsiatas M, Chang PM, et al.Avelumab plus sacituzumab govitecan versus avelumab monotherapy as first-line maintenance treatment in patients with advanced urothelial carcinoma: JAVELIN Bladder Medley interim analysis [J]. Ann Oncol. 2025 May 30:S0923-7534(25)00202-9.
- Powles TB, Van der Heijden MS, Loriot Y, et al.Enfortumab Vedotin Plus Pembrolizumab in Untreated Locally Advanced or Metastatic Urothelial Carcinoma: 2.5-Year Median Follow-Up of the Phase III EV-302/KEYNOTE-A39 Trial [J]. Ann Oncol. 2025 May 29:S0923-7534(25)00762-8.



