
简要介绍
前列腺癌
1. Eur Urol(IF:25.2):基于多模态人工智能的数字病理学生物标志物的开发与验证——用于预测NRG/RTOG试验中根治性前列腺切除术后生化复发患者的转移情况
2. Lancet(IF:88.5):前列腺癌综述
3. J Clin Oncol(IF:41.9):转移性去势抵抗性前列腺癌患者的全身治疗:ASCO临床实践指南(2026.1版)
4. Lancet Oncol(IF:35.9):纳武利尤单抗联合多西他赛对比安慰剂联合多西他赛用于雄激素受体通路抑制剂经治且未接受过化疗的转移性去势抵抗性前列腺癌(CheckMate 7DX):一项双盲、随机、3期试验
肾癌
5. CA Cancer J Clin(IF:232.4):第三届高级泌尿生殖系统癌症共识会议(AUCC3)2025年:关于肾细胞癌和尿路上皮癌管理的专家共识
膀胱癌
6. N Engl J Med(IF:78.5):ALBAN (GETUG-AFU 37):循环肿瘤DNA指导的阿替利珠单抗辅助治疗肌层浸润性膀胱癌(NMIBC)的III期、随机、开放标签、国际多中心临床试验
7. Ann Oncol(IF:65.4):循环肿瘤DNA指导的肌层浸润性膀胱癌根治性膀胱切除术后免疫治疗:TOMBOLA试验结果
前列腺癌
1. 基于多模态人工智能的数字病理学生物标志物的开发与验证——用于预测NRG/RTOG试验中根治性前列腺切除术后生化复发患者的转移情况
发表期刊:Eur Urol
背景及目的:前列腺癌根治术后的生化复发是一种异质性疾病状态,存在多种治疗选择。改善风险分层有助于实现更个性化的决策。我们开发并验证了一种基于数字病理的多模态人工智能模型(multimodal artificial intelligence,MMAI),用于预测接受挽救治疗的根治术后生化复发患者的结局。
方法:利用前列腺组织病理图像特征和临床变量(病理分级组、病理T分期、挽救性放疗前的前列腺特异性抗原水平、年龄和手术切缘)训练MMAI模型,以预测远处转移。该锁定模型在来自NRG/肿瘤放射治疗组9601和0534研究的533例接受挽救性放疗联合或不联合激素治疗的患者中进行了验证,采用Cox回归和时间依赖性受试者工作特征曲线下面积(AUC)进行评估。
主要发现与局限性:中位随访时间为9.3年,MMAI评分与远处转移显著相关(每标准差的亚分布风险比为2.17,95%置信区间1.65–2.85;p<0.001),并且在校正临床变量和治疗后仍具有独立预后价值(图1)。MMAI评分的10年ROC曲线下面积为0.74,而临床列线图为0.68。二分类风险分层显示,MMAI高风险组的10年远处转移发生率(25%)显著高于低风险组(8.8%)(图2)。在高风险组中,激素治疗联合挽救性放疗相比单独挽救性放疗的10年远处转移绝对发生率降低21%,而低风险组仅为2.5%(图3)。本研究的局限性包括采用了归档的试验队列。
结论与临床意义:根治术后MMAI模型可在挽救性放疗联合或不联合激素治疗治疗后为患者提供个体化风险评估,并可能支持关于挽救治疗的共同决策。目前该模型的外部和前瞻性验证工作正在进行中。
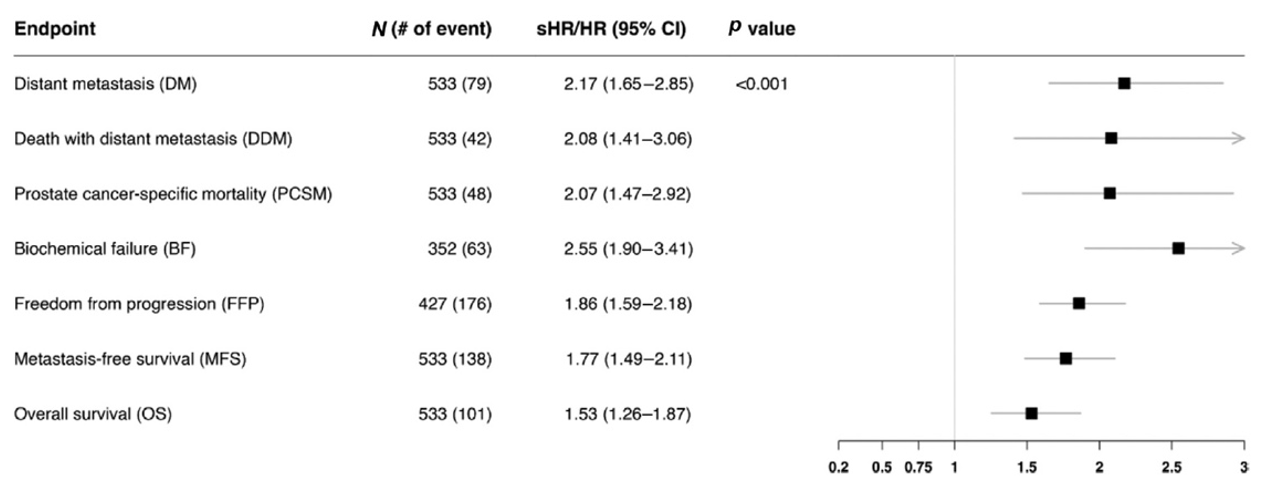
图1. 验证队列中,根治性前列腺切除术后多模态人工智能评分与各临床终点的预后关联
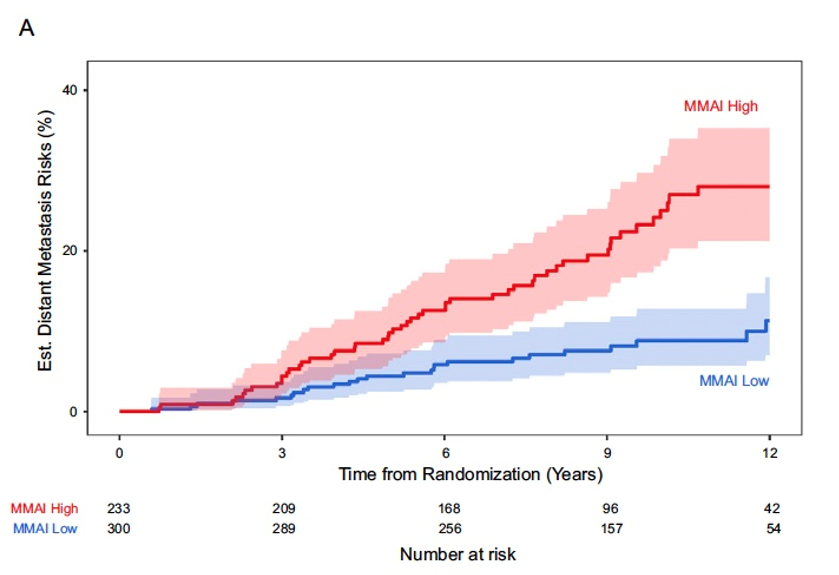
图2. 验证队列中远处转移的累积发生率曲线
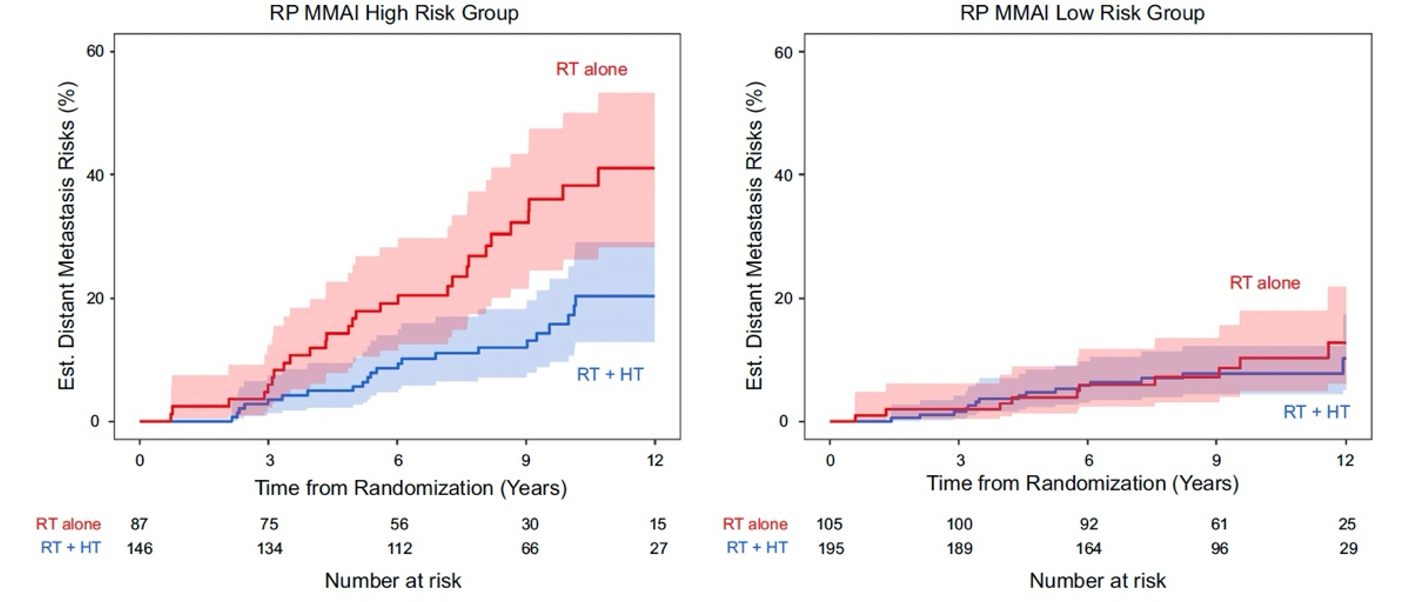
图3.(A)RP MMAI 高风险组和(B)RP MMAI 低风险组内远处转移的累积发生率曲线
2. 前列腺癌综述
发表期刊:Lancet
摘要:前列腺癌是一项重大的临床挑战,在全球癌症相关死亡中占相当大的比例。过去5年,治疗格局发生了巨大转变,患者结局因此得到改善。在本次专题综述中,我们回顾了前列腺癌的病理学、诊断策略和治疗方法。主动监测是惰性前列腺癌患者的首选治疗方案。对于需要治疗的患者,局部治疗可实现有效的肿瘤控制。系统治疗对于晚期和转移性病例至关重要,目前已有多种治疗手段可用,包括雄激素剥夺治疗、化疗,以及新兴的靶向药物,如镥 177标记的前列腺特异性膜抗原放射性配体治疗和PARP抑制剂。在促进共同决策时,兼顾毒性特征和患者偏好非常重要。未来仍需开展进一步研究,以确定转移性前列腺癌最有效的治疗顺序和联合方案。
3. 转移性去势抵抗性前列腺癌患者的系统治疗:ASCO动态指南,2026.1版
发表期刊:J Clin Oncol
摘要:动态指南针对证据快速更新、导致临床推荐频繁变化的特定主题领域制定。按照《ASCO 指南方法学手册》的描述,动态指南由常设专家小组按固定周期更新,并持续、系统地检索和评价相关医学文献。ASCO 动态指南遵循《ASCO 临床实践指南利益冲突政策实施细则》。
背景:2025年,ASCO发布了关于转移性去势抵抗性前列腺癌系统治疗的动态临床实践指南。基于新证据,本版mCRPC系统治疗动态指南根据最新证据提供了更新的推荐意见。
结果:截至2025年8月1日,共有204篇文献被确定符合动态系统评价的纳入标准,其中包括自指南首次发布以来新增或更新的21篇文献。6项III期临床试验的报告被专家小组认为值得进一步审查(附录表A1):TALAPRO 2、EORTC 1333/PEACE 3、CONTACT 02、KEYNOTE 641、KEYNOTE 921和MAGNITUDE。其中4项为新研究(EORTC 1333/PEACE 3、CONTACT 02、KEYNOTE 641、KEYNOTE 921),2项为先前发表研究的更新(TALAPRO 2和MAGNITUDE)。鉴于美国食品药品监督管理局最近批准镥 177 PSMA 617用于多西他赛治疗前,另一项试验(PSMAfore)被重新审查。支持未改变推荐意见的证据在本指南的先前版本中已有综述。
更新推荐:主要针对四类临床路径下mCRPC患者的诊疗做了推荐更新:
1. 既往在mHSPC或nmCRPC阶段仅接受过ADT治疗且疾病已进展至mCRPC的患者(图4A1)
2. 既往接受过ADT和ARPI治疗且病情进展为mCRPC的患者(图4A2)
3. 既往接受过ADT和多西他赛治疗且疾病已进展至mCRPC的患者(图4A3)
4. 既往接受过ADT/ARPI和多西他赛治疗且疾病已进展为mCRPC的患者(图4A4)。
强调应尽早在可行的情况下对转移性前列腺癌患者进行胚系和体系检测,应根据患者在mHSPC阶段接受的既往治疗史个体化治疗方案,并综合考量患者的临床状态,肿瘤相关症状与体征,治疗相关毒性,潜在的药物相互作用成本及药物可及性。
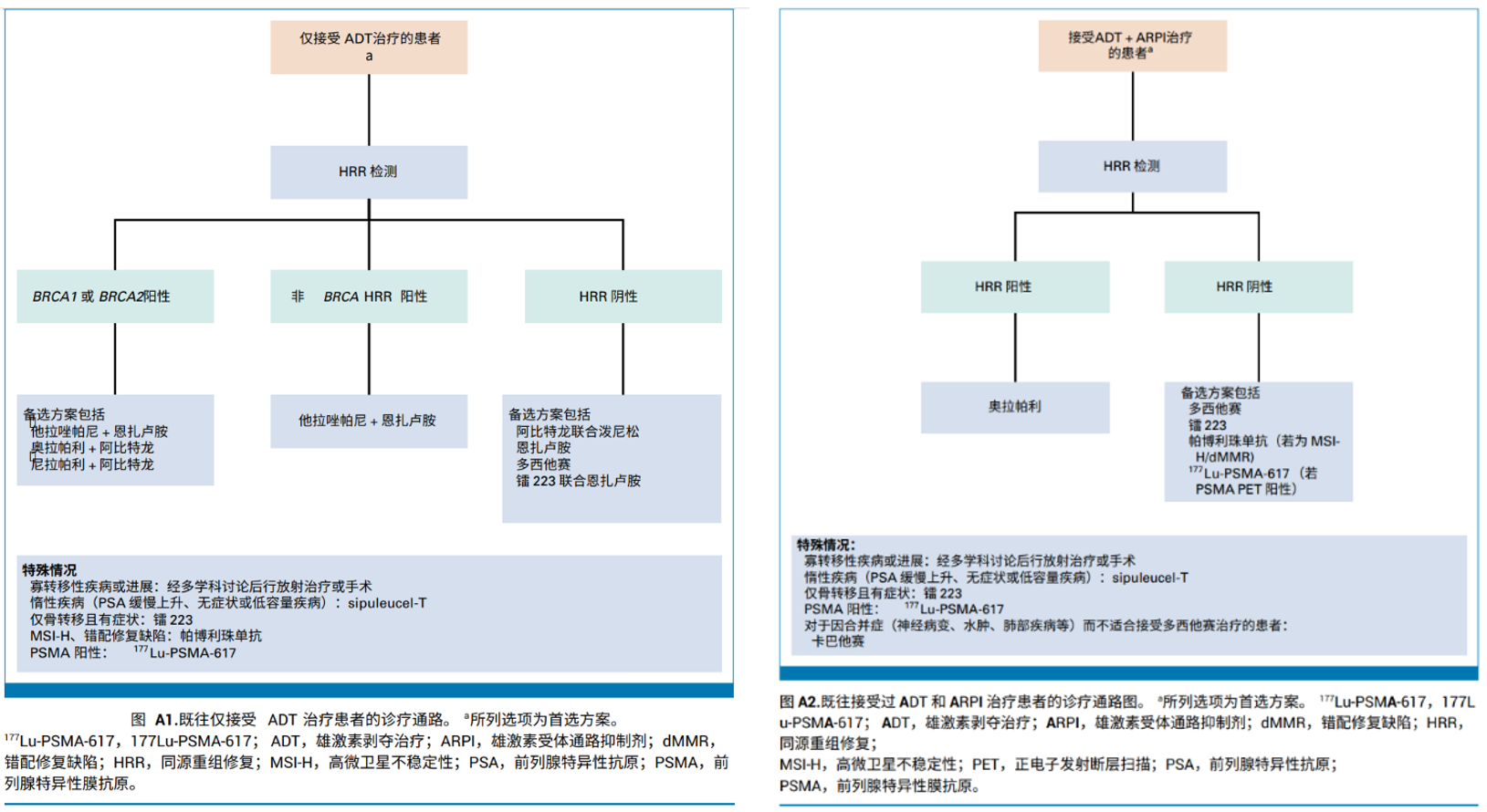
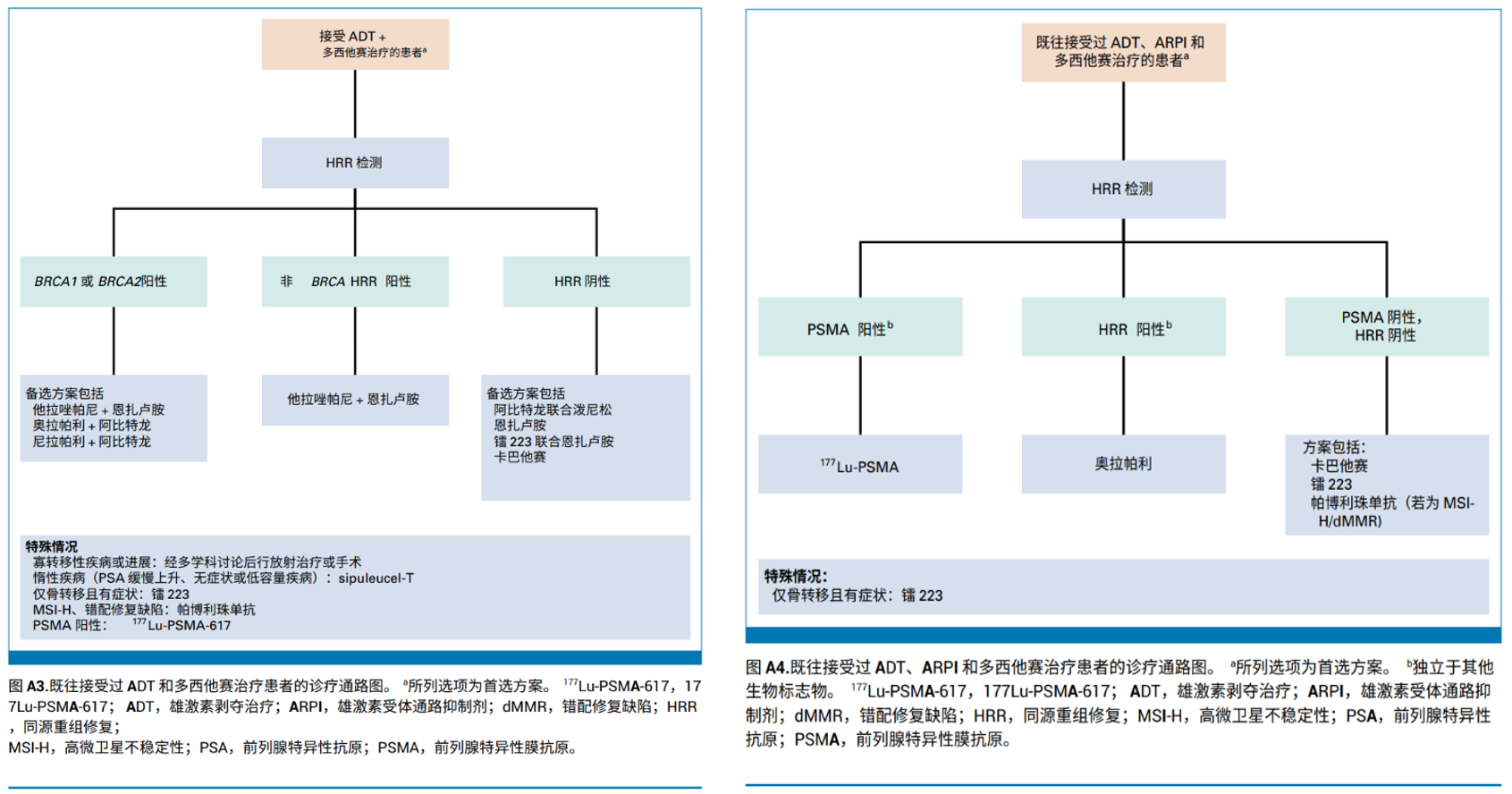 图4:A1:仅接受ADT治疗患者的诊疗通路;A2:既往接受过ADT和ARPI治疗患者的诊疗通路;
图4:A1:仅接受ADT治疗患者的诊疗通路;A2:既往接受过ADT和ARPI治疗患者的诊疗通路;
A3:既往接受过ADT和多西他赛治疗患者的诊疗通路;A4:既往接受过ADT,ARPI和多西他赛治疗患者的诊疗通路
4. 纳武利尤单抗联合多西他赛对比安慰剂联合多西他赛用于雄激素受体通路抑制剂经治且未接受过化疗的转移性去势抵抗性前列腺癌(CheckMate 7DX):一项双盲、随机、3期试验
发表期刊:Lancet Oncol
背景:雄激素受体通路抑制剂和多西他赛是未经化疗的转移性去势抵抗性前列腺癌的标准治疗。本研究旨在评估在雄激素受体通路抑制剂经治、未接受过化疗的转移性去势抵抗性前列腺癌患者中,在多西他赛基础上加用纳武利尤单抗对比单用多西他赛的疗效和安全性。
方法:本研究为一项双盲、随机、三期临床试验,在27个国家的291所医院和癌症中心入组年龄18周岁及以上、经组织学证实、雄激素受体通路抑制剂经治且未接受过化疗的转移性去势抵抗性前列腺癌成人患者。患者需在筛查前6个月内出现疾病进展,且东部肿瘤协作组体能状态评分为0或1。患者按1:1比例随机分配至纳武利尤单抗联合多西他赛组或安慰剂联合多西他赛组,均为每3周静脉给药一次,最多10个周期;随后纳武利尤单抗组接受纳武利尤单抗每4周一次维持治疗,安慰剂组接受相应安慰剂。随机化按既往雄激素受体通路抑制剂治疗和是否存在内脏转移分层,采用交互式应答技术以区组大小为6的置换区组随机化。患者、研究者和申办方均对治疗分配设盲。主要终点为盲态独立中心评估的影像学无进展生存期和总生存期,在所有随机化患者中进行分析。安全性在至少接受一剂研究药物的患者中评估。该研究已在临床试验网站注册,并已完成。
结果:2020年3月11日至2022年8月2日期间,共筛查1414例患者,其中1030例被随机分配至纳武利尤单抗联合多西他赛组或安慰剂联合多西他赛组。所有受试者均为男性,中位年龄70岁,662例为白人,240例为亚洲人,35例为黑人或非裔美国人。中位随访17.2个月。纳武利尤单抗联合多西他赛组的中位影像学无进展生存期为9.4个月,安慰剂联合多西他赛组为8.7个月(风险比0.96;检验值0.59)(图5)。中位总生存期分别为18.7个月和18.9个月(风险比1.09;检验值0.36)(图6)。纳武利尤单抗联合多西他赛组510例患者中有223例发生3至4级治疗相关不良事件,安慰剂联合多西他赛组510例患者中有187例。两组最常见的3至4级事件为中性粒细胞减少和中性粒细胞计数下降。任何级别的治疗相关严重不良事件在纳武利尤单抗联合多西他赛组为107例,在安慰剂联合多西他赛组为77例(表1)。纳武利尤单抗联合多西他赛组报告12例治疗相关死亡,安慰剂联合多西他赛组报告1例治疗相关死亡。
结论:在雄激素受体通路抑制剂经治、未接受过化疗的转移性去势抵抗性前列腺癌患者中,纳武利尤单抗联合多西他赛并未改善影像学无进展生存期或总生存期。这些结果不支持在未经选择的雄激素受体通路抑制剂经治、未接受过化疗的转移性去势抵抗性前列腺癌患者群体中使用抗程序性死亡受体一免疫检查点抑制剂联合多西他赛的治疗方案。
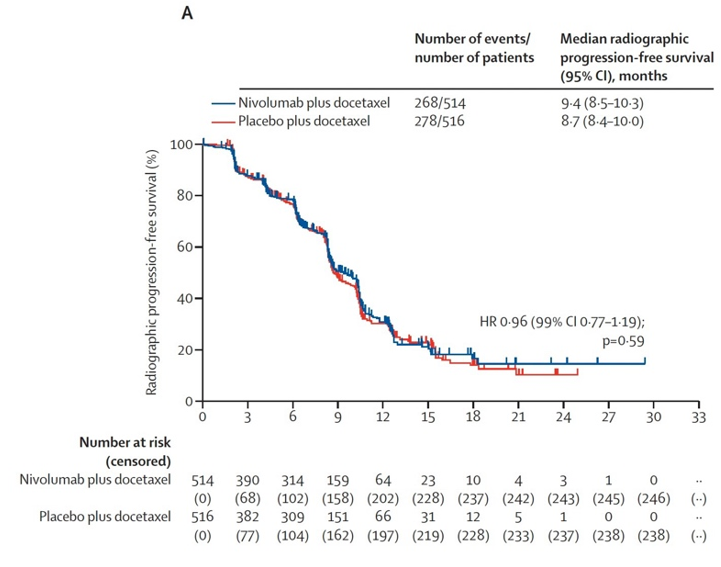
图5:影像学无进展生存期累积发生率曲线
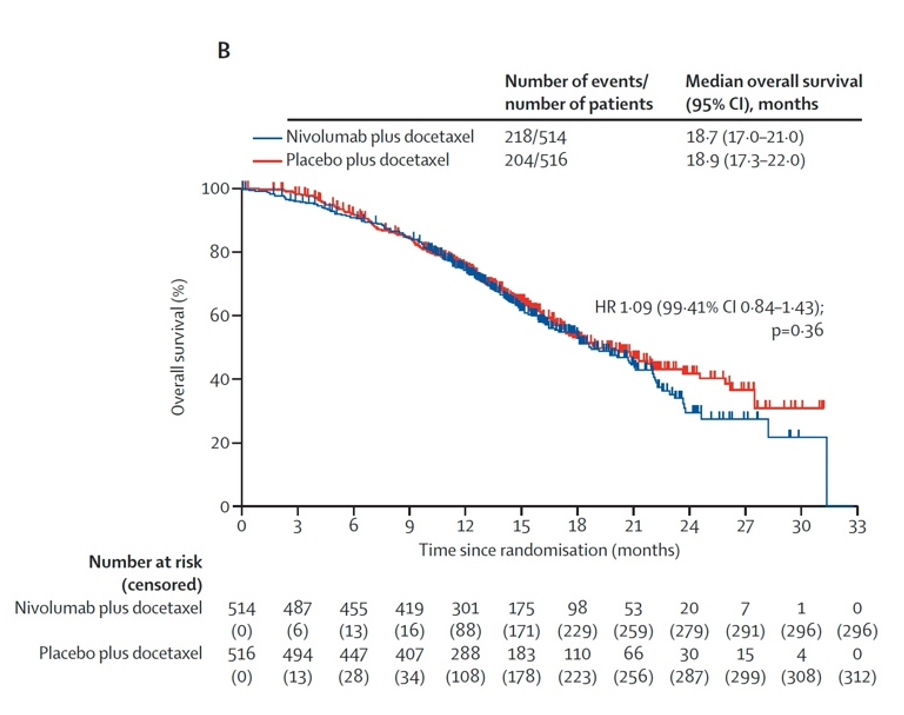
图6:总生存期累积发生率曲线
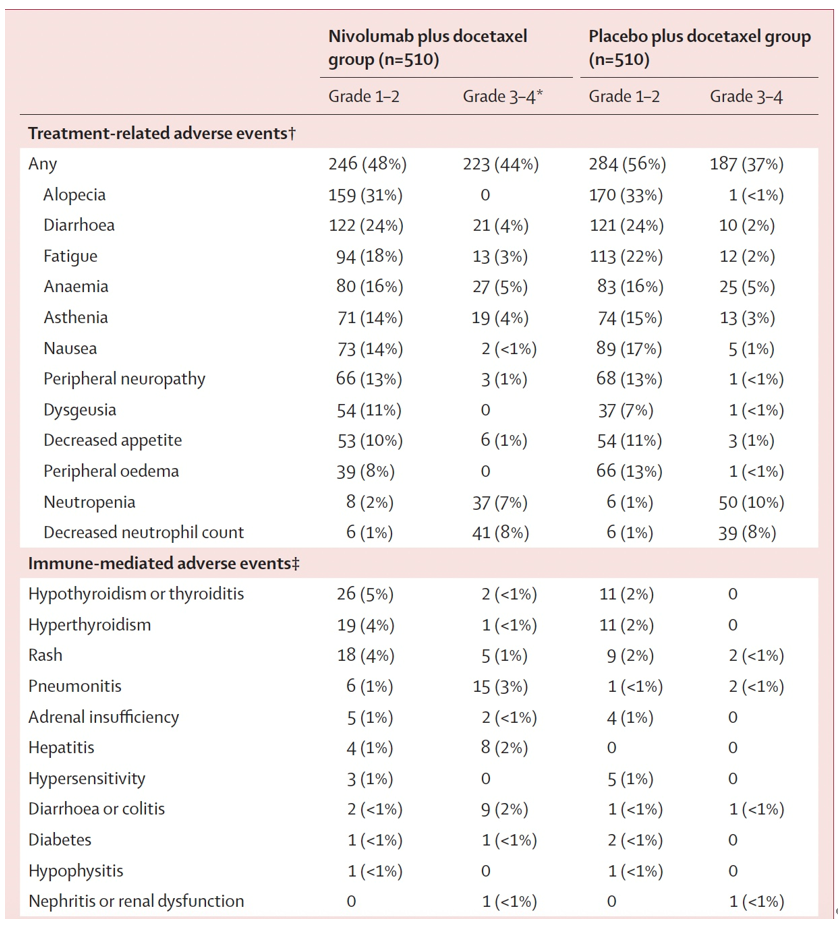
表1:所有接受治疗患者的治疗相关不良事件和免疫介导的不良事件
肾癌
5. 晚期泌尿系统肿瘤共识会议(AUC3)2025:肾细胞癌及尿路癌症临床管理专家共识
发表期刊:CA Cancer J Clin
摘要:肾细胞癌(RCC)和尿路癌(UTC)的治疗格局发生了巨大变化,使得治疗选择和排兵布阵变得日益复杂。2025年晚期泌尿系肿瘤共识会议的召开,旨在为优化这两类肿瘤的管理制定循证的专家共识建议。一个由51名专家组成的多学科小组参与了改良的德尔菲法流程,针对通过迭代共识形成的、涵盖肾细胞癌和尿路癌管理相关问题进行了讨论。会议前后均进行了投票,会后针对专家组反馈做集中分析,共识定义为至少75%的一致同意,强共识为超过90%。
专家组对以下内容达成了强共识:对高危肾细胞癌(包括病理T2 [pT2] 4级、pT3-pT4任何级别、pTXN1或完全切除的转移性疾病)使用辅助帕博利珠单抗;对局限性尿路上皮癌在膀胱切除术前使用新辅助治疗;对转移性尿路上皮癌使用EV联合帕博利珠单抗作为一线治疗;以及对生物标志物阴性的尿路上皮癌在疾病进展后使用含铂化疗。
对于肾细胞癌,专家组还达成如下共识:在一线免疫检查点抑制剂联合血管内皮生长因子受体酪氨酸激酶抑制剂治疗或双免疫检查点抑制剂治疗进展后,可使用单药血管内皮生长因子受体酪氨酸激酶抑制剂。
然而,在肾细胞癌和尿路上皮癌管理的其他关键领域仍缺乏共识。
2025年晚期泌尿系统肿瘤共识会议为复杂的临床场景提供了循证指导,同时明确了关键的研究方向。专家组认识到,多个领域缺乏共识凸显了改进患者选择和开展前瞻性研究的必要性,以推动更优的联合治疗和序贯治疗策略。这一年度共识更新为应对不断演变的治疗模式提供指导,以优化患者预后结局。
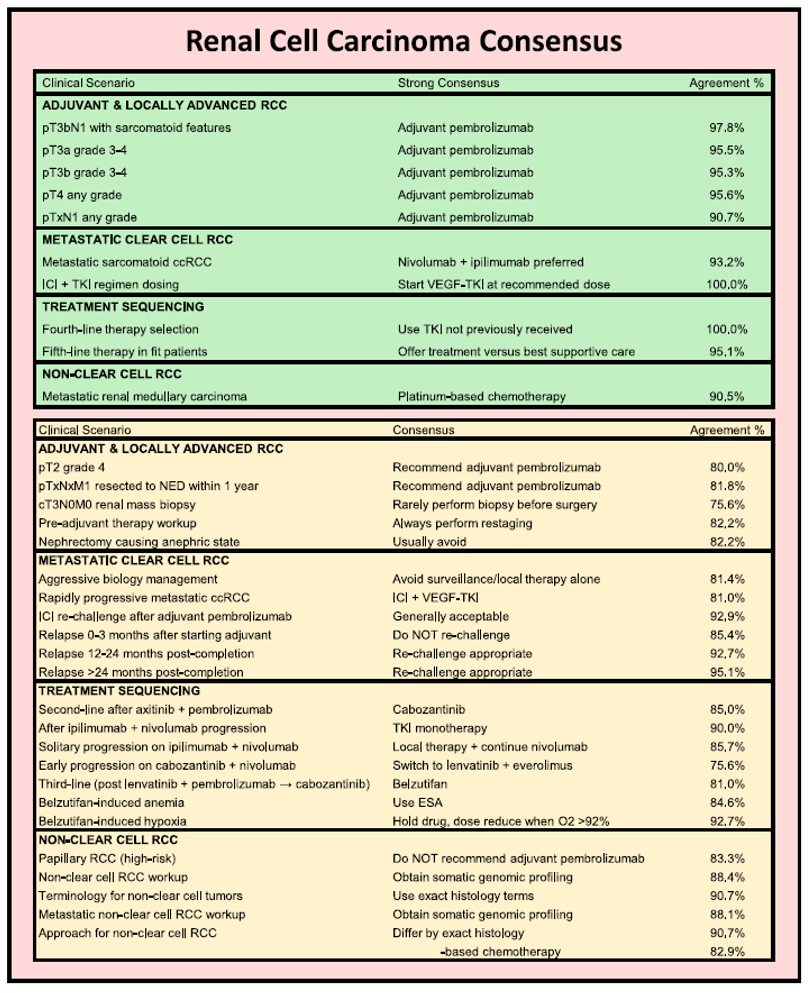
图7. 肾细胞癌的共识建议
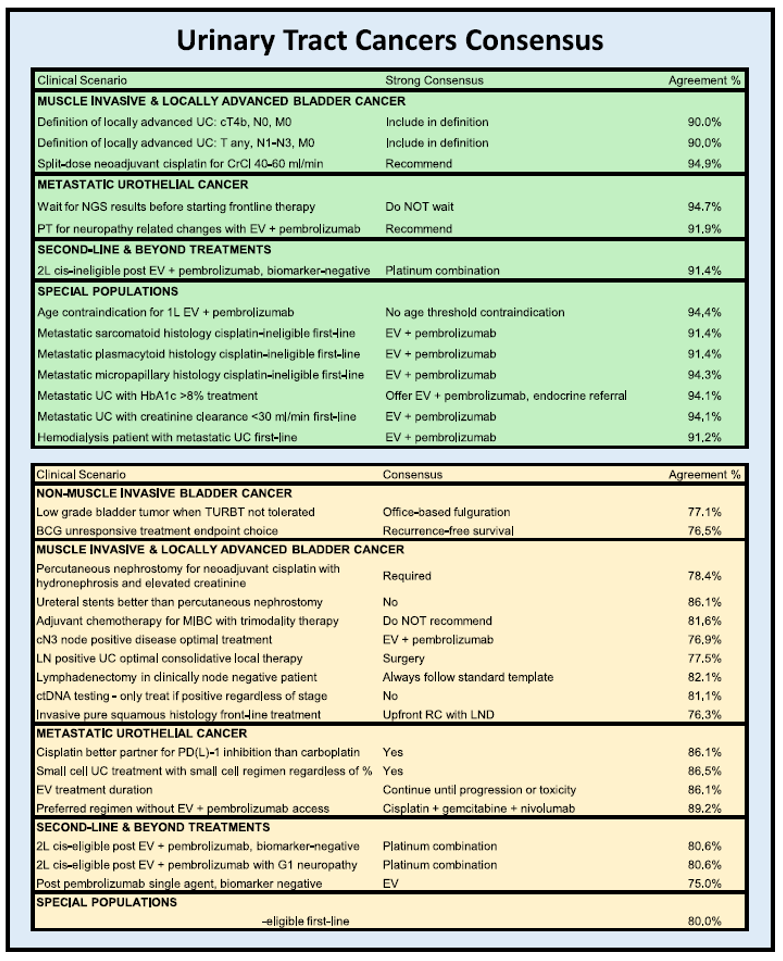
图7. 尿路癌的共识建议
膀胱癌
6. ALBAN (GETUG-AFU 37):循环肿瘤DNA指导的阿替利珠单抗辅助治疗肌层浸润性膀胱癌(NMIBC)的III期、随机、开放标签、国际多中心临床试验
发表期刊:N Engl J Med
背景:肌层浸润性膀胱癌患者在膀胱切除术后的结局存在差异。基于循环肿瘤DNA的分子残留病灶检测可能识别出术后复发高风险的患者,这些患者可能从辅助免疫治疗中获益,从而使低风险患者避免不必要的治疗负担。
方法:在一项3期、双盲、随机试验中,我们采用系列循环肿瘤DNA检测对术后无影像学疾病证据的肌层浸润性膀胱癌患者进行了长达1年的监测。在监测期间循环肿瘤DNA检测呈阳性的符合条件患者以2:1的比例随机分配,每4周接受静脉注射阿替利珠单抗或安慰剂,最长1年。主要终点是研究者评估的无病生存期。总生存期是按层级顺序评估的次要终点,以控制一类错误。持续循环肿瘤DNA阴性的患者不接受阿替利珠单抗或安慰剂。
结果:共纳入761例患者;250例循环肿瘤DNA阳性的合格患者接受了随机分组(167例进入阿替利珠单抗组,83例进入安慰剂组)。阿替利珠单抗组的中位无病生存期为9.9个月,而安慰剂组为4.8个月(疾病复发或死亡的风险比为0.64;95%置信区间为0.47至0.87;P=0.005)(图8)。阿替利珠单抗组的中位总生存期为32.8个月,而安慰剂组为21.1个月(死亡风险比为0.59;95%置信区间为0.39至0.90;P=0.01)(图9)。阿替利珠单抗组28%的患者和安慰剂组22%的患者出现3级或4级不良事件(与治疗相关的分别为7%和4%);两组分别有3%和2%的患者发生致命不良事件(与治疗相关的分别为2%和0%)(表2)。在357例持续循环肿瘤DNA阴性的患者中,1年监测结束时的无病生存率为95%,2年时为88%(图10)。
结论:在肌层浸润性膀胱癌患者中,由循环肿瘤DNA指导的阿替利珠单抗辅助治疗相比安慰剂显著延长了无病生存期和总生存期。(由霍夫曼 拉罗什公司资助;IMvigor011,临床试验编号NCT04660344。)
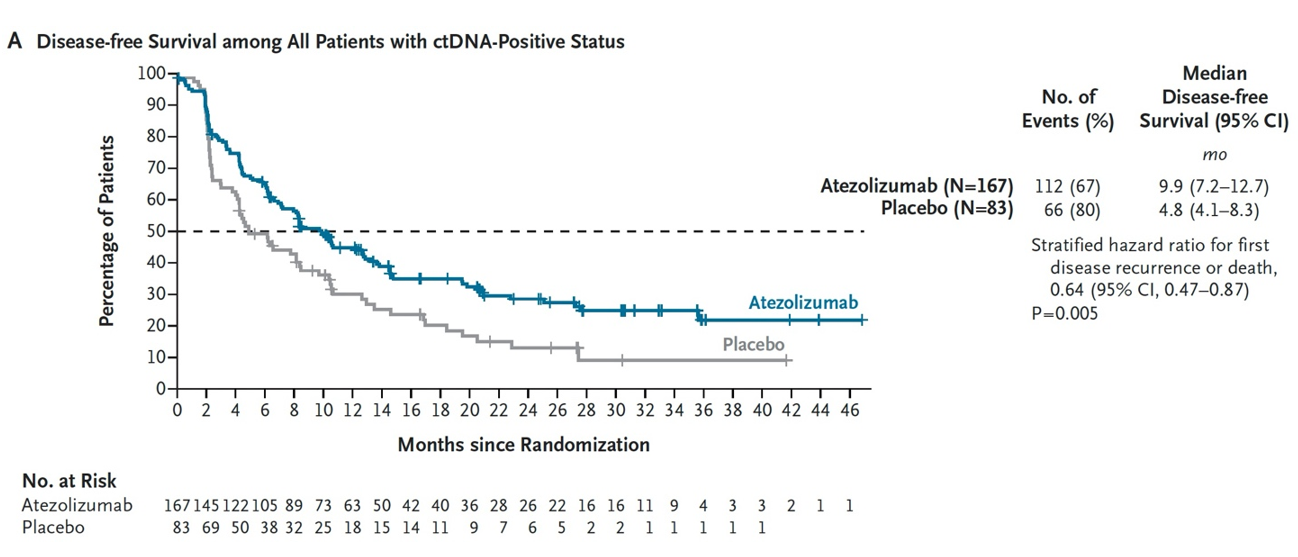
图8. ctDNA阳性患者的中位无病生存期对比
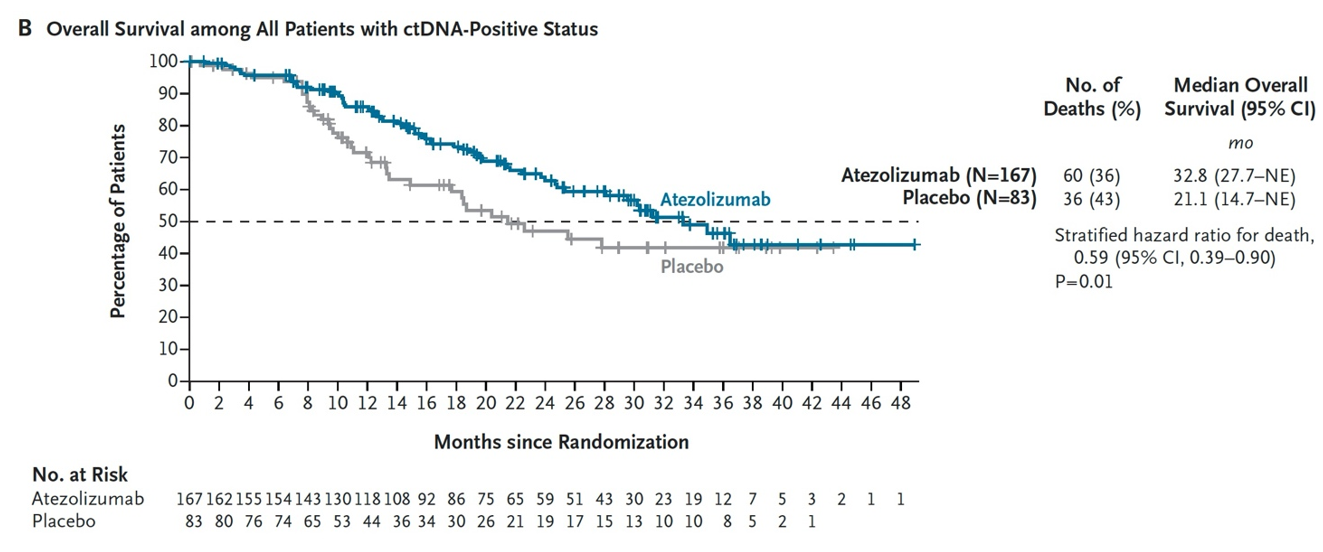
图9. ctDNA阳性患者的中位总生存期对比
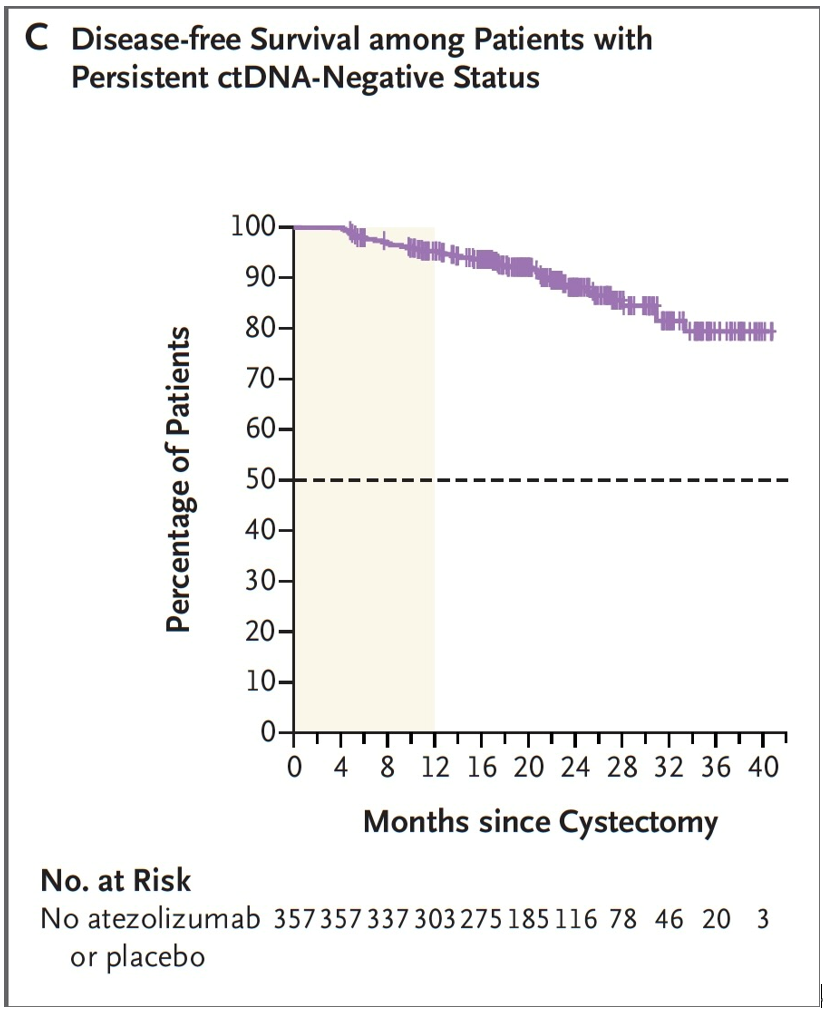
图10 持续ctDNA阴性患者的无病生存率
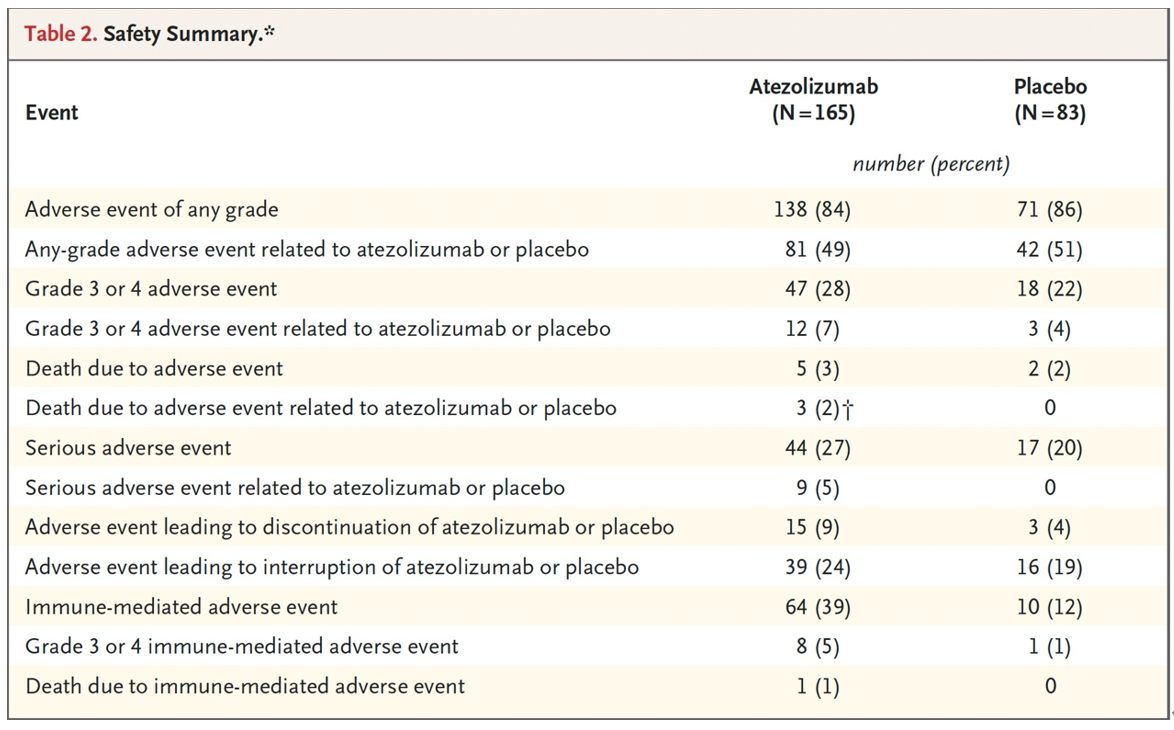
表2. 安全性总结
7. 循环肿瘤DNA指导的肌层浸润性膀胱癌根治性膀胱切除术后免疫治疗:TOMBOLA试验结果
发表期刊:Ann Oncol
背景:局限性肌层浸润性膀胱癌的标准治疗是新辅助化疗后行根治性膀胱切除术,但约50%的患者在2年内复发。目前辅助免疫治疗仅根据病理学和临床评估在高风险患者中使用,可能导致治疗不足或过度治疗。
患者与方法:TOMBOLA是一项丹麦多中心、开放标签、单臂的2期试验,旨在评估采用系列循环肿瘤DNA检测来指导术后免疫治疗。接受新辅助化疗和根治性膀胱切除术的低危和高危肌层浸润性膀胱癌患者(临床分期T2至4a、淋巴结0至1、无远处转移)在术后接受基于肿瘤个体化特征的循环肿瘤DNA检测监测。循环肿瘤DNA阳性患者无论影像学结果如何,均开始接受阿替利珠单抗治疗,最长1年;循环肿瘤DNA阴性患者仅在影像学发现转移后才接受免疫治疗。主要终点为分子学和影像学完全缓解。关键次要终点包括无复发生存期和总生存期。
结果:共纳入192例患者,在意向治疗人群中178例可评估患者(中位随访34个月)中,104例(58%)在膀胱切除术后2年内出现循环肿瘤DNA阳性,其中63%在4个月内出现。从循环肿瘤DNA检测阳性到影像学确认复发的中位提前时间为90天(范围- 61至961天)(图11)。在循环肿瘤DNA阳性患者中,84例完成阿替利珠单抗治疗并具备可用于主要终点评估的影像学和循环肿瘤DNA数据。60%(50/84)的患者达到主要终点完全缓解。循环肿瘤DNA阴性患者的1年无复发生存率为97%,循环肿瘤DNA阳性患者为76%(图12)。预设的生物标志物分析显示,循环肿瘤DNA状态和水平、风险分层以及免疫相关基因表达特征均与复发风险和对免疫治疗的反应相关。治疗耐受性良好,未出现新的安全性问题。
结论:新辅助化疗和膀胱切除术后进行基于肿瘤个体化特征的循环肿瘤DNA检测可预测复发风险,并为肌层浸润性膀胱癌提供个性化术后管理。TOMBOLA研究表明,循环肿瘤DNA阳性的低危患者可能从早期免疫治疗中获益,而循环肿瘤DNA阴性的高危患者则可在不影响结局的情况下安全地避免辅助治疗。临床试验注册号:NCT04138628。
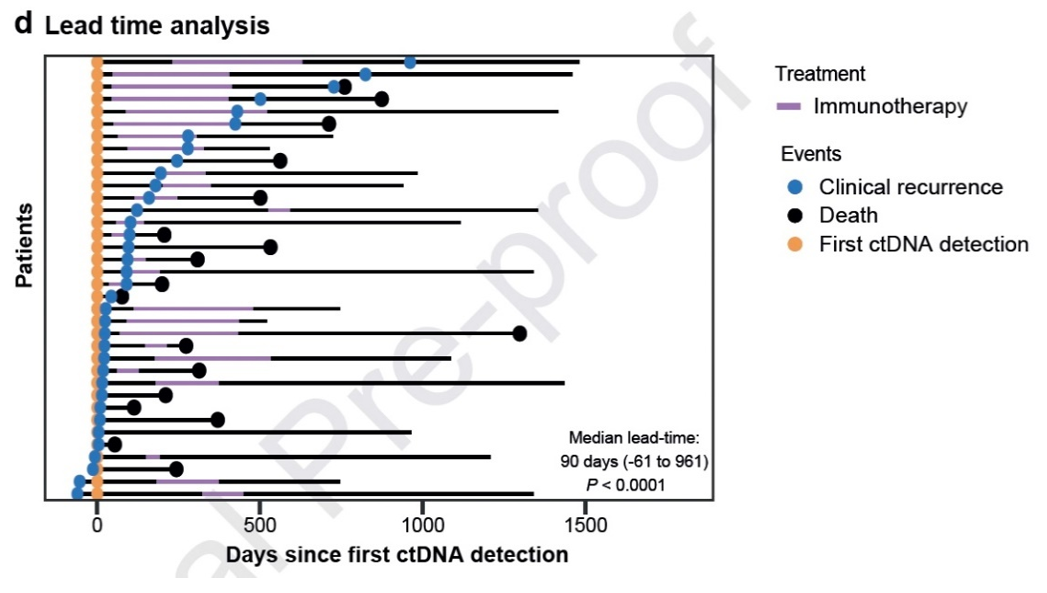
图11. 提前时间分析
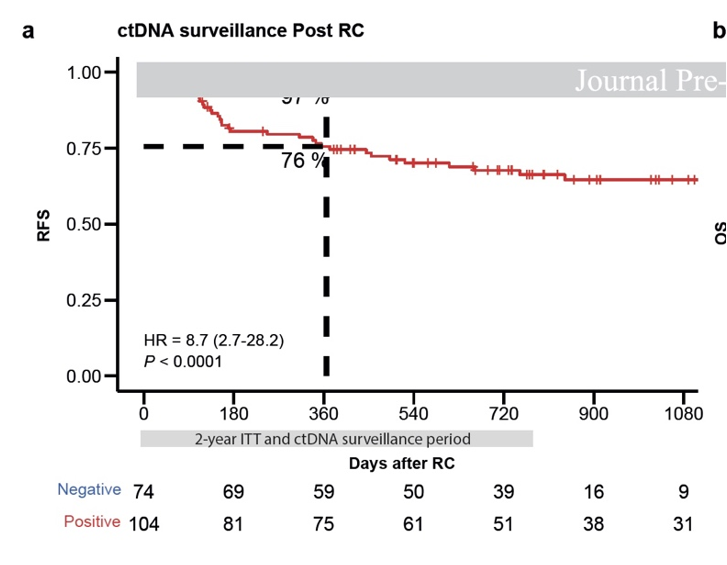
图12. 根治性膀胱切除术后ctDNA阳性与阴性患者的无复发生存率
参考文献
- Morgan TM, Ren Y, Tang S, et al. Development and Validation of a Multimodal Artificial Intelligence-derived Digital Pathology-based Biomarker Predicting Metastasis Among Patients with Biochemical Recurrence After Radical Prostatectomy in NRG/RTOG Trials. Eur Urol. Published online December 22, 2025. doi:10.1016/j.eururo.2025.12.007
- Fonteyne V, Tree A, Castro E, Touijer K, Walz J. Prostate cancer. Lancet. Published online December 16, 2025. doi:10.1016/S0140-6736(25)02221-4
- Taplin ME, Riaz IB, Rumble RB, et al. Systemic Therapy in Patients With Metastatic Castration-Resistant Prostate Cancer: ASCO Living Guideline, Version 2026.1. J Clin Oncol. Published online January 20, 2026. doi:10.1200/JCO-25-02693
- Fizazi K, Saad F, Alonso-Gordoa T, et al. Nivolumab plus docetaxel versus placebo plus docetaxel for androgen receptor pathway inhibitor-pretreated and chemotherapy-naive metastatic castration-resistant prostate cancer (CheckMate 7DX): a double-blind, randomised, phase 3 trial. Lancet Oncol. 2026;27(1):68-78. doi:10.1016/S1470-2045(25)00566-2
- McKay RR, Pal S, Xie W, et al. Advanced Urologic Cancer Consensus Conference (AUC3) 2025: Expert consensus on the management of renal cell and urinary tract cancers. CA Cancer J Clin. 2026;76(1):e70052. doi:10.3322/caac.70052
- Powles T, Kann AG, Castellano D, et al. ctDNA-Guided Adjuvant Atezolizumab in Muscle-Invasive Bladder Cancer. N Engl J Med. 2025;393(24):2395-2408. doi:10.1056/NEJMoa2511885
- Dyrskjøt L, Birkenkamp-Demtröder K, Nordentoft I, et al. ctDNA-Guided Immunotherapy following Radical Cystectomy for Muscle-Invasive Bladder Cancer: Results from the TOMBOLA Trial. Ann Oncol. Published online January 14, 2026. doi:10.1016/j.annonc.2025.12.018



