
简要介绍
前列腺癌
1. Eur Urol:非转移性前列腺癌术后放疗联合雄激素抑制治疗的持续时间(DADSPORT):汇总数据的合作系统评价与荟萃分析
2. Lancet Oncol:调强中度大分割放疗与立体定向体部放疗治疗前列腺癌(PACE-C):一项随机、开放标签、3期非劣效性试验的早期毒性结果
3. Lancet Oncol:卡博替尼联合阿替利珠单抗治疗转移性前列腺癌(CONTACT-02):一项3期、开放标签、随机试验的最终分析
4. Lancet Oncol:二甲双胍用于开始雄激素剥夺治疗的转移性前列腺癌患者:STAMPEDE平台方案的3期随机试验
5. Eur Urol:接受达罗他胺或安慰剂联合多西他赛及雄激素剥夺治疗的转移性激素敏感性前列腺癌患者的进展后生存期:3期ARASENS试验的事后分析
肾癌
6. N Engl J Med:贝伐珠单抗联合厄洛替尼治疗遗传性和散发性乳头状肾癌
7. JAMA Oncol:晚期非透明细胞肾细胞癌的一线治疗:系统评价与荟萃分析
8. J Clin Oncol:嫌色细胞肾细胞癌中抗肿瘤免疫受损的肿瘤内在和微环境决定因素
尿路上皮癌
9. Nat Cancer:阿替利珠单抗联合个性化新抗原疫苗治疗尿路上皮癌:1期试验
10. Eur Urol:阿维鲁单抗一线维持治疗晚期尿路上皮癌:JAVELIN Bladder 100试验中非内脏转移或仅淋巴结转移患者的长期结局
前列腺癌
1. 非转移性前列腺癌术后放疗联合雄激素抑制治疗的持续时间(DADSPORT):汇总数据的合作系统评价与荟萃分析
发表期刊:Eur Urol
背景与目的:为更好地明确激素治疗(HT)联合术后放疗(RT)在非转移性前列腺癌中的作用,DADSPORT协作组计划对随机对照试验(RCTs)的汇总数据进行系统评价和荟萃分析。
方法:纳入评估非转移性前列腺癌患者术后放疗联合激素治疗的随机对照试验。在近期试验结果公布前,研究方法已预先确定(CRD42022325769)。主要结局为总生存期(OS);次要结局为无转移生存期(MFS)和前列腺癌特异性生存期(PCSS)。从研究者处获取包括预设参与者亚组在内的汇总结果,并采用固定效应荟萃分析对各试验结果进行合并。通过敏感性分析和网络荟萃分析评估结果的一致性。
主要发现与局限性:主要分析纳入5项随机对照试验。没有明确证据表明激素治疗可改善总生存期(风险比[HR]=0.86,95%置信区间[CI]=0.74–1.00,p=0.057;8年时的绝对效应为2%[0–3.5%]),且激素治疗持续时间对疗效无显著影响(p=0.6)。激素治疗对总生存期的获益似乎仅限于放疗前前列腺特异性抗原水平较高(p=0.07)和CAPRA-S评分较高(p=0.09)的患者。激素治疗显著改善无转移生存期(HR=0.78,95% CI=0.69–0.88,p<0.001)和前列腺癌特异性生存期(HR=0.61,95% CI=0.47–0.79,p<0.001),8年时这两项结局的绝对改善率均为4%。
结论与临床意义:术后放疗后给予短疗程或长疗程激素治疗可改善无转移生存期和前列腺癌特异性生存期。观察到的总生存期改善幅度较小,且可能仅限于具有较高风险因素的患者。
2. 调强中度大分割放疗与立体定向体部放疗治疗前列腺癌(PACE-C):一项随机、开放标签、3期非劣效性试验的早期毒性结果
发表期刊:Lancet Oncol
背景:中度大分割放疗(MHRT)是前列腺癌的标准治疗方法。立体定向体部放疗(SBRT)也具有疗效,且在无需激素治疗的低风险患者中已被证明不劣于中度大分割放疗(PACE-B),但关于高风险患者毒性的随机数据仍缺乏。本研究旨在比较中度大分割放疗与立体定向体部放疗的早期毒性。
方法:PACE-C是一项随机、开放标签、3期非劣效性试验,在英国、爱尔兰共和国和新西兰的53家医院开展,纳入年龄≥18岁、组织学确诊为中风险或高风险前列腺腺癌(T1–T3a,Gleason评分7–8,前列腺特异性抗原10–30ng/mL)且WHO体能状态评分为0–2的男性患者。参与者通过中央随机分配(1:1;非盲法;区组大小为4和6;按中心和风险组分层)接受中度大分割放疗(60 Gy;20次每日分割,持续4周)或立体定向体部放疗(36.25 Gy;5次,每日或隔日分割,持续1–2周),同时对前列腺及精囊近端1cm的临床靶区额外给予40 Gy的强制性剂量(无边缘)。计划给予6个月的雄激素剥夺治疗,并在放疗开始前启动。PACE-C的主要结局为无生化或临床失败生存期,相关数据尚未成熟。本预设安全性分析的共同主要终点为放疗期间或完成后12周内(早期或急性期)出现2级及以上放射肿瘤学组(RTOG)胃肠道和泌尿生殖系统毒性的比例。按实际接受的治疗进行分析,纳入接受至少1次中度大分割放疗或立体定向体部放疗的参与者。试验仍在随访中,后期毒性和疗效数据有待进一步公布。该研究已在ClinicalTrials.gov注册,编号NCT01584258。
结果:2019年11月13日至2022年6月24日,608名患者接受了中度大分割放疗,584名患者接受了立体定向体部放疗,并纳入研究分析。在1192名患者中,1136名(95%)为白人,20名(2%)为黑人或英裔黑人,17名(1%)为亚裔或英裔亚裔,7名(1%)为华裔或其他种族。在早期阶段(治疗后12周内),共同主要终点——2级及以上RTOG泌尿生殖系统毒性在接受中度大分割放疗的608名患者中占166名(27%,95%CI 23.8–31.1),在接受立体定向体部放疗的582名患者中占162名(28%,95% CI 24.3–31.7),绝对差异为0.5%(95% CI–4.7至5.7,p=0.89)。对于2级及以上不良事件通用术语标准(CTCAE)泌尿生殖系统毒性,604名接受中度大分割放疗的患者中有170名(28%)发生事件,581名接受立体定向体部放疗的患者中有195名(34%)发生事件(p=0.050)。3级CTCAE泌尿生殖系统毒性在接受中度大分割放疗的患者中占3名(<1%),在接受立体定向体部放疗的患者中占3名(1%)。对于2级及以上CTCAE胃肠道毒性,604名接受中度大分割放疗的患者中有60名(10%)发生事件,581名接受立体定向体部放疗的患者中有96名(17%)发生事件(p=0.0011)。3级CTCAE胃肠道毒性在接受中度大分割放疗的患者中占3名(<1%),在接受立体定向体部放疗的患者中占4名(1%)。在早期阶段,共同主要终点——2级及以上RTOG胃肠道毒性在608名接受中度大分割放疗的患者中占69名(11%,95% CI 9.0–14.2),在584名接受立体定向体部放疗的患者中占74名(13%,95% CI 10.2–15.8),绝对差异为1.4%(95% CI –2.5至5.2,p=0.53)。未发生与治疗相关的死亡。
解读:尽管与PACE-B相比,立体定向体部放疗的治疗方案更密集且治疗体积更大,但立体定向体部放疗和中度大分割放疗的早期RTOG毒性发生率相似。
3. Cabozantinib联合阿替利珠单抗治疗转移性前列腺癌(CONTACT-02):一项3期、开放标签、随机试验的最终分析
发表期刊:Lancet Oncol
背景:在雄激素受体通路抑制剂(ARPI)治疗后进展的伴盆腔外软组织转移的转移性去势抵抗性前列腺癌(mCRPC)患者预后较差,治疗选择有限。本研究旨在评估具有免疫调节特性的酪氨酸激酶抑制剂cabozantinib联合PD-L1抑制剂阿替利珠单抗在这些患者中的疗效和安全性。
方法:CONTACT-02是一项开放标签、随机、3期研究,在24个国家(欧洲、北美、亚太地区和拉丁美洲)的184个中心纳入患者。纳入年龄≥18岁、东部肿瘤协作组体能状态评分0或1、确诊mCRPC且存在可测量的盆腔外软组织转移病灶(淋巴结或内脏)、经一种既往雄ARPI治疗后进展的患者。通过基于网络的交互式响应技术系统将患者按1:1随机分配至cabozantinib(40 mg口服,每日一次)联合阿替利珠单抗(1200 mg静脉注射,每3周一次)组或ARPI转换组(阿比特龙1000 mg口服,每日一次联合泼尼松5 mg口服,每日两次,或恩扎卢胺160 mg口服,每日一次),并按是否存在肝转移、既往多西他赛治疗史以及首次ARPI启动时的疾病状态进行分层。双重主要终点为前400名随机分配患者的无进展生存期(意向治疗人群的无进展生存期)和所有随机分配患者的总生存期(意向治疗人群)。在所有接受至少一剂研究治疗的患者中评估安全性。尽管研究仍在进行中(部分患者仍在随访),本分析为方案规定的最终分析。该试验已在ClinicalTrials.gov注册,编号NCT04446117。
结果:2020年8月20日至2023年6月7日,575名患者被随机分配至cabozantinib联合阿替利珠单抗组(289人)或ARPI转换组(286人)。中位随访11.8个月(IQR 9.9–19.3)时,cabozantinib联合阿替利珠单抗组的无进展生存期显著优于ARPI转换组(中位6.3个月[95% CI 6.2–8.8]vs 4.2个月[3.7–5.7];风险比[HR]=0.65[95% CI 0.50–0.84],p=0.0007)。中位随访23.1个月(IQR 17.4–30.5)时,cabozantinib联合阿替利珠单抗组与ARPI转换组的总生存期无显著差异(中位14.8个月[95% CI 13.4–16.7] vs 15.0个月[13.0–18.5];HR=0.89 [95% CI 0.72–1.10],p=0.30,见图1)。cabozantinib联合阿替利珠单抗组284名患者中有158名(56%)发生任何原因的3–4级不良事件,ARPI转换组284名患者中有74名(26%)发生;cabozantinib联合阿替利珠单抗组最常见的为高血压(284名患者中24名,8%)和贫血(23名,8%),ARPI转换组最常见的为贫血(284名患者中18名,6%)。cabozantinib联合阿替利珠单抗组284名患者中有45名(16%)发生被认为与治疗相关的严重不良事件,ARPI转换组284名患者中有11名(4%)发生;cabozantinib联合阿替利珠单抗组最常见的为腹泻(284名患者中5名,2%),ARPI转换组最常见的为丙氨酸转氨酶升高(284名患者中2名,1%)。任何原因导致的不良事件导致停药的比例在cabozantinib联合阿替利珠单抗组284名患者中为49名(17%),在ARPI转换组284名患者中为42名(15%)。未发生与治疗相关的死亡。
解读:Cabozantinib联合阿替利珠单抗是一种不直接靶向雄激素受体信号的新型药物组合,可能成为经ARPI治疗后进展的伴软组织转移的mCRPC患者的有效治疗选择。
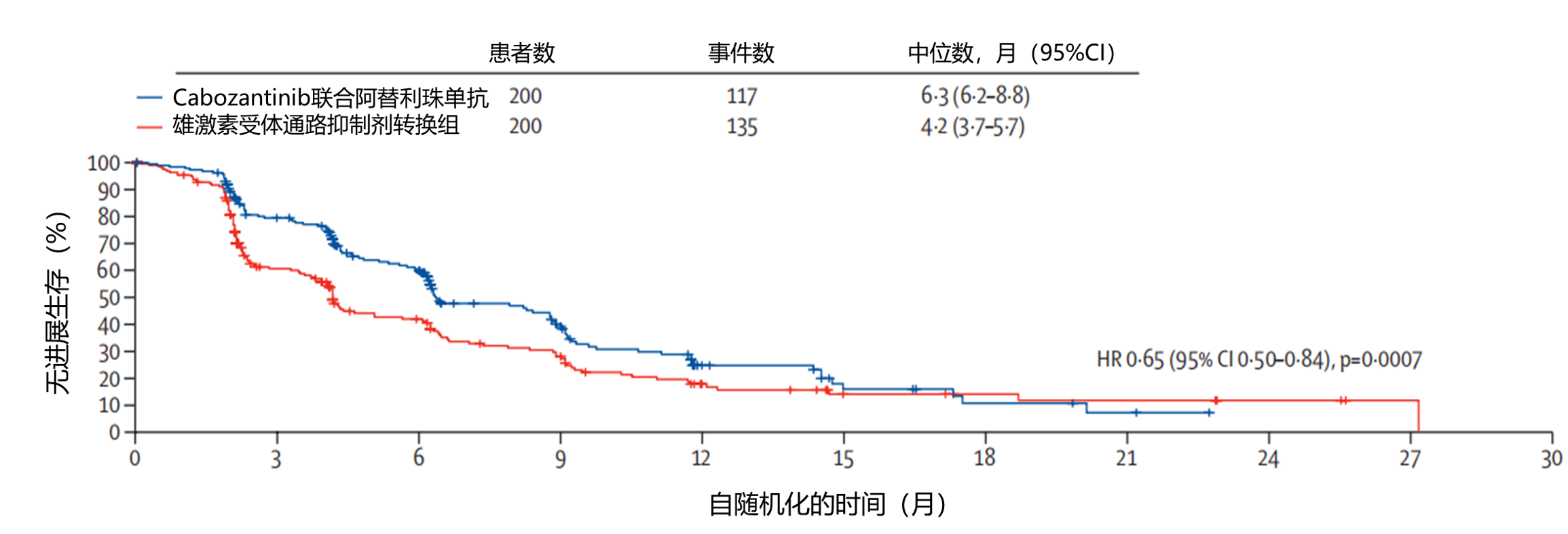
图1.cabozantinib联合阿替利珠单抗组和ARPI转换组无进展生存
4. 二甲双胍用于开始雄激素剥夺治疗的转移性前列腺癌患者:STAMPEDE平台方案的3期随机试验
发表期刊:Lancet Oncol
背景:二甲双胍是一种广泛使用的抗糖尿病药物。多项研究表明,二甲双胍在包括前列腺癌在内的一些恶性肿瘤中具有抗癌活性。二甲双胍还可能减轻雄激素剥夺治疗(ADT)的不良代谢效应。我们假设,二甲双胍可能改善转移性激素敏感性前列腺癌患者的生存期,并减少与雄激素剥夺治疗相关的代谢并发症。
方法:STAMPEDE是一项多臂、多阶段、3期随机试验,纳入通过同位素骨扫描和CT扫描等常规影像学检查分期为高风险局部晚期或转移性前列腺腺癌的患者。本研究报告STAMPEDE最新研究的结果,即在非糖尿病(糖化血红蛋白[HbA1c]<48 mmol/mol[相当于<6.5%])、肾功能良好(肾小球滤过率≥45 ml/min/1.73 m²)且WHO体能状态0–2的转移性疾病患者中,在标准治疗基础上加用二甲双胍的效果。该试验在英国和瑞士的112家医院根据STAMPEDE方案招募患者。患者按1:1随机分配至标准治疗组或标准治疗联合二甲双胍(850mg每日两次)组。随机分配通过电话进行,采用包含20%随机因素的最小化法(由伦敦大学学院MRC临床试验单位开发和维护),并按随机分配医院、年龄(<70岁 vs ≥70岁)、WHO体能状态(0 vs 1或2)、雄激素剥夺治疗类型、阿司匹林或非甾体抗炎药(NSAIDs)长期规律使用情况(是vs否)、盆腔淋巴结状态(阳性vs阴性)、计划放疗(是vs否)以及计划使用多西他赛或雄激素受体通路抑制剂(ARPI)情况(多西他赛vs阿比特龙、恩扎卢胺或阿帕他胺vs均不使用)进行分层。标准治疗包括雄激素剥夺治疗联合或不联合放疗、联合或不联合多西他赛或ARPI。主要结局指标为总生存期,定义为从随机分配至任何原因死亡的时间,在意向治疗人群中评估。在开始治疗的患者中评估安全性。该试验已在ClinicalTrials.gov注册(NCT00268476)和ISRCTN注册(ISRCTN78818544)。
结果:2016年9月5日至2023年3月31日,1874名转移性疾病患者被随机分配至标准治疗组(938人)或标准治疗联合二甲双胍组(936人)。患者中位年龄69岁(IQR 63–73),中位PSA为84ng/mL(24–352)。1874名患者中,1758名(94%)为新诊断的转移性疾病,116名(6%)为异时复发性疾病。1874名患者中,1543名(82%)接受雄激素剥夺治疗联合多西他赛,52名(3%)接受阿比特龙、恩扎卢胺或阿帕他胺。至最近病例报告表随访的中位时间为60个月(IQR 49–72)。如图2所示,标准治疗组报告473例死亡,中位生存期为61.8个月(IQR 29.7至未达到)。二甲双胍组报告453例死亡,中位生存期为67.4个月(32.5至未达到;HR=0.91,95% CI 0.80–1.03;p=0.15)。标准治疗组938名患者中487名(52%)报告3级及以上不良事件,标准治疗联合二甲双胍组921名患者中523名(57%)报告3级及以上不良事件。标准治疗组61名(7%)患者和标准治疗联合二甲双胍组84名(9%)患者报告至少1次3级及以上胃肠道不良事件;其他所有身体系统的3级不良事件发生率无差异。标准治疗组有6例与药物相关的死亡,标准治疗联合二甲双胍组有1例。
解读:在转移性激素敏感性前列腺癌的总体患者人群中,我们未发现标准治疗基础上加用二甲双胍能显著改善总生存期的证据。二甲双胍的副作用谱符合预期,主要为腹泻。与标准治疗组相比,二甲双胍组雄激素剥夺治疗的不良代谢副作用显著减少。
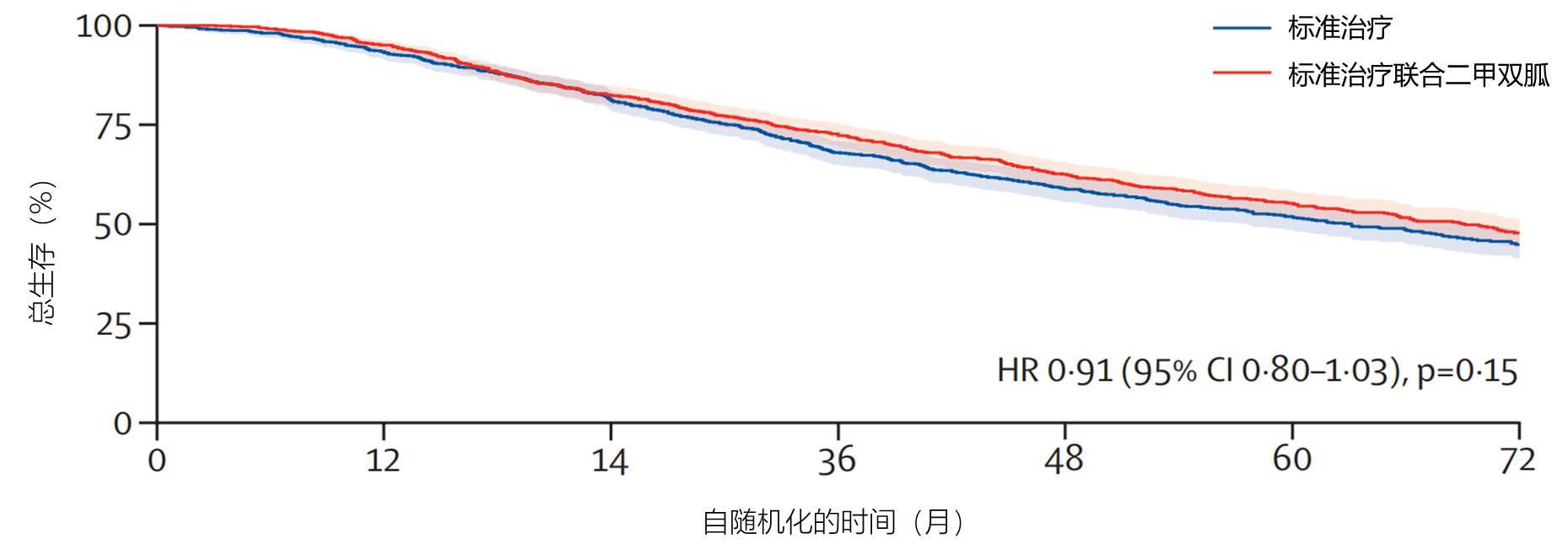
图2.标准治疗组和二甲双胍组的总生存
5. 接受达罗他胺或安慰剂联合多西他赛及雄激素剥夺治疗的转移性激素敏感性前列腺癌患者的进展后生存期:3期ARASENS试验的事后分析
发表期刊:Eur Urol
背景与目的:在ARASENS试验(NCT02799602)中,达罗他胺+多西他赛+雄激素剥夺治疗(ADT)较多西他赛+雄激素剥夺治疗显著改善总生存期(OS)并延缓疾病进展时间。本研究报告患者接受的后续抗肿瘤治疗及研究治疗停药后的相关总生存期数据。
方法:患者按1:1随机分配至达罗他胺(600 mg口服,每日两次)组或安慰剂组,两组均联合多西他赛+雄激素剥夺治疗。治疗停药后,患者进入随访期,期间收集后续治疗和生存信息。采用Kaplan-Meier法估算进展后总生存期(从首次后续治疗开始至死亡的时间),并通过多变量Cox回归分析进行比较。
主要发现与局限性:在1305名接受治疗的患者中,达罗他胺组651名患者中的315名和安慰剂组654名患者中的495名进入随访期,其中分别有57%和76%的患者接受了后续治疗。达罗他胺组中,首次后续治疗为雄激素受体通路抑制剂(ARPI)的占63%,为紫杉烷类药物的占29%,相应的进展后中位总生存期相似(13个月 vs 11个月;风险比[HR]=1.25,95%置信区间[CI]=0.50–3.09)。安慰剂组中,首次后续治疗为ARPI的占78%,为紫杉烷类药物的占19%,紫杉烷类药物亚组的总生存期较ARPI亚组更差(14个月 vs 23个月;HR=3.18,95% CI=1.56–6.50)。这些分析的主要局限性是其为事后分析性质。
结论与临床意义:对于ARASENS试验中未接受达罗他胺且未使用过ARPI的患者,后续接受ARPI治疗的进展后生存期长于紫杉烷类药物治疗,但总生存期仍短于达罗他胺组。进展后治疗决策应考虑疾病负荷和具有不同作用机制的药物。
肾癌
6. 贝伐珠单抗联合厄洛替尼治疗遗传性和散发性乳头状肾癌
发表期刊:N Engl J Med
背景:遗传性平滑肌瘤病和肾细胞癌(HLRCC)是一种由延胡索酸水合酶基因种系致病性变异引起的遗传性疾病,患者发生乳头状肾细胞癌的风险增加。目前对于晚期HLRCC相关乳头状肾细胞癌尚无有效的治疗方法,大多数患者死于疾病进展。
方法:在这项开放标签、2期研究中,我们评估贝伐珠单抗(10 mg/kg,每2周一次)联合厄洛替尼(150 mg,每日一次)治疗晚期HLRCC相关或散发性乳头状肾细胞癌患者的疗效。主要终点为总缓解率;次要终点包括无进展生存期和总生存期。
结果:共纳入43名HLRCC相关乳头状肾细胞癌患者和40名散发性乳头状肾细胞癌患者。31名(72%;95%置信区间[CI]57–83)HLRCC相关乳头状肾细胞癌患者获得确认缓解;中位无进展生存期为21.1个月(95% CI 15.6–26.6,见图3),中位总生存期为44.6个月(95% CI 32.7至无法估算,见图4)。14名(35%;95% CI 22–51)散发性乳头状肾细胞癌患者获得确认缓解,中位无进展生存期为8.9个月(95% CI 5.5–18.3),中位总生存期为18.2个月(95% CI 12.6–29.3)。最常见的治疗相关不良事件为痤疮样皮疹(93%)、腹泻(89%)和蛋白尿(78%)。最常见的3级及以上治疗相关不良事件为高血压(34%)和蛋白尿(17%)。
结论:贝伐珠单抗联合厄洛替尼在HLRCC相关或散发性乳头状肾细胞癌患者中显示出抗肿瘤活性。毒性反应与该联合方案已知的不良反应一致。
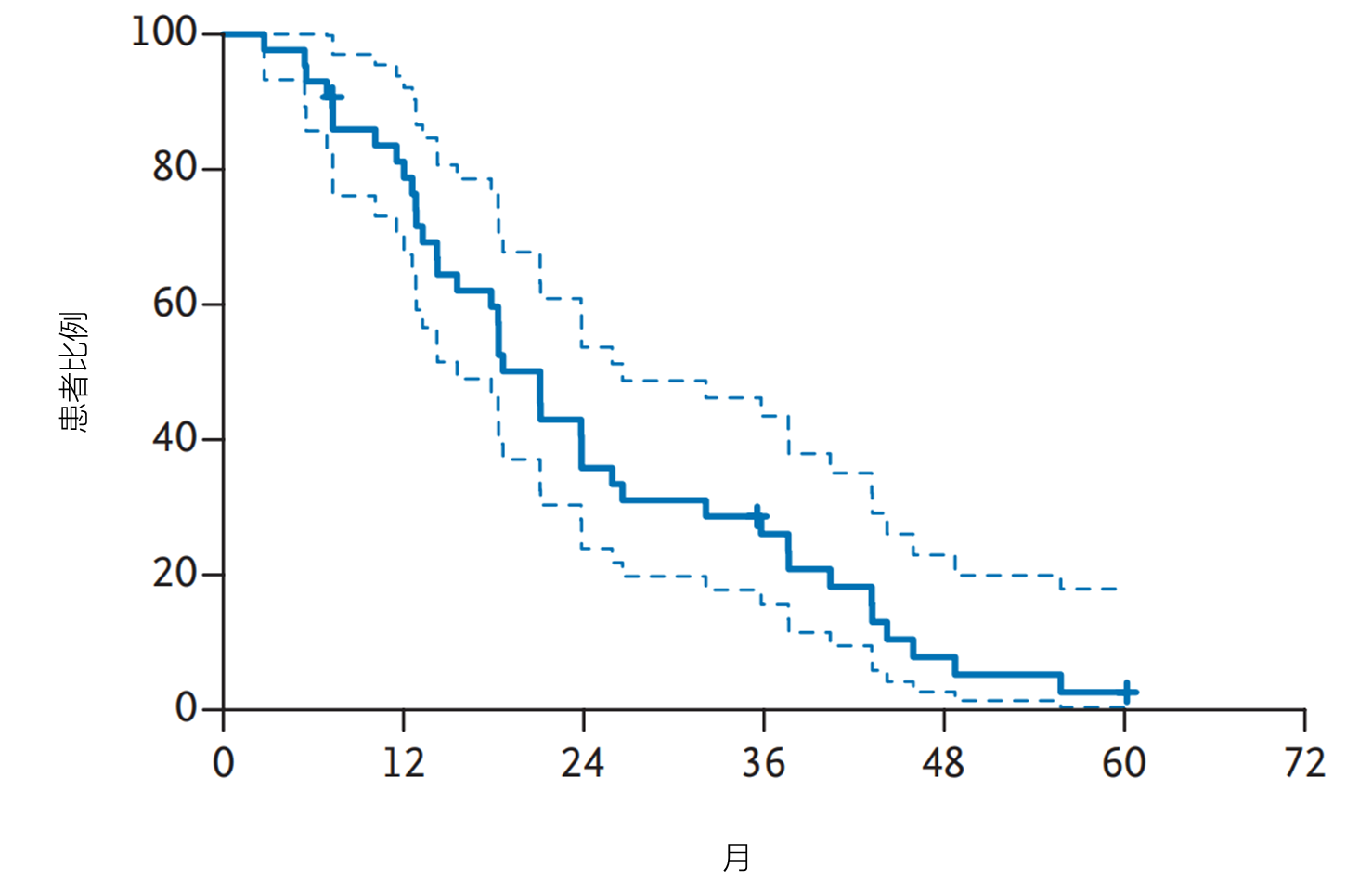
图3.患者的中位无进展生存
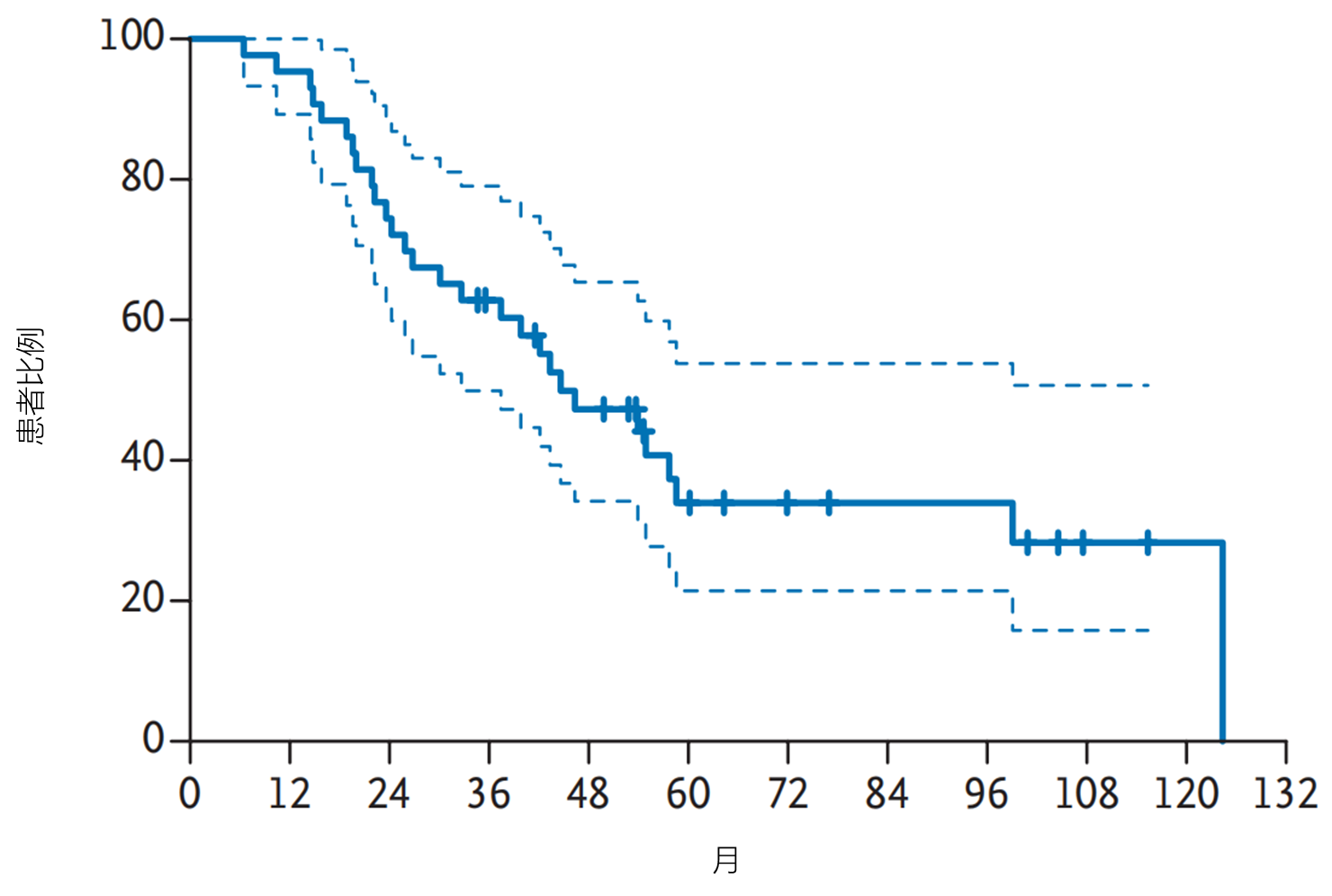
图4.患者的总生存
7. 晚期非透明细胞肾细胞癌的一线治疗:系统评价与荟萃分析
发表期刊:JAMA Oncol
重要性:非透明细胞肾细胞癌(nccRCCs)因其异质性和在临床试验中代表性有限而带来诸多挑战。了解免疫治疗与靶向治疗联合应用对这些亚型的益处对于改善患者结局至关重要。
目的:评估各种一线免疫治疗联合方案和靶向治疗在转移性非透明细胞肾细胞癌治疗中的疗效。
数据来源:从数据库建立至2024年12月31日,在PubMed、Embase和Cochrane图书馆数据库进行系统文献检索,使用相关关键词和医学主题词。
研究选择:纳入涉及非透明细胞肾细胞癌患者、报告基于免疫检查点抑制剂(ICI)的治疗、并提供客观缓解率(ORR)、无进展生存期(PFS)、总生存期(OS)和疾病控制率(DCR)数据的研究。
数据提取与合成:两名独立评审员提取数据,分歧由第三位专家解决。采用纽卡斯尔-渥太华量表评估观察性研究的质量。进行随机效应荟萃分析,并使用I²统计量评估异质性。
主要结局与测量指标:主要关注的结局为客观缓解率、无进展生存期、总生存期和疾病控制率。
结果:分析纳入23项研究,涵盖多种非透明细胞肾细胞癌亚型。汇总结果显示,非透明细胞肾细胞癌治疗的客观缓解率为26.6%,疾病控制率为57.8%。中位无进展生存期为6.59个月,中位总生存期为21.11个月。免疫检查点抑制剂在非透明细胞肾细胞癌中显示出显著疗效,在不同亚型中均表现出明显的临床活性。尽管免疫检查点抑制剂单药治疗具有一定效果,但联合治疗的临床结局更优。
结论与意义:本系统评价和荟萃分析发现,免疫检查点抑制剂(尤其是与靶向治疗联合时)在转移性非透明细胞肾细胞癌治疗中显示出良好疗效。这些发现支持将其纳入治疗指南,并强调个体化治疗策略的重要性。未来研究应关注长期结局、安全性特征以及生物标志物的识别,以优化患者选择并改善结局。
8. 嫌色细胞肾细胞癌中抗肿瘤免疫受损的肿瘤内在和微环境决定因素
发表期刊:J Clin Oncol
目的:尽管免疫检查点抑制剂(ICI)已改变许多晚期肾细胞癌(RCCs)的治疗模式,但嫌色细胞肾细胞癌(ChRCC)和肾嗜酸细胞瘤的有效抗肿瘤免疫决定因素仍是未满足的临床和科学需求。
方法:对嫌色细胞肾细胞癌和肾嗜酸细胞瘤患者的肿瘤及邻近正常组织进行单细胞转录组学和T细胞受体谱分析。使用机器学习评估肾嗜酸细胞瘤的细胞起源,并分析相关致癌通路。采用免疫组织化学方法,比较肾嗜酸细胞瘤与透明细胞肾细胞癌(ccRCC)的免疫浸润情况。比较嫌色细胞肾细胞癌与透明细胞肾细胞癌的免疫检查点表达、克隆扩增和肿瘤特异性。利用国际转移性肾细胞癌数据库联盟数据集,比较接受一线全身治疗的转移性嫌色细胞肾细胞癌(mChRCC)患者与透明细胞肾细胞癌患者的临床结局。
结果:我们证实α-闰细胞是肾嗜酸细胞瘤的细胞起源。我们发现嫌色细胞肾细胞癌中HLA I类分子下调,且富集包括哺乳动物雷帕霉素靶蛋白和铁死亡在内的潜在可靶向通路。嫌色细胞肾细胞癌的肿瘤微环境显示免疫浸润显著减少,尤其是肿瘤浸润性CD8+T细胞明显耗竭。嫌色细胞肾细胞癌浸润的CD8+T细胞表现出免疫检查点表达降低、克隆扩增减弱和肿瘤特异性降低。临床分析发现,接受免疫治疗的转移性嫌色细胞肾细胞癌患者生存率显著较差。
结论:嫌色细胞肾细胞癌的免疫基因组分析显示T细胞显著耗竭,其免疫表型以缺乏免疫检查点表达和肿瘤特异性差为特征,表明这些肿瘤中少量的T细胞可能是无特异性的旁观者细胞。这种“免疫冷”微环境阻碍了对免疫治疗的有效应答,强调需要针对嫌色细胞肾细胞癌设计旨在改善肿瘤特异性T细胞浸润微环境的个性化治疗。
尿路上皮癌
9. 阿替利珠单抗联合个性化新抗原疫苗治疗尿路上皮癌:1期试验
发表期刊:Nat Cancer
限制性适应性免疫特征和高新抗原负荷与对免疫检查点抑制剂(ICIs)的应答相关。为刺激抗肿瘤免疫,我们评估阿替利珠单抗(抗程序性死亡蛋白1配体1)联合个性化新抗原疫苗PGV001在尿路上皮癌患者中的应用。主要终点为可行性(定义为新抗原识别、肽合成、疫苗生产时间和疫苗接种)和安全性。次要终点包括转移性患者的客观缓解率、缓解持续时间和无进展生存期,辅助治疗患者的疾病进展时间,总生存期以及疫苗诱导的新抗原特异性T细胞免疫。在12名入组患者中,10名成功制备疫苗(中位20.3周)。所有开始治疗的患者均完成初始接种周期。最常见的治疗相关不良事件为1级注射部位反应、疲劳和发热。中位随访39个月时,4名接受辅助治疗的患者中3名无复发,5名接受转移性治疗且有可测量疾病的患者中2名达到客观缓解(见图5)。所有患者均表现出治疗期间新抗原特异性T细胞应答的出现。新抗原疫苗联合免疫检查点抑制剂具有可行性和安全性,达到了其终点,值得进一步研究。
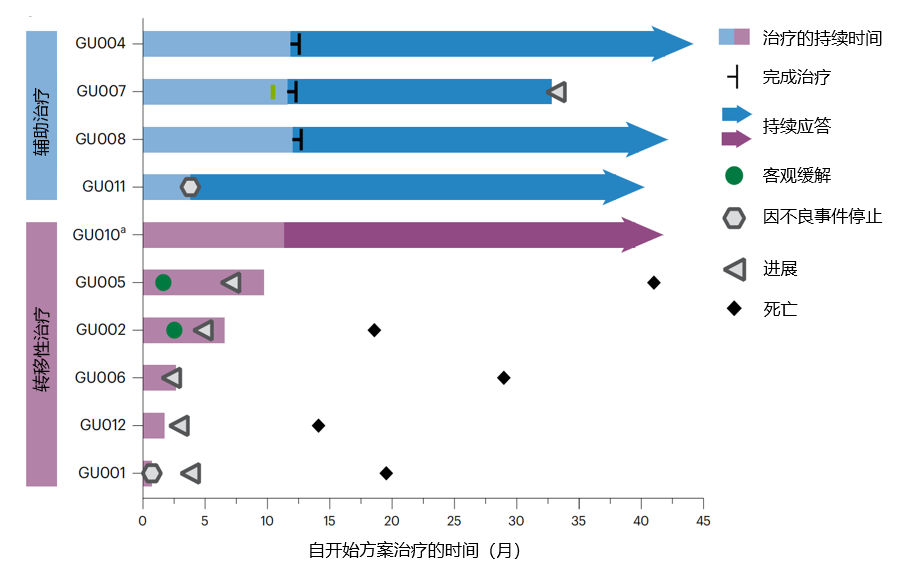
图5.辅助治疗或转移性治疗参与者的临床结果游泳图
10. Avelumab一线维持治疗晚期尿路上皮癌:JAVELIN Bladder 100试验中非内脏转移或仅淋巴结转移患者的长期结局
发表期刊:Eur Urol
在JAVELIN Bladder 100随机3期试验中,对于一线铂类化疗(PBC)后未进展的晚期尿路上皮癌(aUC)患者,avelumab一线维持治疗联合最佳支持治疗(BSC)较单纯最佳支持治疗显著延长总生存期(OS;主要终点)和无进展生存期(PFS)。本研究报告对铂类化疗开始时为非内脏转移(包括骨转移)或随机分配时为仅淋巴结转移亚组的探索性分析。在非内脏转移患者(n=318)中,avelumab组与对照组的中位总生存期分别为31.4个月和17.1个月(风险比[HR]=0.60[95% 置信区间{CI}=0.45–0.79],见图6);在仅淋巴结转移患者(n=102)中,分别为31.9个月和22.7个月(HR=0.86[95% CI=0.51–1.47])。在非内脏转移患者中,无论对铂类化疗的应答如何或接受的铂类化疗方案如何,avelumab均延长总生存期。所有亚组的无进展生存期分析均支持avelumab优于对照组。各亚组的avelumab相关不良事件发生率相似。局限性包括样本量小和分析的探索性。总体而言,探索性分析表明,对于一线铂类化疗后未进展、伴非内脏转移或仅淋巴结转移的晚期尿路上皮癌患者,avelumab维持治疗有效且毒性可控。
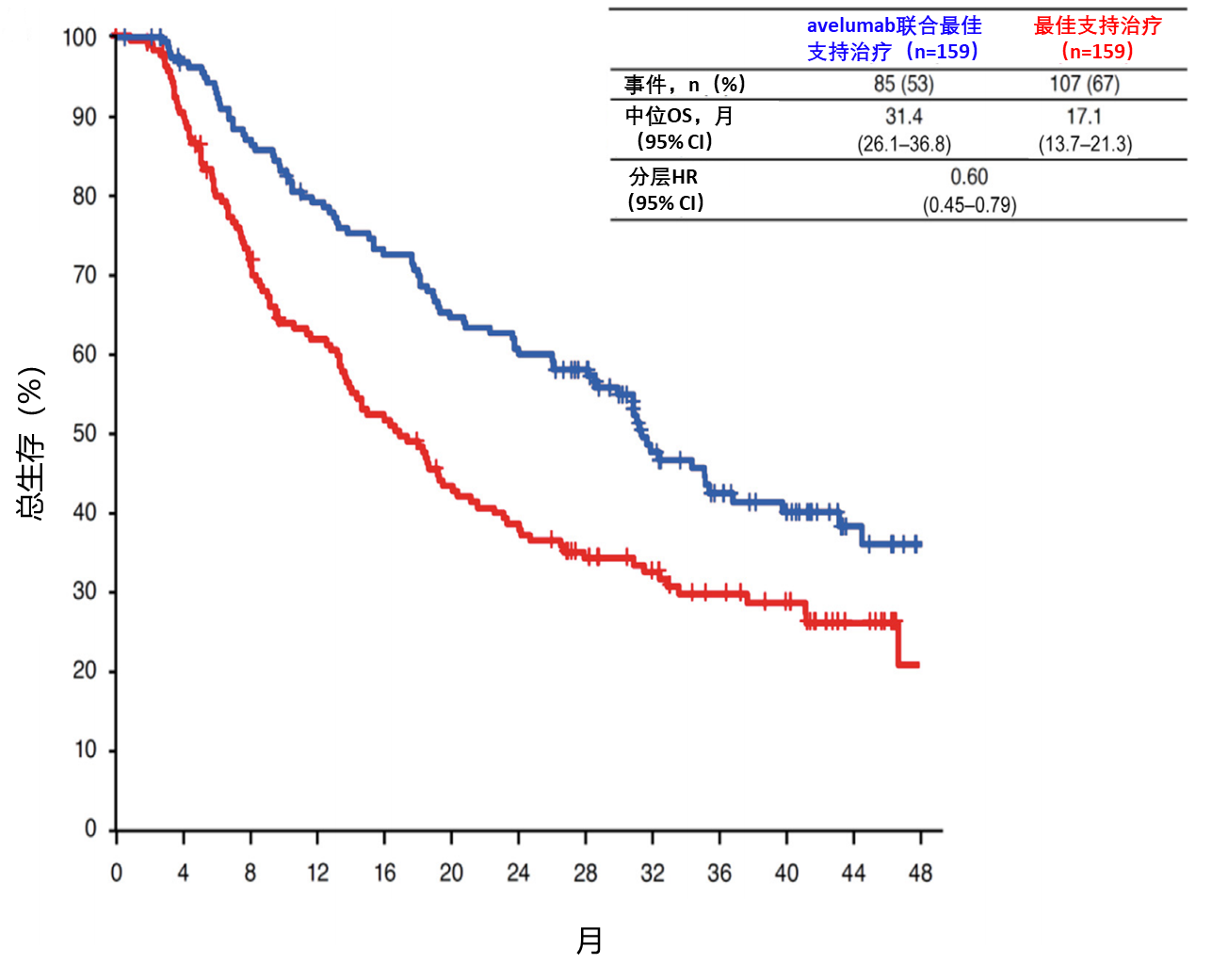
图6.avelumab组与对照组的中位总生存期
参考文献
- Burdett S, Fisher DJ, Tierney JF, et al; DADSPORT Meta-analysis Collaboration. Duration of Androgen Suppression with Postoperative Radiotherapy (DADSPORT) for Nonmetastatic Prostate Cancer: A Collaborative Systematic Review and Meta-analysis of Aggregate Data[J]. Eur Urol. 2025 Jun 25:S0302-2838(25)00291-X.
- Tree AC, Hinder V, Chan A, et al; PACE Investigators. Intensity-modulated moderately hypofractionated radiotherapy versus stereotactic body radiotherapy for prostate cancer (PACE-C): early toxicity results from a randomised, open-label, phase 3, non-inferiority trial[J]. Lancet Oncol. 2025 Jul;26(7):936-947.
- Agarwal N, Azad AA, Carles J, et al. Cabozantinib plus atezolizumab in metastatic prostate cancer (CONTACT-02): final analyses from a phase 3, open-label, randomised trial[J]. Lancet Oncol. 2025 Jul;26(7):860-876.
- Gillessen S, Murphy L, James ND, et al; STAMPEDE investigators. Metformin for patients with metastatic prostate cancer starting androgen deprivation therapy: a randomised phase 3 trial of the STAMPEDE platform protocol[J]. Lancet Oncol. 2025 Jul 7:S1470-2045(25)00231-1.
- Grimm MO, Smith M, Hussain M, et al. Postprogression Survival of Patients with Metastatic Hormone-sensitive Prostate Cancer who Received Darolutamide or Placebo in Combination with Docetaxel and Androgen Deprivation Therapy: Post Hoc Analysis of the Phase 3 ARASENS Trial[J]. Eur Urol. 2025 Jun 20:S0302-2838(25)00340-9.
- Srinivasan R, Gurram S, Singer EA, et al. Bevacizumab and Erlotinib in Hereditary and Sporadic Papillary Kidney Cancer[J]. N Engl J Med. 2025 Jun 19;392(23):2346-2356.
- Petrelli F, Verri E, Ghidini A, et al. First-Line Therapy For Advanced Non-Clear Cell Renal Cell Carcinoma: A Systematic Review and Meta-Analysis[J]. JAMA Oncol. 2025 Jul 3:e251891.
- Labaki C, Saad E, Madsen KN, et al. Tumor-Intrinsic and Microenvironmental Determinants of Impaired Antitumor Immunity in Chromophobe Renal Cell Carcinoma[J]. J Clin Oncol. 2025 Jul 2:JCO2500234.
- Saxena M, Anker JF, Kodysh J, et al. Atezolizumab plus personalized neoantigen vaccination in urothelial cancer: a phase 1 trial. Nat Cancer. 2025 Jun;6(6):988-999.
- Bellmunt J, Powles T, Park SH, et al. Avelumab First-line Maintenance for Advanced Urothelial Carcinoma: Long-term Outcomes from the JAVELIN Bladder 100 Trial in Patients with Nonvisceral or Lymph Node-only Disease[J]. Eur Urol. 2025 Jun 3:S0302-2838(25)00295-7.



