
简要介绍
前列腺癌
1. N Engl J Med:欧洲前列腺癌筛查研究——23年随访结果
2. JAMA Oncol:筛状结构阳性与阴性前列腺癌的主动监测、手术和放疗效果比较——基于PROTECT随机临床试验的二次分析
3. J Clin Oncol:二甲双胍用于低风险前列腺癌主动监测的临床试验
4. Ann Oncol:卡匹色替联合阿比特龙治疗PTEN缺陷型转移性激素敏感前列腺癌:CAPItello-281 III期研究
5. Nat Med:尼拉帕利联合醋酸阿比特龙和泼尼松治疗HRR缺陷型转移性去势敏感性前列腺癌:一项随机3期试验
6. Lancet Oncol:阿贝西利联合阿比特龙治疗转移性去势抵抗性前列腺癌患者(CYCLONE 2):一项随机、双盲、安慰剂对照的3期试验
肾癌
7. Ann Oncol:基于帕博利珠单抗的新型疗法作为晚期透明细胞肾细胞癌的一线治疗:开放标签、伞式平台I/II期KEYMAKER-U03试验的03A子研究
8. Ann Oncol:仑伐替尼联合依维莫司对比卡博替尼治疗PD-1免疫检查点抑制剂治疗后进展的转移性透明细胞肾细胞癌:一项多中心随机II期试验(LenCabo)
膀胱癌
9. Ann Oncol:ALBAN (GETUG-AFU 37):比较静脉注射阿替利珠单抗联合膀胱内注射卡介苗与单纯卡介苗治疗卡介苗初治高危非肌层浸润性膀胱癌(NMIBC)的III期、随机、开放标签、国际多中心临床试验
10. Lancet:度伐利尤单抗联合卡介苗治疗卡介苗初治的高危非肌层浸润性膀胱癌(POTOMAC):一项随机、开放标签3期试验的最终分析
前列腺癌
1. 欧洲前列腺癌筛查研究——23年随访结果
发表期刊:N Engl J Med
背景及目的:预计到2040年,由于预期寿命延长和人口增长,全球前列腺癌死亡率将翻一番。因此,通过早期发现和治疗来应对这一负担仍是公共卫生优先事项。欧洲前列腺癌筛查随机研究(ERSPC)于1993年启动,旨在评估基于人群的前列腺特异性抗原(PSA)筛查对前列腺癌死亡率的影响。随着预期寿命延长和人口增长,全球前列腺癌死亡病例预计将持续上升,因此对前列腺癌筛查长期结果进行最终分析,对理解PSA检测的利弊至关重要。
方法:ERSPC是一项于1993年在荷兰与比利时启动的多中心随机研究,研究范围覆盖欧洲八国。瑞典、芬兰、意大利、西班牙和瑞士的研究中心在1994至1998年间陆续加入,随后两个法国研究中心也分别于2000年及2003年加入该研究。除芬兰外,其余地区均按1:1的比例进行随机分组。在芬兰,每年固定有8000名男性被随机分配至筛查组,其余人员则构成对照组,最终形成约1:1.5的分组比例。本次分析共纳入162,236例男性受试者,其中72,888人被分配至筛查组,89,348人被分配至对照组。该研究的主要终点为干预组(由受邀参与筛查的受试者组成)与未接受任何干预的对照组在前列腺癌死亡率方面的差异;次要研究终点为前列腺癌的发病率。研究对象为50至74岁男性,各研究中心在此年龄范围内自行设定具体准入标准,但所有中心均包含预先设定的55至69岁核心年龄组受试者。
主要结果:前列腺癌发病率:随机分组23年后的随访数据显示:累计前列腺癌发病率在筛查组为14%,对照组为12%,总体风险比(RR)为1.30(95%CI:1.26-1.33)(图1)。男性绝对超额发病率为27/1000例。按诊断时的风险等级进行分层分析显示,低风险组RR为2.14(95%CI:2.04-2.25),中风险组RR为1.10(95%CI:1.04-1.17),高风险组RR为0.95(95%CI:0.89-1.01),晚期前列腺癌组RR为0.66(95%CI:0.60-0.74)。
前列腺癌死亡率:随机分组23年后的随访数据显示:累计前列腺癌死亡率在筛查组为1.4%,对照组为1.6%,总体RR为0.87(95%CI:0.80-0.95)(图2)。经未参与筛查情况校正后,至少参加一轮筛查的男性RR为0.84(95%CI:0.76-0.92)。包含法国研究中心的敏感性分析显示,中位随访17年后 RR为0.84(95%CI:0.76-0.93),这与既往基于相似随访时长发表的结果一致。前列腺癌死亡绝对风险降低值为0.22%(95%CI:0.10-0.34)。两组随机分组23年后累计其他原因死亡率均为49%(RR=1.00;95%CI:0.98-1.01)(图3)。
结论:ERSPC主要结局指标的最终分析结果强调,长期随访数据对评估前列腺癌筛查效果具有关键意义。尽管本研究证实基于PSA的筛查有利于降低前列腺癌死亡率,并在延长随访期后呈现出更优的获益风险比,但相关的过度诊断和不必要干预风险仍不容忽视。未来的筛查策略应聚焦于风险分层方法,在保持临床获益的同时最大限度降低这些潜在危害。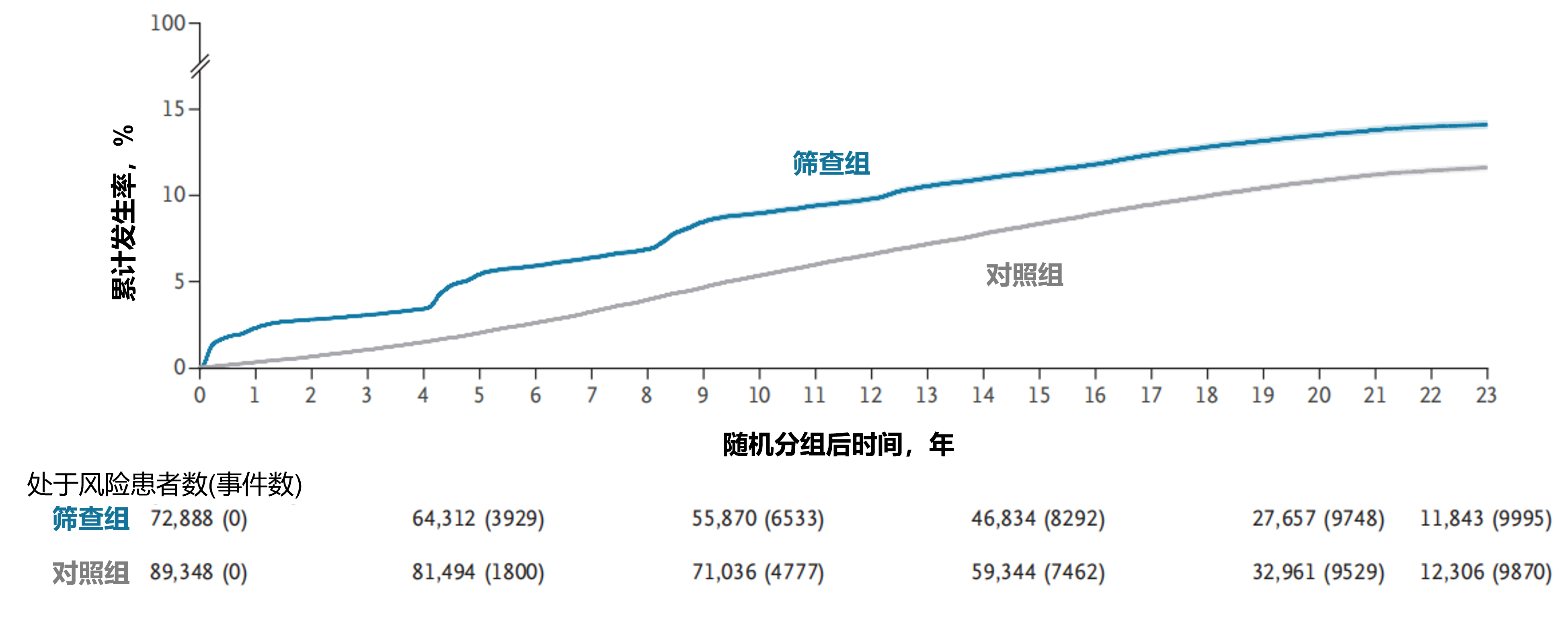
图1. 随机分组23年后的前列腺癌确诊发病率
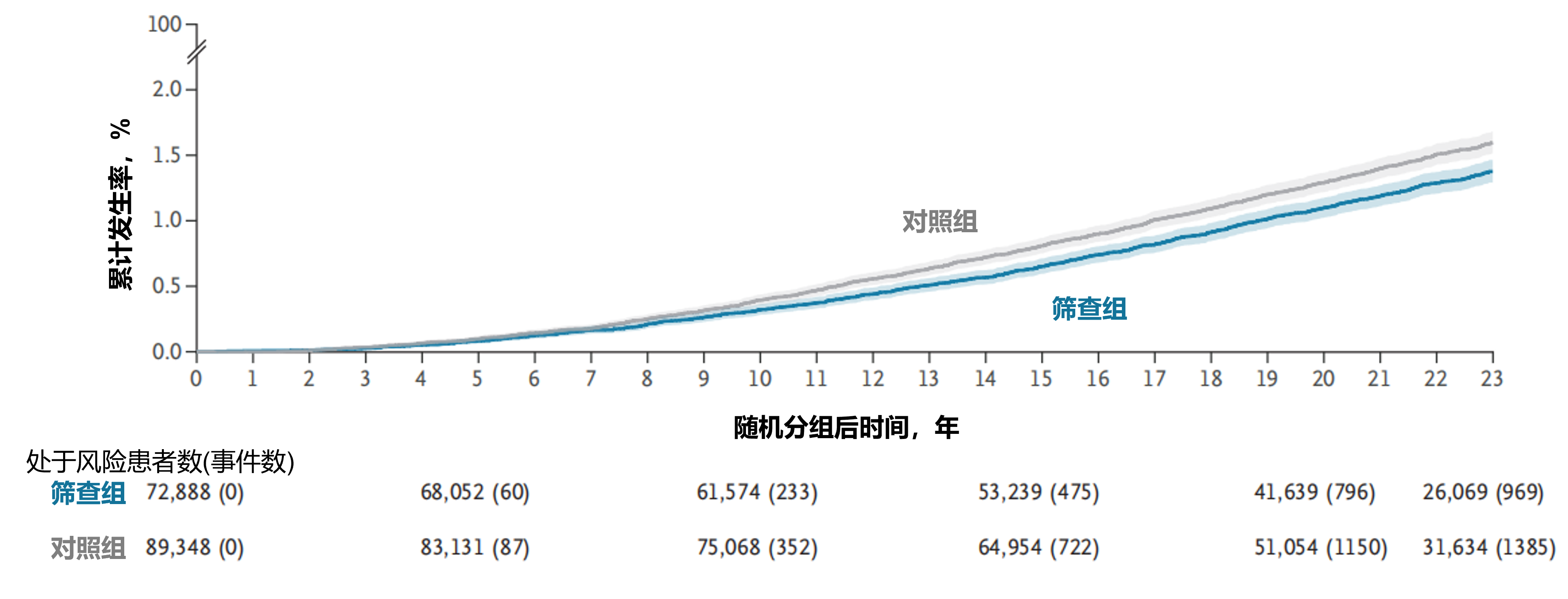
图2. 随机分组23年后的前列腺癌特异性死亡率
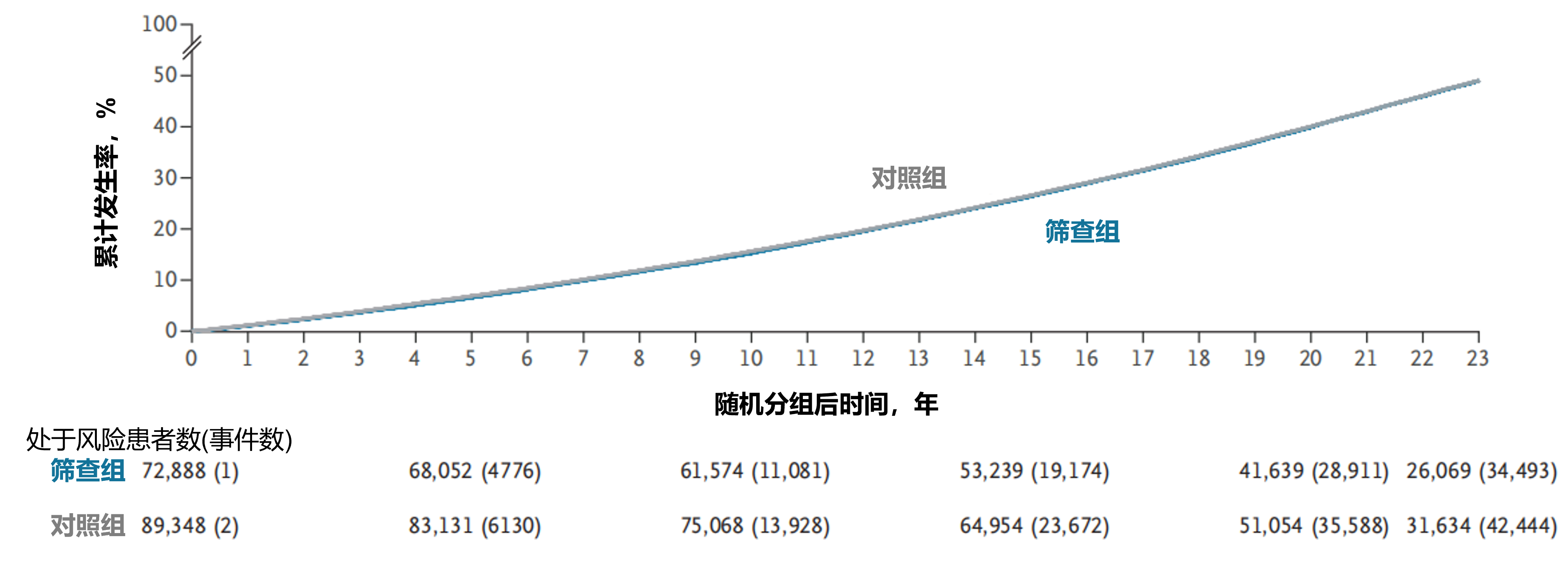
图3. 随机分组23年后的前列腺癌其他原因死亡率
2. 筛状结构阳性与阴性前列腺癌的主动监测、手术和放疗效果比较——基于PROTECT随机临床试验的二次分析
发表期刊:JAMA Oncol
背景及目的:手术治疗与放射治疗是前列腺癌主要根治性治疗选择,而主动监测则旨在避免对惰性肿瘤的过度治疗。尽管PROTECT试验中三种方案的长期前列腺癌特异性生存率相当,但早期根治性治疗使转移风险降低一半,这表明需要更精准地识别能从早期干预中获益的患者。越来越多研究证实,筛状结构是前列腺癌不良预后的预测因子,但PROTECT试验既往未对该指标进行分析。因此,在缺乏随机数据的情况下,筛状结构阳性与阴性患者分别接受早期治疗与主动监测的获益差异仍不明确。本次对PROTECT随机临床试验结果进行回顾性分析,旨在明确筛状结构阳性与阴性前列腺癌与患者接受主动监测、手术治疗或放疗后15年转移风险之间的关联。
方法:1999年至2009年期间,PROTECT三期随机临床试验共纳入1643例临床局限性前列腺癌患者,这些患者被随机分配接受主动监测、手术治疗或放疗联合新辅助雄激素剥夺治疗(ADT)。在本项针对PROTECT试验的二次分析中,研究人员对现有诊断活检切片进行了中心化病理学复核,若患者存在浸润性筛状癌和/或导管内癌,则将其归类为筛状结构阳性。数据收集时间为2024年1月25日至10月11日,数据分析于2024年10月14日至2025年1月30日期间完成。暴露因素为年龄、前列腺特异性抗原(PSA)、格里森评分及筛状结构状态。
主要结局指标:主要结局指标为疾病进展至转移阶段(经影像学检查证实的骨转移、内脏转移或淋巴结转移,或PSA>100 ng/mL)。研究采用多变量Cox比例风险回归模型,经随机化变量校正后评估15年转移风险,并通过Gray检验比较累积发生率曲线。同时开展了意向治疗人群分析和符合方案集分析。
结果:在意向治疗人群分析中,筛状结构阳性与转移风险显著升高相关(风险比[HR]=3.61,95%CI:1.60-8.11;P=0.003);与主动监测相比,接受新辅助ADT联合放疗可降低转移风险(HR=0.35,95%CI:0.16-0.78;P=0.04),但手术治疗未呈现显著获益(HR=0.52,95%CI:0.25-1.08;P=0.09)(图4A)。在接受手术治疗(26%)和主动监测(25%)的筛状结构阳性患者中,15年累计转移发生率均较筛状结构阴性患者显著更高(两组P值均<0.001),而新辅助ADT联合放疗组的筛状结构阳性患者累计转移发生率为8%,与该组筛状结构阴性患者无显著差异。在筛状结构阴性患者中,不同治疗方式的累计转移发生率无显著性差异(图4B);符合方案集分析观察到相似结果。
结论:本项队列研究的结果表明,筛状结构阳性会使前列腺癌患者发生转移的风险显著升高。虽然手术治疗可以延缓但未能阻止筛状结构阳性患者的转移,但与主动监测相比,新辅助ADT联合放疗可降低长期转移发生率。相反,本研究结果支持对筛状结构阴性前列腺癌患者(包括格里森评分3+4=7的患者)采取主动监测策略。
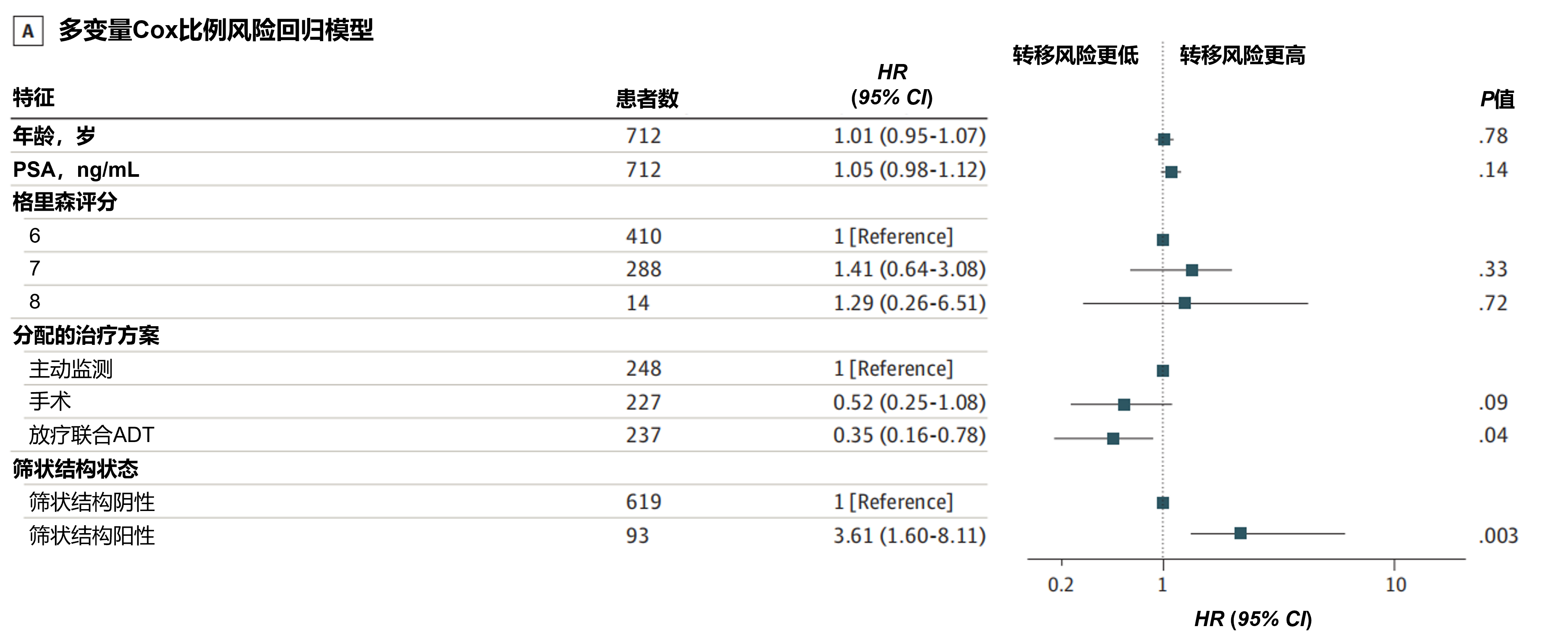
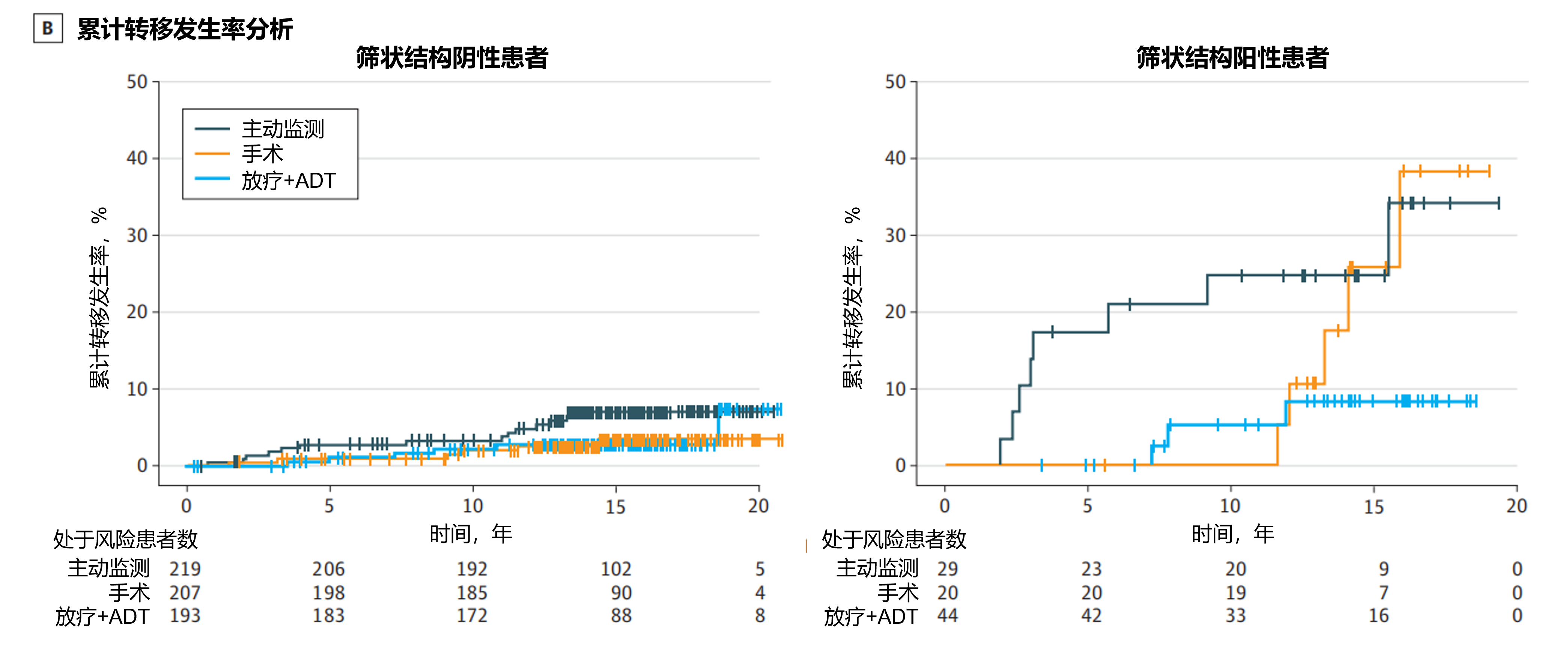
图4. 意向治疗人群的主要结局分析
3. 二甲双胍用于低风险前列腺癌主动监测的临床试验
发表期刊:J Clin Oncol
背景及目的:前列腺癌(PCa)仍是男性最高发的恶性肿瘤之一,其中相当大部分病例在确诊时属于低危局限性病变。对于此类患者,主动监测(AS)已成为标准管理策略。二甲双胍作为一种广泛用于治疗2型糖尿病的双胍类降糖药,其在肿瘤学领域作为潜在辅助疗法的价值日益受到关注。除降糖特性外,该药物对胰岛素信号通路和雷帕霉素靶蛋白信号通路的生物学效应已成为研究重点,这两条通路均与前列腺癌进展相关。临床前研究及流行病学数据表明,二甲双胍可能抑制肿瘤增殖、调节肿瘤微环境并延长某些恶性肿瘤(尤其是前列腺癌)患者的总生存期。针对接受二甲双胍治疗的糖尿病男性患者前列腺癌特异性死亡率下降的观察结果,进一步激发了对其在非糖尿病人群中潜在作用的研究兴趣。本研究报道了一项在III期随机多中心双盲临床试验中,针对选择主动监测的低危前列腺癌患者使用二甲双胍的研究结果,旨在评估二甲双胍对接受主动监测的低危前列腺癌患者疾病进展的抑制作用。
方法:二甲双胍主动监测试验(MAST)是一项多中心、随机、双盲、安慰剂对照的III期临床试验,旨在评估二甲双胍对接受主动监测的低危局限性前列腺癌患者的疗效。研究在2013年11月12日至2023年11月27日期间,共筛查了417例患者,其中408例符合入选标准并被随机分配至各治疗组。符合入选标准的受试者按1:1比例随机分配至二甲双胍组(850mg,每日两次;n=205)或安慰剂组(n=203),随访时间最长达36个月。
研究终点:主要终点为疾病进展时间,其定义为治疗性和/或病理学进展。通过Kaplan-Meier分析和Cox比例风险模型评估无进展生存期(PFS)。
主要结果:在144例出现治疗性或病理学进展的患者中,二甲双胍组为70例,安慰剂组为74例。二甲双胍组和安慰剂组的12个月PFS率分别为94%(95%CI:90%-97%)和96%(95%CI:93%-99%),24个月PFS率分别为62%(95%CI:54%-70%)和69%(95%CI:62%-76%),36个月PFS率分别为58%(95%CI:51%-67%)和60%(95%CI:53%-68%)。Kaplan-Meier生存曲线(图5)显示两组间的疾病进展时间无统计学显著差异(HR=1.09,95%CI:0.79-1.52;对数秩检验P=0.59)。
安全性方面,胃肠道不良反应是最常报告的不良事件,在二甲双胍组中更为常见。具体而言,二甲双胍组有19%的参与者报告腹泻,而安慰剂组为8%;其他胃肠道症状(如恶心、消化不良或腹痛)在二甲双胍使用者中发生率为9%,安慰剂组仅为1%。这些不良事件严重程度通常为轻至中度。两组间的严重不良事件无显著差异,且未记录到乳酸酸中毒病例。
结论:本研究表明,在接受主动监测的低危前列腺癌患者中,联用二甲双胍未能显现延缓疾病进展的疗效。此外,在肥胖男性亚组中观察到潜在不良效应。
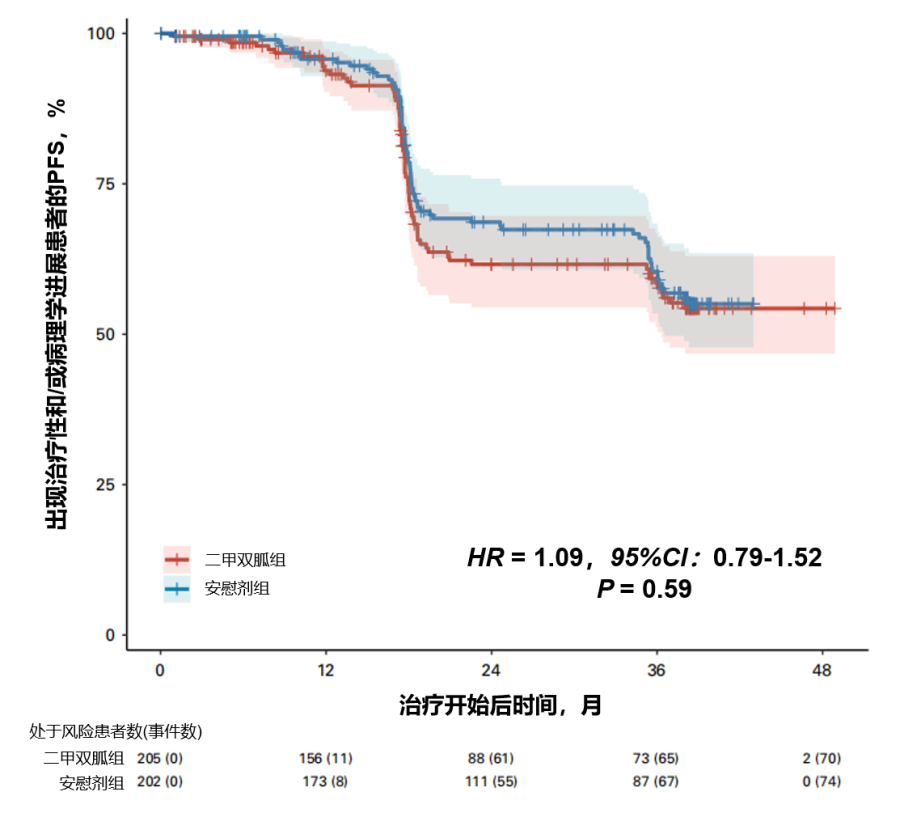
图5. 按治疗组划分的总体PFS(包括病理学进展或治疗性进展)Kaplan-Meier曲线
4. 卡匹色替联合阿比特龙治疗PTEN缺陷型转移性激素敏感前列腺癌:CAPItello-281 III期研究
发表期刊:Ann Oncol
背景及目的:在转移性激素敏感性前列腺癌(mHSPC)中,磷酸酶与张力蛋白同源物(PTEN)缺陷会导致磷酸肌醇3-激酶(PI3K)/蛋白激酶B(AKT)信号通路激活,从而产生不受雄激素受体通路抑制剂(ARPIs)抑制的独立增殖驱动,最终导致不良预后。卡匹色替联合阿比特龙可实现PI3K/AKT和AR信号通路的双重抑制,这有望延缓疾病进展并改善临床结局。然而,目前尚未有针对PTEN缺陷型肿瘤人群专门设计、或在mHSPC背景下评估卡匹色替联合阿比特龙的对比研究报道。CAPItello-281研究(NCT04493853)是一项III期临床试验,旨在评估卡匹色替联合阿比特龙对比安慰剂联合阿比特龙在PTEN缺陷型mHSPC患者中的疗效与安全性。本文报告CAPItello-281研究的主要分析结果(PTEN缺陷阈值设定为≥90%),并对肿瘤活检中PTEN缺陷程度逐步加重(≥95%、≥99%、100%)的亚组进行事后探索性分析。
方法:CAPItello-281是一项全球性、III期、随机、双盲、安慰剂对照的前瞻性研究,旨在评估对于PTEN缺陷型mHSPC患者,在阿比特龙方案基础上联用卡匹色替对比安慰剂的疗效与安全性。研究于2020年7月13日至2024年2月5日期间,从32个国家筛查的6566例患者中,有6201例在筛查时提交了肿瘤组织,通过中心免疫组织化学(IHC)检测进行PTEN状态评估。在这6201例患者中,6003例(96.8%)获得了有效的IHC PTEN检测结果,其中1519例(占6003例的25.3%)为PTEN缺陷型肿瘤(阈值设定为≥90%)。共计1012例患者按1:1比例随机分配至卡匹色替组(400 mg,每日两次,用药4天/停药3天;n=507)或安慰剂组(n=505),两组均联合使用阿比特龙(1000 mg,每日一次)、泼尼松/泼尼松龙及ADT,直至疾病进展、出现不可耐受毒性、撤回知情同意或死亡。
研究终点:主要终点为研究者评估的影像学无进展生存期(rPFS),评估依据包括RECIST 1.1版标准(软组织病灶)和/前列腺癌临床试验工作组3(PCWG3)标准(骨病灶),或在无疾病进展情况下的全因死亡。关键次要疗效终点包括总生存期(OS)、至首次后续治疗时间(TFST)、症状性骨骼事件无生存期(SSE-FS)以及至疼痛进展时间(TTPP)。
主要结果:在具有有效肿瘤检测结果的患者中,25.3%(1519/6003)存在PTEN缺陷型肿瘤。根据预设方案,在观察到398例疾病进展或死亡事件(数据成熟度39.3%)后进行了主要分析。在总体人群中,与安慰剂联合阿比特龙相比,卡匹色替联合阿比特龙显著降低了影像学疾病进展风险(中位rPFS 33.2个月 vs 25.7个月;HR=0.81,95%CI:0.66-0.98,P=0.034;图6)。预设亚组分析表明,在大多数预设亚组中,卡匹色替联合阿比特龙治疗患者的rPFS均优于安慰剂联合阿比特龙组,且无论疾病风险分层及转移肿瘤负荷如何均显示一致获益。在主要分析时,次要终点OS的HR为0.90(95%CI:0.71-1.15,P=0.401),数据成熟度为26.4%。安全性分析集包括503例接受卡匹色替联合阿比特龙治疗的患者,以及503例接受安慰剂联合阿比特龙治疗的患者。在卡匹色替联合阿比特龙组中,最常见的任意级别不良事件为腹泻(51.9%),其次为高血糖(38.0%)和皮疹(35.4%)。
结论:综上所述,在CAPItello-281试验中,对于PTEN缺陷型mHSPC患者,在ADT治疗基础上联合使用卡匹色替与阿比特龙,相较于安慰剂联合阿比特龙,显示出rPFS的统计学显著改善。在次要终点方面也观察到一致的额外肿瘤学获益。卡匹色替联合方案具有可控的安全性特征,与该药物既往报道的安全性数据一致。这些研究结果支持将卡匹色替联合阿比特龙作为AKT与AR双重抑制的靶向治疗方案,用于PTEN缺陷型mHSPC的治疗。
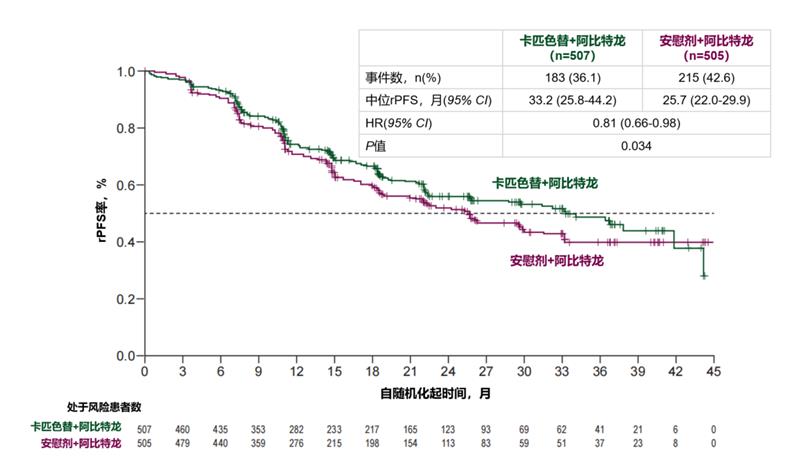
图6. 总体人群(PTEN缺失阈值≥90%,全分析集)经研究者评估的rPFS Kaplan-Meier估计曲线
5. 尼拉帕利联合醋酸阿比特龙和泼尼松治疗HRR缺陷型转移性去势敏感性前列腺癌:一项随机3期试验
发表期刊:Nat Med
背景及目的:对于携带同源重组修复(HRR)基因突变的前列腺癌患者,在激素治疗后病情出现进展时使用聚腺苷二磷酸核糖聚合酶(PARP)抑制剂已成为标准疗法,但耐药现象频发。尼拉帕利是一种高选择性、强效PARP抑制剂。尼拉帕利与阿比特龙联合泼尼松方案已获批用于治疗BRCA1/2基因突变的转移性去势抵抗性前列腺癌(mCRPC)。本次开展AMPLITUDE跨国III期临床试验,旨在评估对于携带HRR基因有害种系或体细胞突变的mCSPC患者,在阿比特龙联合泼尼松方案基础上联用尼拉帕利能否延长影像学无进展生存期。
方法:AMPLITUDE双盲试验评估了在醋酸阿比特龙+泼尼松(AAP)方案基础上联合强效特异性PARP抑制剂尼拉帕利对比安慰剂联合AAP方案,治疗携带HRR基因突变的mCSPC患者的疗效。研究共纳入696例患者按1:1比例随机分组(每组348例)。中位年龄为68岁;56%的患者携带BRCA1或BRCA2基因突变;78%的患者存在高负荷转移;16%的患者既往接受多西他赛治疗。
主要结果:在针对BRCA突变亚组的首个疗效分层检验中,与安慰剂联合AAP组相比,尼拉帕利联合AAP组的研究者评估的影像学无进展生存期(主要终点)显著改善(HR=0.52,95%CI:0.37-0.72;P<0.0001)。该亚组中,尼拉帕利联合AAP组的中位影像学无进展生存期尚未达到,而安慰剂联合AAP组为26.0个月(图7)。
在HRR效应因子亚组(HR=0.57,95%CI:0.42-0.77;P=0.0003)和意向性治疗人群(HR=0.63,95%CI:0.49-0.80;P=0.0001)中,尼拉帕利联合AAP组患者的影像学进展或死亡风险均显著降低。HRR效应因子亚组和意向性治疗人群中,尼拉帕利联合AAP组的中位影像学无进展生存期均未达到,而安慰剂联合AAP组分别为27.6个月和29.5个月。
尼拉帕利联合AAP的治疗效果在大多数预设亚组中保持一致,但部分亚组的事件数较少,无法得出确定性结论。通过盲态独立中心评估的影像学无进展生存期获益程度与研究者评估结果相当。尽管这不是预设分析,研究仍关注了携带HRR基因突变但未检出BRCA2或BRCA1突变(即存在BRIP1、PALB2、RAD51B、RAD54L、CDK12、CHEK2和FANCA中任何基因突变)患者的疗效。非BRCA1/2突变患者的影像学无进展生存期HR为0.81(95%CI:0.56-1.18)。
安全性分析显示,尼拉帕利联合AAP组3-4级不良事件发生率为75%,安慰剂联合AAP组为59%;尼拉帕利联合AAP组最常见的不良事件为贫血(29%),其中25%的患者需要输血治疗,以及高血压(27%)。尼拉帕利联合AAP组出现14例导致死亡的治疗期不良事件,安慰剂联合AAP组为7例。
结论:综上所述,AMPLITUDE是首次证实PARP抑制剂在mCSPC领域具有疗效的研究。对于携带HRR基因突变的mCSPC患者,尼拉帕利联合AAP方案可显著延长患者的影像学无进展生存期。不良事件通过剂量调整和支持治疗可得到控制,治疗中止的发生率较低,相关严重后遗症罕见。影像学进展的延缓具有重要临床意义,尤其在BRCA1/2突变肿瘤中最为显著,尼拉帕利联合AAP方案可能为此类患者提供新的治疗选择。在评估该治疗方案带来的影像学无进展生存期延长这一潜在获益时,应综合考虑mCSPC患者群体可能面临的不良事件风险。
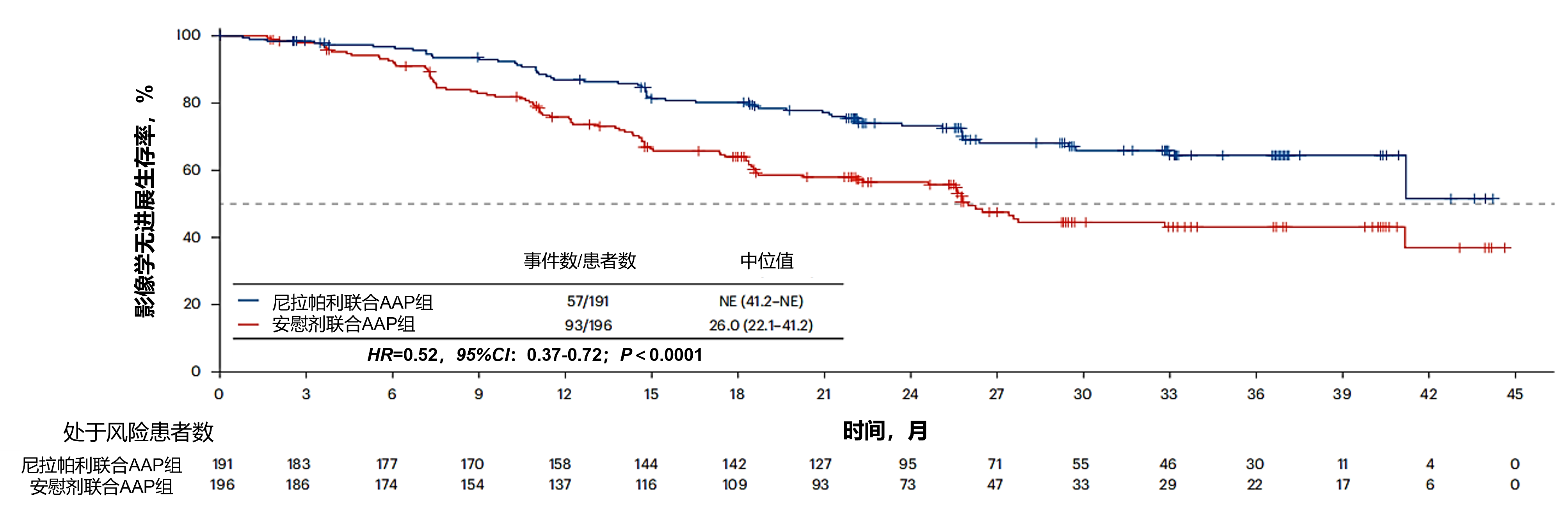
图7. BRCA亚组(n=387)经研究者评估的影像学无进展生存期Kaplan-Meier估计曲线
6. 阿贝西利联合阿比特龙治疗转移性去势抵抗性前列腺癌患者(CYCLONE 2):一项随机、双盲、安慰剂对照的3期试验
发表期刊:Lancet Oncol
背景及目的:与乳腺癌中的雌激素受体信号传导类似,雄激素受体信号通过雷帕霉素靶蛋白驱动的D型细胞周期蛋白诱导,部分激活CDK4和CDK6活性,维持前列腺癌细胞的持续增殖。与此一致的是,细胞周期蛋白D1浓度升高被认为是雄激素受体靶向治疗的潜在耐药机制。阿贝西利是一种口服CDK4和CDK6抑制剂,已获批用于治疗激素受体阳性、HER2阴性、高风险早期及晚期乳腺癌。临床前研究显示其在前列腺癌细胞系和异种移植模型中具有抗肿瘤作用。二期研究CYCLONE 1(NCT04408924)显示,在经深度治疗且具有侵袭性特征的mCRPC患者中,阿贝西利药物展现出令人鼓舞的抗肿瘤活性。这些发现共同确立了CDK4和CDK6作为前列腺癌治疗的有效靶点,并具有增强雄激素受体靶向治疗临床获益的潜力。本研究旨在评估在阿贝西利联合阿比特龙用于mCRPC患者一线治疗的安全性和有效性。本文报告研究者评估的影像学无进展生存期的主要结局分析。
方法:CYCLONE 2研究是一项在12个国家89家中心开展的随机、双盲、安慰剂对照的Ⅲ期临床试验,采用适应性设计,分为三部分:第1部分为安慰剂对照的安全性和剂量探索期,旨在确定阿贝西利与阿比特龙联合使用的推荐剂量;第2部分和第3部分为疗效评估期。纳入患者年龄≥18岁、经组织学确诊的前列腺腺癌伴骨扫描/CT/MRI证实的转移灶,且在持续雄激素剥夺治疗期间出现影像学或PSA进展。允许既往在转移性去势敏感性前列腺癌阶段接受过多西他赛治疗,但排除曾使用阿比特龙、阿帕鲁胺、恩扎卢胺、达罗他胺或CDK4/6抑制剂的患者。
随机化分组:第1部分的患者按2:2:1:1比例被随机分配,接受阿比特龙(1000 mg口服,每日1次)联合泼尼松或泼尼松龙(5 mg口服,每日2次)治疗,并在此基础上分别联用以下四种方案之一:150 mg阿贝西利(口服,每日2次)、200 mg阿贝西利(口服,每日2次)、与这两种剂量相匹配的安慰剂(每日2次)。在第2、3部分中,患者按1:1比例被随机分配至阿贝西利+阿比特龙组、安慰剂+阿比特龙组。所有研究部分均采用相同的分层因素进行分组,包括:既往是否接受多西他赛、是否存在可测量病灶、入组时疾病进展类型。
研究终点:主要终点为研究者评估的rPFS;次要终点包括独立评审委员会评估的rPFS、OS、客观缓解率(ORR)、缓解持续时间(DoR)、PSA进展时间、安全性及药代动力学等。
主要结果:共有393例患者被随机分组,206例接受阿贝西利+阿比特龙,187例接受安慰剂+阿比特龙。两组基线疾病特征均衡,37%患者既往接受过多西他赛治疗。基于第1部分药代动力学与安全性数据,阿贝西利200 mg每日两次被选为推荐剂量。
在观察到187例影像学无进展生存事件后进行了主要分析:阿贝西利联合阿比特龙组206例患者中92例(45%)报告了影像学无进展生存事件,安慰剂联合阿比特龙组187例患者中95例(51%)报告了此类事件(HR=0.83,95%CI: 0.62-1.11;P=0.21)。阿贝西利联合阿比特龙组和安慰剂联合阿比特龙组的中位rPFS分别为22.0个月和20.3个月(图8)。
亚组分析结果显示,在疾病进展风险较高及预后特征较差的患者亚组中,HR估计值呈现更低数值,包括基线存在可测量病灶、入组时即出现影像学进展、新发转移性病变、格里森评分较高、基线PSA高于中位值以及既往在mCSPC阶段接受过多西他赛治疗的患者。
次要终点分析显示,经盲态独立中心审查评估的rPFS与研究者评估结果一致(HR=0.84,95%CI:0.61-1.16;P=0.29)。截至数据截点时,OS数据尚不成熟(HR=0.93,95%CI:0.67-1.29;名义P =0.65)。在基线存在可测量病灶的患者中,阿贝西利联合阿比特龙组和安慰剂联合阿比特龙组的ORR分别为45%和55%,中位DoR分别为21.3个月和15.7个月。两组在PSA进展时间、症状进展时间或最严重疼痛进展时间方面,均未出现具有名义统计学显著性及临床意义的差异。
安全性分析显示,阿贝西利联合阿比特龙组最常见的3级及以上不良事件为贫血(14%)、中性粒细胞减少症(13%)和丙氨酸氨基转移酶升高(9%)。安慰剂联合阿比特龙组最常见的3级及以上不良事件为高血压(9%)。阿贝西利联合阿比特龙组有44%的患者发生严重不良事件,安慰剂联合阿比特龙组有37%的患者发生严重不良事件。
研究局限性:本研究存在若干局限性,尽管研究人群反映了试验入组时间范围,但治疗范式在研究期间已演进为将ARPI作为mCSPC标准疗法。尽管包括前列腺癌在内的某些癌症在部分人群中发病率和死亡率更高,但这些人群在临床试验中的代表比例仍然严重不足。本试验在12个国家开展,这些地区的总体入组情况反映了当地人口多样性,而CYCLONE 2研究的整体入组结构可能未能准确反映这些人群的全球前列腺癌发病率分布。这些局限性可能影响研究结果的普适性。
结论:CYCLONE 2是首个在前列腺癌患者中评估CDK4或CDK6抑制剂的III期研究。在本研究的mCRPC患者中,与安慰剂联合阿比特龙相比,阿贝西利联合阿比特龙双重抑制CDK4/CDK6和雄激素受体通路,并未改善患者rPFS。该联合方案的安全性与既往报道的各单药已知安全性特征一致。需要进一步研究来确定mCRPC患者有效的联合治疗方案,特别是针对具有不良预后特征的患者。
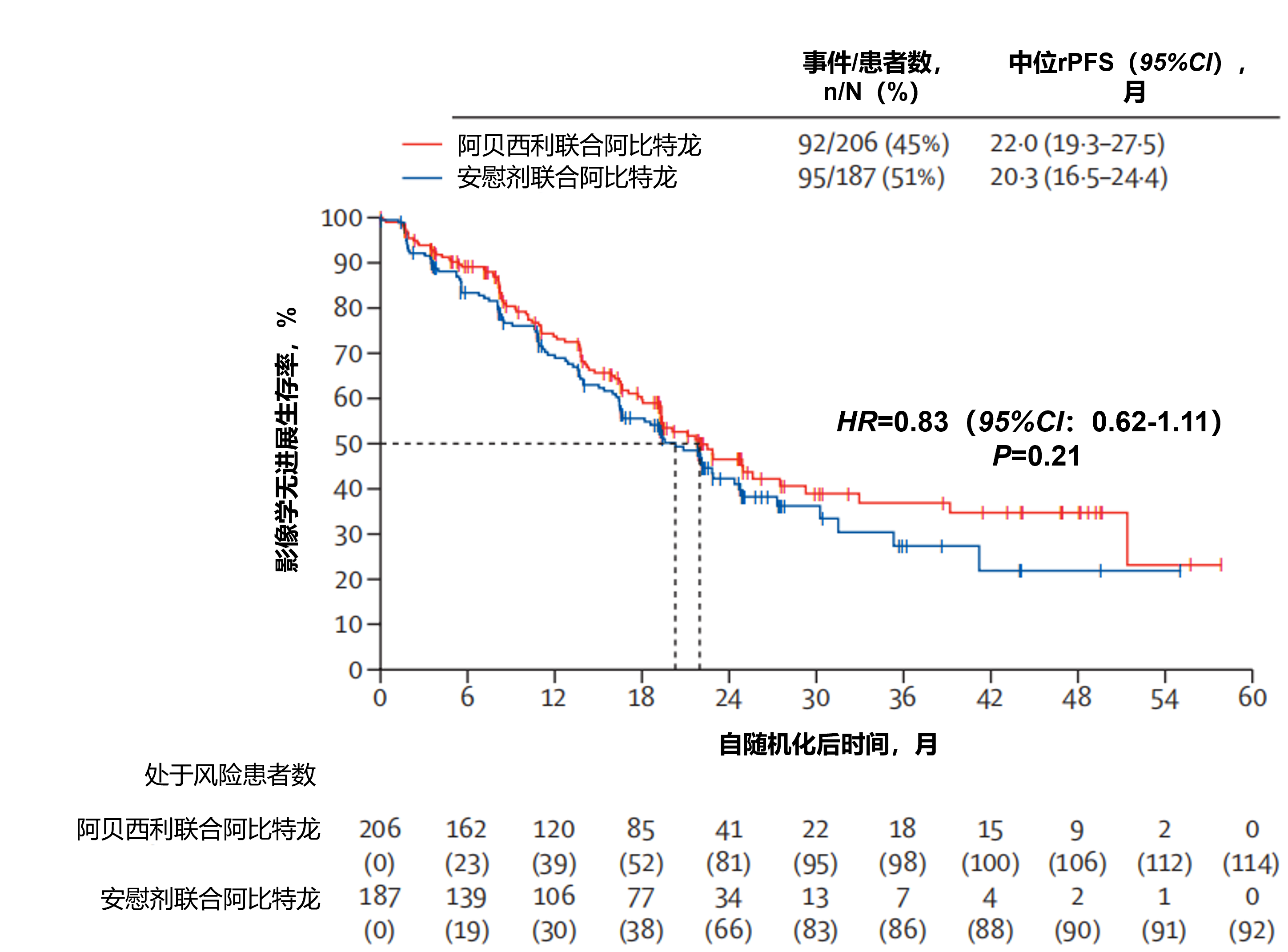
图8. 研究者评估的影像学无进展生存期Kaplan-Meier估计曲线
肾癌
7. 基于帕博利珠单抗的新型疗法作为晚期透明细胞肾细胞癌的一线治疗:开放标签、伞式平台I/II期KEYMAKER-U03试验的03A子研究
发表期刊:Ann Oncol
背景:两种免疫检查点抑制剂联合或一种免疫检查点抑制剂联合一种血管内皮生长因子受体酪氨酸激酶抑制剂(VEGFR-TKI)的双联治疗方案,相较于既往的单药VEGFR-TKI疗法,已显著改善初治晚期透明细胞肾细胞癌(ccRCC)患者的临床结局。然而,仍有约30%-50%的受试者在治疗开始后2年内出现疾病进展或死亡。三联疗法可能是进一步改善一线治疗结局的潜在方向。
方法:在Ib/II期、多中心、开放标签、滚动队列设计的KEYMAKER-U03研究(NCT04626479)的03A子研究中,截至2025年3月31日,共入组393例既往未接受过全身治疗的晚期ccRCC患者,按2:1比例随机分配至以下方案组:quavonlimab(qmab)/帕博利珠单抗(pembro)+仑伐替尼(lenva)组、favezelimab(fave)/帕博利珠单抗+仑伐替尼组、帕博利珠单抗+仑伐替尼+belzutifan(bel)组、vibostolimab(vibo)/帕博利珠单抗+bel组,或同期对照组(帕博利珠单抗+仑伐替尼),所有试验方案均设置了约10例患者的安全性导入阶段。主要终点为所有随机分组患者(不包括安全性导入阶段患者)中经盲态独立中心审查(BICR)根据RECIST v1.1标准评估的ORR,以及所有接受治疗患者的安全性。次要终点包括PFS和OS。五个队列中随机分组患者的中位随访时间介于16至39个月之间。
主要结果:根据BICR采用RECIST v1.1标准评估的主要疗效终点ORR:同期对照组(帕博利珠单抗+仑伐替尼)为80.6%,qmab/帕博利珠单抗+仑伐替尼组为71.3%,fave/帕博利珠单抗+仑伐替尼组为62.7%,帕博利珠单抗+仑伐替尼+bel组为77.5%,vibo/帕博利珠单抗+bel组为42.5%(95%CI 31.5-54.1)。所有治疗方案均观察到完全缓解。
截至数据截点时,帕博利珠单抗+仑伐替尼+bel组80例患者中有33.8%出现经证实的疾病进展或死亡,其他各治疗组均约有50%参与者达到该终点。同期对照组(帕博利珠单抗+仑伐替尼)的中位PFS为26.3个月,24个月预估PFS率为52.9%。qmab/帕博利珠单抗+仑伐替尼组的中位PFS为18.0个月,24个月预估PFS率为46.0%(与同期对照组41例患者相比,HR=0.96;95%CI:0.57-1.61)。帕博利珠单抗+仑伐替尼+bel组的中位PFS为31.8个月,24个月预估PFS率为67.1%(与同期对照组37例患者相比,HR=0.45;95%CI:0.25-0.83)。所有治疗组均未达到中位OS。同期对照组(帕博利珠单抗+仑伐替尼)、qmab/帕博利珠单抗+仑伐替尼组和帕博利珠单抗+仑伐替尼+bel组的24个月预估OS率分别为76.5%、73.3%和85.5%。由于数据尚未成熟且可用事件数有限,未提供与同期入组参照组相比的总生存期风险比。
安全性分析显示,所有患者均出现治疗相关不良事件,≥3级治疗相关不良事件发生率分别为:同期对照组(帕博利珠单抗+仑伐替尼)71.0%,qmab/帕博利珠单抗+仑伐替尼组73.3%,fave/帕博利珠单抗+仑伐替尼组86.9%,帕博利珠单抗+仑伐替尼+bel组70.0%,vibo/帕博利珠单抗+bel组68.9%。
结论与意义:帕博利珠单抗+仑伐替尼方案观察到的疗效与安全性验证了既往关于该联合疗法的研究结果。帕博利珠单抗+仑伐替尼+bel组、qmab/帕博利珠单抗+仑伐替尼组的ORR与帕博利珠单抗+仑伐替尼组相近,但其他试验组未达到相似效果。针对帕博利珠单抗+仑伐替尼+bel、qmab/帕博利珠单抗+仑伐替尼与帕博利珠单抗+仑伐替尼的进一步对比研究,正在III期LITESPARK-012试验中进行。
8. 仑伐替尼联合依维莫司对比卡博替尼治疗PD-1免疫检查点抑制剂治疗后进展的转移性透明细胞肾细胞癌:一项多中心随机II期试验(LenCabo)
发表期刊:Ann Oncol
研究背景及目的:尽管基于ICI的联合方案能带来总生存期获益和部分持久的显著缓解,但大多数转移性ccRCC患者会出现疾病复发,需要接受后续治疗。既往两项随机III期试验证实,在ICI为基础的治疗进展后继续抗PD-1/PD-L1阻断缺乏临床获益,转移性ccRCC的二线及后线治疗格局已转向抗血管生成靶向治疗。然而,目前靶向治疗尚未进行过头对头比较。2021年,设计并启动了LenCabo试验——一项多中心随机II期临床试验,旨在验证以下假设:对于基于PD-1的ICI治疗出现疾病进展的患者,仑伐替尼+依维莫司通过阻断ccRCC相关的多重信号通路,将产生比卡博替尼更长的无进展生存期。
研究设计:这项多中心随机II期试验入组了既往接受过1-2线治疗(包含PD-1 ICI)的转移性ccRCC患者。受试者接受仑伐替尼(18mg/日)+依维莫司(5mg/日)对比卡博替尼(60mg/日)治疗,并根据国际转移性肾癌数据库联盟风险分组和既往靶向治疗情况进行分层。研究采用贝叶斯最优二期设计(BOP2)。共90例患者完成随机分组;86例患者至少接受了一剂分配的仑伐替尼+依维莫司(n=40)或卡博替尼(n=46)治疗。
研究终点:主要终点为PFS;次要终点包括根据RECIST 1.1版标准评估的ORR、疾病控制率(DCR)、OS、健康相关生活质量,以及3-5级不良事件发生率。
主要结果:从随机分组至数据截止日(2025年8月1日)的中位时间为20个月。共观察到60例PFS事件。仑伐替尼+依维莫司组较卡博替尼组的中位PFS显著延长,分别为15.7个月 vs 10.2个月(HR=0.51,95%CI:0.29-0.89,P=0.02;图9)。仑伐替尼+依维莫司组较卡博替尼组的ORR在数值上更高,分别为52.6% vs 38.6%。由于事件数较少,总生存期数据尚不成熟且无法定论(仑伐替尼+依维莫司组 vs 卡博替尼组的1年OS率分别为87.0% vs 84.6% [95%CI: 0.47-2.38])。因毒性导致的停药率在仑伐替尼+依维莫司组为20%,卡博替尼组为10.9%。
结论与意义:在这项针对既往PD-1 ICI治疗进展的转移性ccRCC患者的随机II期试验中,仑伐替尼+依维莫司相较于卡博替尼显著延长了无进展生存期。作为ICI治疗后二线及以上方案的首个头对头比较研究,该结果对治疗序贯决策具有重要参考价值,并为肿瘤临床实践提供了关键信息。
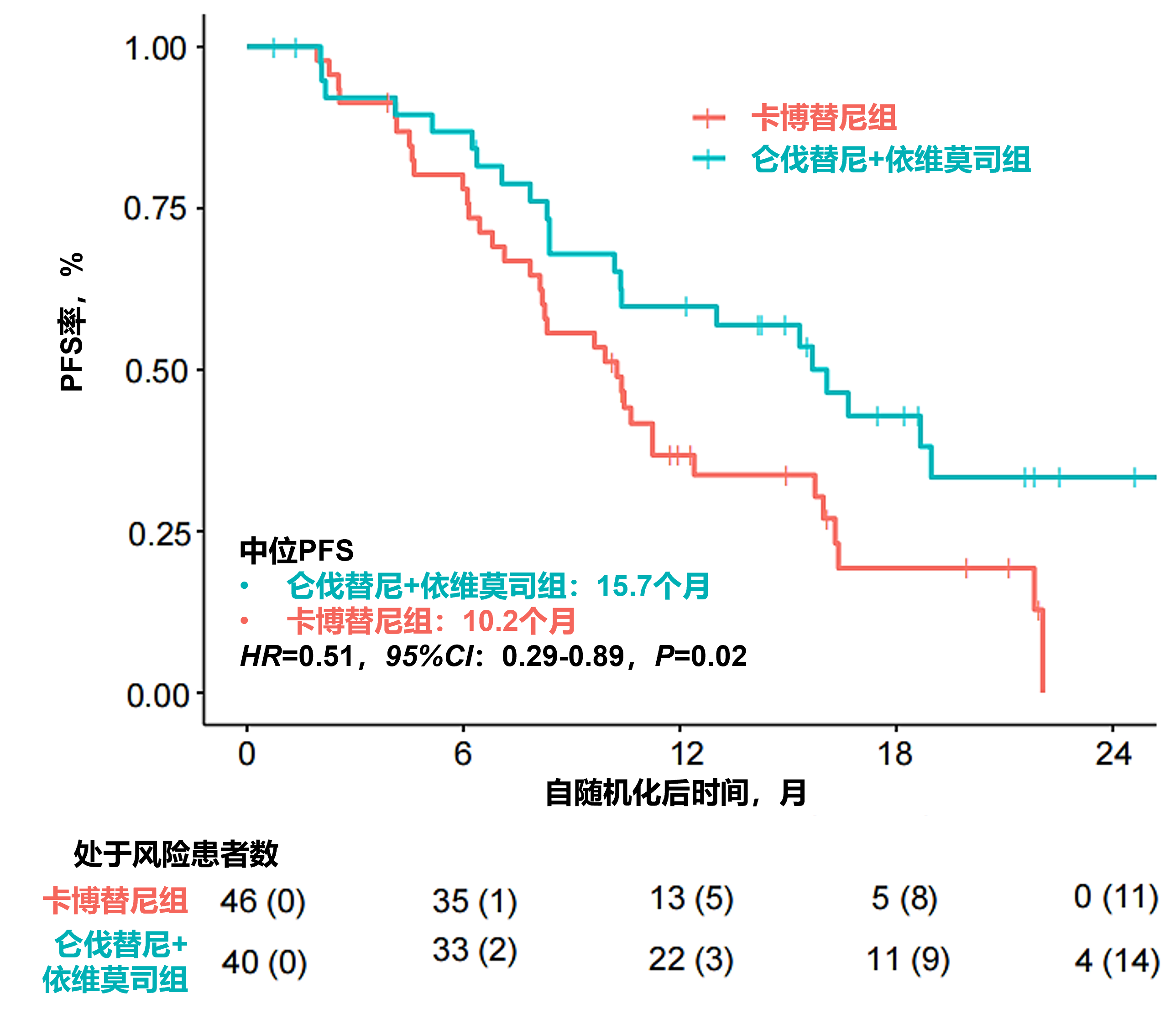
图9. 仑伐替尼+依维莫司组 vs 卡博替尼组PFS的Kaplan-Meier曲线
膀胱癌
9. ALBAN (GETUG-AFU 37):比较静脉注射阿替利珠单抗联合膀胱内注射卡介苗与单纯卡介苗治疗卡介苗初治高危非肌层浸润性膀胱癌(NMIBC)的III期、随机、开放标签、国际多中心临床试验
发表期刊:Ann Oncol
背景及目的:高危非肌层浸润性膀胱癌(NMIBC)经尿道膀胱肿瘤切除术后的标准治疗方案是卡介苗(BCG)膀胱灌注(诱导及维持治疗方案),但仍有30%-40%患者对BCG治疗无应答。既往研究表明,程序性死亡配体1(PD-L1)表达与免疫浸润改变可能与BCG治疗失败相关。
阿替利珠单抗是一种人源化免疫球蛋白G1单克隆抗PD-L1抗体。其与BCG联合治疗的可行性已在既往两项研究中得到评估:一项针对高危、BCG无应答伴原位癌(CIS)NMIBC患者的Ib/II期研究,另一项是针对BCG初治高危NMIBC患者的Ib/II期BladderGATE试验。两项试验中阿替利珠单抗联合BCG均表现出良好耐受性,未出现新的安全信号或治疗相关死亡,初步结果提示具有临床意义的抗肿瘤活性。本次在ALBAN III期试验(NCT03799835)中,在BCG初治高危NMIBC患者中比较静脉注射阿替利珠单抗联合膀胱灌注BCG与单用BCG治疗的疗效。主要目的是通过无事件生存期(EFS)评估阿替利珠单抗联合BCG方案的疗效。
方法:ALBAN试验是一项国际性、1:1随机、开放标签的III期临床试验,旨在比较阿替利珠单联合BCG(B组)与单用BCG(A组)治疗BCG初治高危NMIBC患者的疗效,其中255例患者被随机分配至A组,262例患者分配至B组。主要终点为研究者评估的EFS。关键次要终点包括高级别无复发生存期(RFS)、完全缓解率、伴原位癌病变患者的缓解持续时间以及OS。
结果:在意向治疗(ITT)人群中,B组(BCG+阿替利珠单抗)相比A组(单用BCG)未能达到改善研究者评估EFS的主要终点。截至数据截止日观察到146例EFS事件(每组各73例),两组未显示显著性差异(校正后HR=0.98,95%CI:0.71-1.36,P=0.9106)(图10)。值得注意的是,两组均未达到中位EFS。EFS事件类型主要为局部或区域复发(87.7%)和死亡(8.9%)。所有预设亚组的EFS分析结果均保持一致,显示BCG+阿替利珠单抗未带来显著获益。对于入组时伴原位癌(无论是否合并乳头状肿瘤)的患者,粗风险比为0.74(95%CI:0.43-1.28,P=0.2786)。
关键次要终点分析显示,B组(BCG+阿替利珠单抗)和A组(单用BCG)的高级别RFS相似(分层HR=1.06,95%CI:0.73-1.55,P=0.7658)。研究对入组时伴原位癌(CIS)的患者进行完全缓解情况评估。经尿道膀胱肿瘤切除术(TURBT)确认后,第 25 周时A组的完全缓解率为96.5%,B组为93.7%(P=0.6819);第一年(即截至第51周)内经确认的完全缓解率,A组为74.0%,B组为81.1%(P=0.2211)。在EFS分析时,两组均未达到中位OS;总体共发生25例死亡,其中A组9例,B组16例,分别有1例和7例死亡归因于膀胱癌。
安全性分析显示,在至少接受过一剂试验治疗的患者中(A组250例,B组255例),A组94.0%和B组98.8%的患者出现≥1起不良事件。任意级别治疗相关不良事件(TRAEs)发生率在A组为75.6%,B组为94.1%。最常见TRAEs包括尿路异常(A组32.8% vs B组35.7%)、尿频(A组28.8% vs B组34.5%)和血尿(A组26.8% vs B组28.6%)。≥3级TRAEs发生率在A组为8.8%,B组为22.7%。任意级别和≥3级免疫治疗相关不良事件(irAEs)发生率分别为:A组8.8%和1.2%,B组54.9%和5.5%。
结论:这项针对BCG初治高危NMIBC患者的III期临床试验显示,在为期1年的BCG+阿替利珠单抗未能带来无事件生存期获益。该结果与另一种PD-(L)1抑制剂报告的阳性EFS结果形成对比,表明检查点抑制剂联合BCG疗法的获益可能具有情境特异性和药物特异性,而非类别效应。未来研究应聚焦于生物标志物驱动的患者筛选,并优化检查点抑制剂相对于BCG的给药时机、疗程及给药途径。
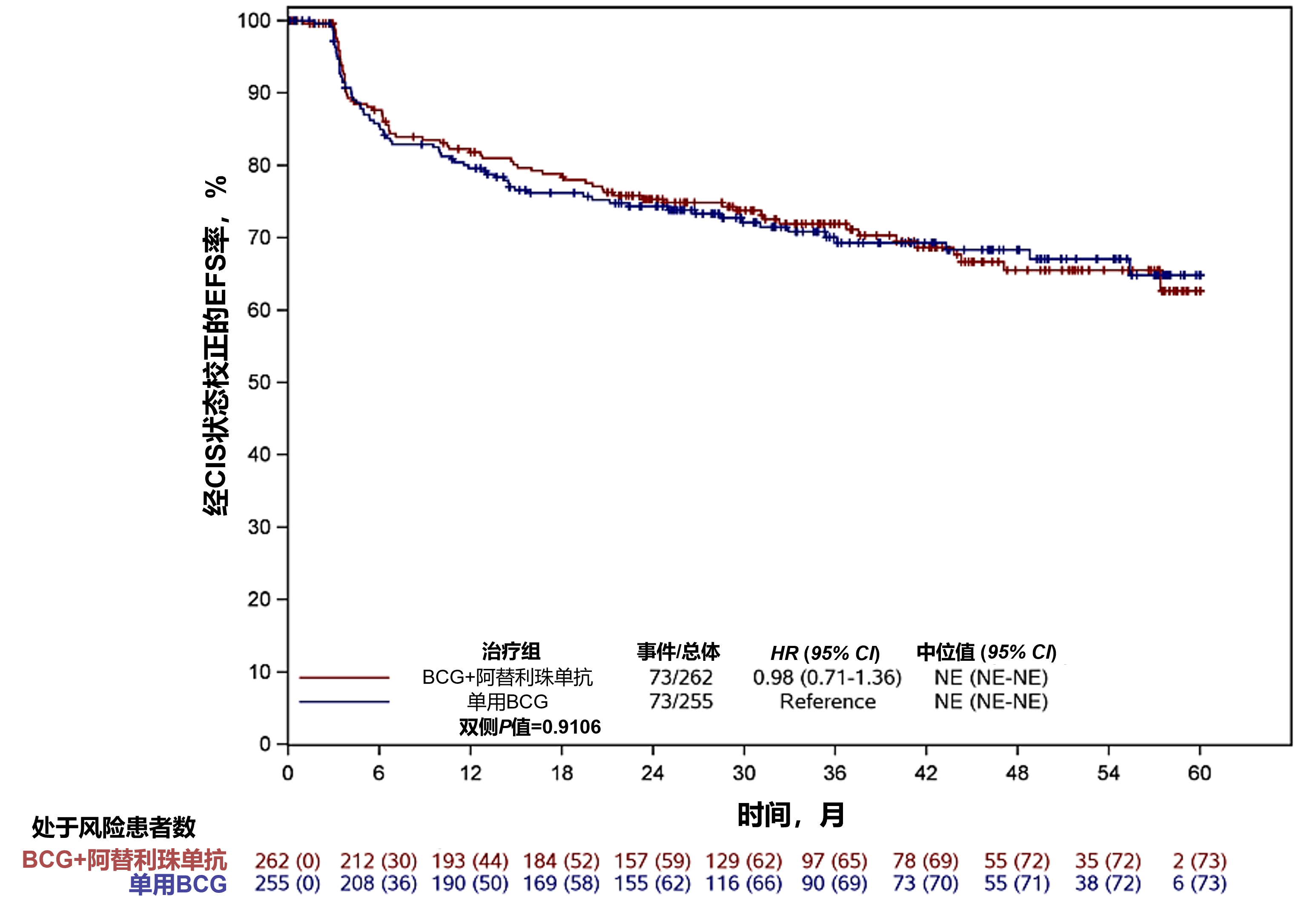
图10. 意向治疗人群中研究者评估EFS的Kaplan-Meier曲线
10. 度伐利尤单抗联合卡介苗治疗卡介苗初治的高危非肌层浸润性膀胱癌(POTOMAC):一项随机、开放标签3期试验的最终分析
发表期刊:Lancet
背景及目的:对于BCG初治的高危NMIBC,标准治疗方案为经TURBT后联合膀胱灌注BCG治疗,包括诱导治疗和维持治疗方案。尽管BCG初始缓解率较高,但早期复发十分常见(2年内复发率达30%)。出现高危疾病早期复发或进展为BCG无应答的患者,其发展为肌层浸润性膀胱癌或转移性疾病的风险显著增加。免疫检查点抑制剂在高危NMIBC治疗中已显现疗效。度伐利尤单抗是一种选择性、高亲和力、经修饰的人源化IgG1单克隆抗体,可与PD-L1结合并阻断其与PD-1及CD80的结合,从而消除PD-L1介导的T细胞活化抑制。本次开展了一项III期临床试验,旨在评估对于BCG初治高危NMIBC患者,度伐利尤单抗联合BCG诱导及维持治疗相较单用BCG诱导及维持治疗是否能改善临床结局。
方法:POTOMAC是一项在12个国家116个中心(包括学术研究中心、医院和泌尿科诊所)开展的III期、随机、开放标签、多中心全球性试验。研究于2018年6月18日至2020年10月2日期间,共对1350例患者进行资格评估,其中1018例完成随机分配,纳入标准为年龄≥18岁、接受过TURBT的BCG初治高危NMIBC患者。患者按1:1:1比例随机分配至以下三组:339例接受静脉注射度伐利尤单抗(每4周一次,共13个周期)联合膀胱灌注BCG诱导(每周一次持续6周)及维持治疗(在第3、6、12、18、24个月时每周给药3次)、339例接受度伐利尤单抗联合BCG诱导,340例接受BCG诱导及维持(对照组)。主要终点为在意向性治疗人群中,度伐利尤单抗联合BCG诱导及维持组与对照组相比经研究者评估的无病生存期。
主要结果:中位随访60.7个月,度伐利尤单抗联合BCG诱导及维持组339例患者中观察到67例(20%)无病生存事件,对照组340例患者中观察到98例(29%)无病生存事件。与对照组相比,度伐利尤单抗联合BCG诱导及维持组的高危疾病复发或全因死亡风险显著降低32%(HR=0.68,95%CI:0.50-0.93;对数秩检验P=0.015;图11)。度伐利尤单抗联合BCG诱导及维持组24个月预估无高危疾病复发生存率为86.5%,对照组为81.6%。
在至少接受过一剂研究治疗的患者中,度伐利尤单抗联合BCG诱导及维持组336例患者中有71例(21%)、度伐利尤单抗联合BCG诱导组337例患者中有52例(15%)、对照组339例患者中有13例(4%)出现3-4级治疗相关不良事件。未发生导致死亡的治疗相关不良事件。
结论与临床意义:综上所述,对于BCG初治高危NMIBC患者,为期1年的度伐利尤单抗联合BCG诱导及维持治疗可带来具有统计学显著性和临床意义的无病生存期改善,相较于标准BCG诱导及维持单药治疗,其无病生存事件风险额外降低32%。在BCG诱导及维持治疗基础上联合度伐利尤单抗未对总生存期产生不利影响。度伐利尤单抗联合BCG诱导及维持方案的安全性与各药物已知安全性特征一致,耐受性良好且可控,未观察到非预期毒性。其他次要终点将在未来另行评估报告。POTOMAC研究结果支持度伐利尤单抗联合BCG诱导及维持治疗作为BCG初治高危NMIBC患者的新治疗选择。
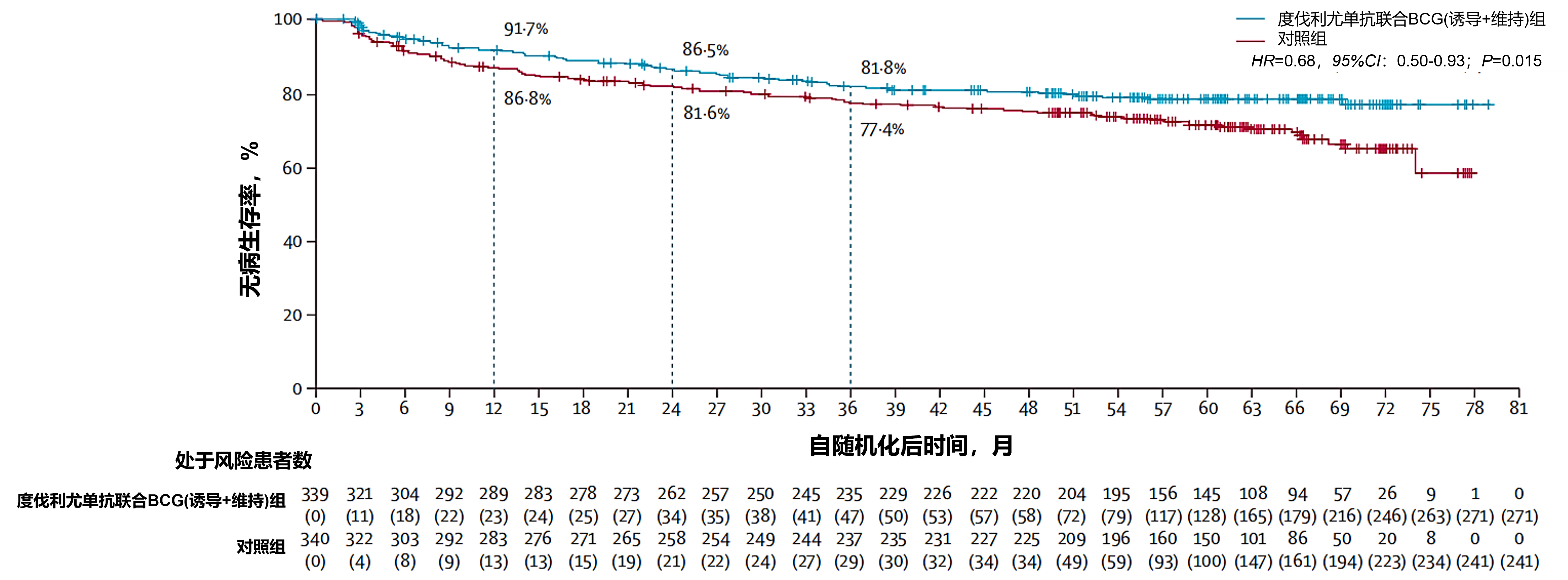
图11. 意向治疗人群中度伐利尤单抗联合BCG(诱导+维持)组与对照组的无病生存期比较
参考文献
- Roobol MJ, de Vos II, Månsson M, et al. European Study of Prostate Cancer Screening - 23-Year Follow-up[J]. N Engl J Med. 2025 Oct 30;393(17):1669-1680.
- Sushentsev N, Warren AY, Colling R, et al. Active Monitoring, Surgery, and Radiotherapy for Cribriform-Positive and Cribriform-Negative Prostate Cancer: A Secondary Analysis of the PROTECT Randomized Clinical Trial[J]. JAMA Oncol. 2025 Oct 16:e254125.
- Fleshner NE, Bernardino RM, Izawa J, et al. Metformin Active Surveillance Trial in Low-Risk Prostate Cancer[J]. J Clin Oncol. 2025 Oct 30:JCO2501070.
- Fizazi K, Clarke NW, De Santis M, et al. Capivasertib plus abiraterone in PTEN-deficient metastatic hormone-sensitive prostate cancer: CAPItello-281 phase III study[J]. Ann Oncol. 2025 Oct 19:S0923-7534(25)04936-1.
- Attard G, Agarwal N, Graff JN, et al. Niraparib and abiraterone acetate plus prednisone for HRR-deficient metastatic castration-sensitive prostate cancer: a randomized phase 3 trial[J]. Nat Med. 2025 Oct 7.
- Smith M, Piulats J, Todenhöfer T, et al. Abemaciclib plus abiraterone in patients with metastatic castration-resistant prostate cancer (CYCLONE 2): a randomised, double-blind, placebo-controlled, phase 3 trial[J]. Lancet Oncol. 2025 Nov;26(11):1489-1500.
- Suarez C, Rojas C, Shin SJ, et al. Novel pembrolizumab-based treatments as first-line therapy in advanced clear cell renal cell carcinoma: Substudy 03A of the open-label, umbrella platform, phase I/II KEYMAKER-U03 trial[J]. Ann Oncol. 2025 Oct 18:S0923-7534(25)04954-3.
- Hahn AW, Chahoud J, Skelton WP, et al. A multicenter randomized phase II trial of lenvatinib plus everolimus versus cabozantinib in patients with metastatic clear cell RCC that progressed on PD-1 immune checkpoint inhibition (LenCabo) [J]. Ann Oncol. 2025 Oct 18:S0923-7534(25)04953-1.
- Roupret M, Bertaut A, Pignot G, et al. ALBAN (GETUG-AFU 37): a phase III, randomized, open-label international trial of intravenous atezolizumab and intravesical Bacillus Calmette-Guérin (BCG) versus BCG alone in BCG-naive high-risk, non-muscle-invasive bladder cancer (NMIBC) [J]. Ann Oncol. 2025 Oct 17:S0923-7534(25)04787-8.
- De Santis M, Palou Redorta J, Nishiyama H, et al. Durvalumab in combination with BCG for BCG-naive, high-risk, non-muscle-invasive bladder cancer (POTOMAC): final analysis of a randomised, open-label, phase 3 trial[J]. Lancet. 2025 Nov 8;406(10516):2221-2234.



