
简要介绍
肾癌
1. Eur Urol:纳武利尤单抗治疗转移性透明细胞肾细胞癌:基于 NIVOREN GETUG-AFU 26 II期研究的整合性生物标志物分析
2. Eur Urol:MLH1错配修复缺陷预测透明细胞肾细胞癌对免疫检查点抑制的卓越疗效
3. Nat Med:针对肾癌中HIF2诱导的恶病质治疗
4.Eur Urol:CaboPoint研究:一项关于转移性肾细胞癌患者在接受基于免疫检查点抑制剂的联合疗法后,采用卡博替尼作为二线治疗的II期临床试验
前列腺癌
5. J Clin Oncol:177Lu-前列腺特异性膜抗原新辅助联合立体定向消融放疗治疗寡复发前列腺癌(LUNAR):一项开放标签、随机对照II期研究
6. JAMA Oncol:局部前列腺癌根治性放疗联合雄激素剥夺治疗的最佳时长:一项荟萃分析
7. Nat Rev Clin Oncol:激素敏感性前列腺癌的个体化强化治疗
8. Eur Urol:转移性激素敏感性前列腺癌生存率的比较分析:基于疾病负荷与转移时机的网络荟萃分析动态研究
9. Ann Oncol:去势抵抗性前列腺癌中AR基因位点改变的谱系与临床分级体系
尿路上皮癌
10. N Engl J Med:注射用维迪西妥单抗联合特瑞普利单抗治疗表达人表皮生长因子受体2(HER2)的晚期尿路上皮癌
肾癌
1. 纳武利尤单抗治疗转移性透明细胞肾细胞癌:基于 NIVOREN GETUG-AFU 26 II期研究的整合性生物标志物分析
发表期刊:Eur Urol
背景及目的:纳武利尤单抗改善了难治性转移性透明细胞肾细胞癌(ccRCC)患者的生存,但其活性尚未有可靠的生物标志物得以明确。本次开展了一项针对接受过一种或多种血管内皮生长因子(VEGF)受体靶向治疗后进展患者的纳武利尤单抗真实世界二期临床试验,并纳入了综合性转化研究计划。通过免疫测定和基因表达谱分析,研究对候选的组织和循环生物标志物进行了评估。NIVOREN GETUG-AFU 26二期临床试验旨在通过一项综合性转化研究计划,评估接受纳武利尤单抗治疗患者的真实世界疗效。
研究方法:NIVOREN GETUG-AFU 26 试验纳入了转移性ccRCC且在酪氨酸激酶抑制剂治疗期间疾病进展的患者;共有720例患者接受了每2周3 mg/kg剂量的纳武利尤单抗治疗。值得注意的是,该研究达到了安全性主要终点:143例患者(20%)出现了至少一次与纳武利尤单抗相关的3级不良事件,未超过预设的安全阈值;在中位随访55.9个月后,客观缓解率为21.3%,中位无进展生存期为3.3个月,中位总生存期为24.5个月。
本次研究实施了一项综合性转化研究计划,涵盖基线时的组织免疫染色、基因表达谱分析以及可溶性因子检测。简而言之,通过免疫组织化学方法评估了三级淋巴结构、CD8+和B淋巴细胞、M2样CD163+巨噬细胞及免疫检查点表达。基因表达谱分析评估了免疫细胞和基质细胞浸润,以及先前与ccRCC预后相关的已发表特征谱:CIT-Descartes、IMmotion Teffector 和 Myeloid、IMbrave Treg,以及 Javelin Renal 101 Immuno。可溶性因子检测涵盖了促肿瘤炎症相关细胞因子、B细胞存活与扩增相关因子、可溶性共刺激检查点4-1BB、侵袭诱导粘附分子VCAM-1,以及缺氧/血管生成标志物血管内皮生长因子。组织样本和血液样本分析分别基于324例和353例患者进行。纳入生物标志物分析的患者特征与总体研究人群基本相似。
主要结果:通过基因表达谱分析对免疫细胞与基质细胞浸润情况进行推断,识别出五个不同的"肾脏免疫分型"集群。值得注意的是,肾脏免疫分型(KIC)集群C和E包含具有高T细胞、B细胞和NK细胞浸润特征,且中性粒细胞、成纤维细胞和内皮细胞比例较低的肿瘤(图1A)。具备这些特征的患者客观缓解率显著更高(44%对15%,p < 0.001),并呈现更优的无进展生存期趋势(7.1个月对2.8个月,风险比[HR]=0.69;图1B、1C)。对CIT-Descartes基因标签的分析显示,炎症型/ccRCC4亚型患者的无进展生存期在数值上更高,而正常型/ccRCC3亚型患者预后最差;与此一致的是,炎症型/ccRCC4亚型表现出更高的CD8细胞浸润和PD-L1表达水平。其他基于免疫检查点抑制剂联合治疗方案开发的免疫分型系统,在本研究人群中均未能预测治疗结局。
对循环因子的分析显示,髓系来源的细胞因子IL-6和IL-8与不良生存结局显著相关:IL-6高表达患者的中位无进展生存期为2.4个月(低表达组为4.6个月,校正后HR=1.44 [95% CI:1.06–1.95]),总生存期为7.2个月(低表达组为29.7个月,校正后HR=2.68 [95% CI:1.94–3.69]);IL-8高表达患者的无进展生存期为2.5个月(低表达组为4.8个月,校正后HR=1.49 [95% CI:1.17–1.90]),总生存期为13.1个月(低表达组为31.9个月,校正后HR=1.73 [95% CI:1.34–2.24])。虽然根据国际转移性肾细胞癌数据库联盟分级标准,IL-6和IL-8均与不良临床特征相关,但在多变量分析中,其与无进展生存期及总生存期的关联仍保持显著独立性。在其他可溶性因子中,多变量分析显示血管内皮生长因子(VEGF)和B细胞活化因子(BAFF)是较短总生存期的独立预测因子,但未显示与无进展生存期的显著关联。
研究局限性:本研究的主要局限性包括使用单药纳武利尤单抗治疗(该方案已非现行标准疗法)以及转化研究结果缺乏独立验证。然而,本研究成果将有助于优化未来ccRCC的治疗策略。实际上,髓系相关与缺氧相关特征已被证实与差异化的治疗效果存在关联,这在IMmotion150试验中得到印证——该研究表明在检查点抑制剂基础上联用酪氨酸激酶抑制剂可逆转基于组织的不良表型。
结论:当前研究进一步证实,可溶性因子能够准确反映这些关键特征,且有助于克服取样偏差与肿瘤异质性问题。这一发现支持在一线免疫联合治疗方案中对可溶性因子进行系统性评估。
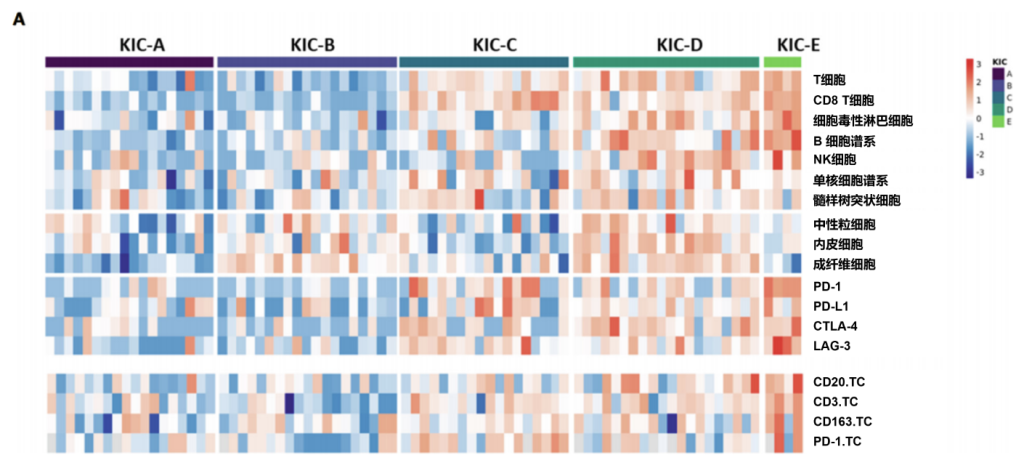
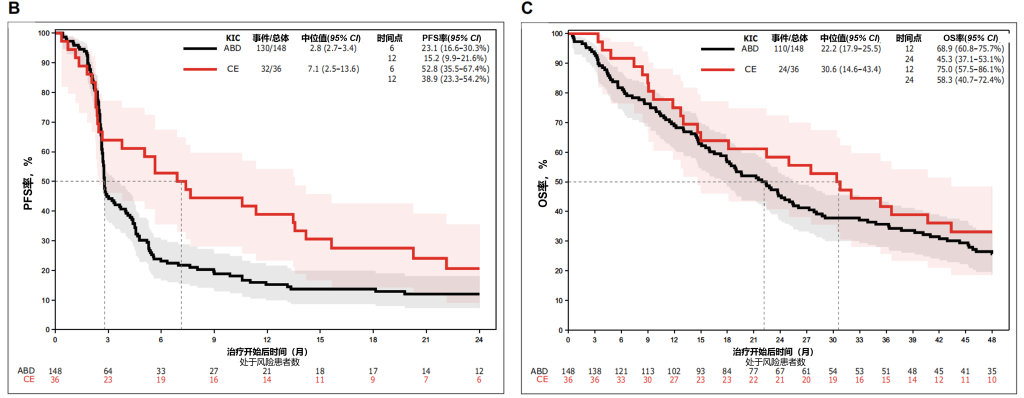
图1. 肾脏免疫分型(KIC)
(A) 基于基因表达谱推断的免疫细胞与基质细胞群进行无监督聚类,展示了五种不同的ccRCC亚型。图中展示了细胞群的免疫组化定量分析结果:T细胞(CD3)、B细胞(CD20)、巨噬细胞(CD163),以及肿瘤中心(TC)的PD-1表达情况。(B) 不同ccRCC KIC亚型的无进展生存期。(C) 不同ccRCC KIC亚型的总生存期。
2. MLH1错配修复缺陷预测透明细胞肾细胞癌对免疫检查点抑制的卓越疗效
发表期刊:Eur Urol
背景及目的:免疫检查点抑制剂可使透明细胞肾细胞癌患者获得深度且持久的治疗应答,但目前尚无有效的生物标志物来指导临床决策。尽管错配修复缺陷在其他恶性肿瘤中已被确立为免疫治疗应答的预测性生物标志物,但由于错配修复基因MLH1与3号染色体短臂上的VHL基因位置邻近,其在ccRCC中的预测价值尚未得到系统评估。本研究通过对多个队列进行基因组学与免疫组化分析,发现体细胞性MLH1功能缺陷虽相对罕见,却是预测ccRCC患者获得卓越免疫治疗应答的有力生物标志物。
研究方法:首先,研究回顾了纪念斯隆-凯特琳癌症中心临床测序队列中使用IMPACT panel测序的893例ccRCC患者,以确定错配修复基因变异的普遍性。在接受系统治疗前完成测序的474例患者中,24例(5.1%)存在错配修复功能丧失性变异。另有5例(1.1%)虽为野生型错配修复基因,但呈现微卫星高度不稳定或高肿瘤突变负荷特征。鉴于表观遗传沉默可能导致其他恶性肿瘤中的错配修复缺陷,研究对这些病例进行了深入研究,但受限于现有数据未能明确该机制。随后,评估了哪些基因组变异会表现为错配修复蛋白缺陷。29例中有16例样本可用于免疫组化染色检测。在免疫组化检测亚组中,仅MLH1基因变异与蛋白缺陷表现完全一致(4例可用病例均符合)。在野生型错配修复基因但呈高肿瘤突变负荷的可用病例中,有2例经免疫组化染色证实存在MLH1缺陷,这支持了表观遗传沉默机制的存在,提示错配修复缺陷的实际发生率可能被低估。进一步强化这些发现的是:在11例具有MLH1缺陷基因组或免疫组化证据的病例中,8例提取出以错配修复为主导的突变特征谱;而其他错配修复基因变异的病例中均未发现此特征。经基因组学或免疫组化检测证实存在MLH1缺陷的患者共11例(占总队列2.3%),研究对其中7例符合以下条件的患者进行了重点分析:确诊为转移性ccRCC、无其他进展期恶性肿瘤病史,且接受了一线免疫检查点抑制剂治疗。这7例患者均接受了PD-1/L1为基础的双联方案治疗(其中3例联合CTLA-4抑制剂,4例联合VEGF抑制剂)。
主要结果:本研究数据为部分MLH1缺陷患者仍出现免疫检查点抑制剂治疗失败提供了机制线索。其中一例获得卓越应答的患者在对侧肾脏出现迟发性肿瘤。肾部分切除术后的肿瘤测序显示,该转移灶源自原发肿瘤且具有MLH1正常功能,免疫组化评估结果也支持这一结论。这表明早期克隆分化及后续因肿瘤异质性导致的免疫逃逸机制,该机制已知会削弱免疫检查点抑制剂在其他错配修复缺陷恶性肿瘤中的疗效。与此同时,一例治疗无应答者被发现存在TAP1基因功能丧失性突变。此类抗原呈递机制关键组分的联合缺陷,可能会完全抵消MLH1缺陷产生的促免疫效应。
研究旨在利用两项针对转移性透明细胞肾细胞癌(ccRCC)一线免疫检查点抑制剂(ICI)治疗的里程碑式3期临床试验数据,在不同独立队列中验证本次发现。
结论:尽管基因组测序目前尚未成为ccRCC管理的标准流程——因其预测价值有限——但随着治疗手段的丰富和对特殊病例认知的深化,这一现状可能发生改变。虽然免疫组化仍是金标准,但本研究表明,利用临床可获取的测序panel基因组数据亦能识别ccRCC中的MLH1缺陷。尽管罕见,MLH1缺陷可能代表了当前ccRCC领域对ICI治疗产生卓越应答最可靠的预测标志物之一。虽然所有转移性患者在可行时都应接受ICI为基础的治疗,但未来研究可深入探讨MLH1状态对治疗方案选择的指导意义,例如联合CTLA-4抑制剂与VEGF抑制剂的不同策略。此外,尽管KeyNote-564研究已在辅助治疗领域取得重大突破,在持续优化患者选择的过程中,MLH1状态仍值得纳入考量。
3. 针对肾癌中HIF2诱导的恶病质治疗
发表期刊:Nat Med
背景及目的:肾癌常引发副肿瘤综合征,包括高钙血症和恶病质,但其潜在机制尚未完全阐明。最常见的肾癌类型为透明细胞肾细胞癌(ccRCC),通常由pVHL肿瘤抑制蛋白缺失及随之引起的HIF2转录因子上调所导致。研究发现,位于12号染色体p臂ccRCC扩增子上的PTHLH基因是ccRCC中HIF2的直接转录靶点。此外,临床前原位细胞系肿瘤模型显示,PTHLH表达升高既是诱导高钙血症和恶病质的必要条件,也是充分条件。与这些观察结果一致的是,两种不同的变构HIF2抑制剂——belzutifan和NKT2152,在ccRCC患者中能迅速改善高钙血症和恶病质,其中部分患者甚至未出现客观的肿瘤缩小。本研究结果支持开展前瞻性临床研究,以确定HIF2抑制剂不仅可用于肿瘤控制,还可用于治疗肾细胞癌相关的恶病质。
主要结果:①HIF2抑制可逆转ccRCC异种移植模型中的恶病质状态。本研究开展了额外的OSRC-2皮下异种移植实验,每周监测小鼠体重变化。如预期所示,荷瘤小鼠出现严重恶病质。当小鼠体重下降超过10%后,研究通过口服灌胃方式将其随机分配至PT2399治疗组或溶剂对照组。PT2399治疗组小鼠体重迅速恢复,而溶剂对照组小鼠体重持续下降。治疗6天后(溶剂对照组有1只小鼠因需避免动物痛苦而在第5天实施)进行解剖并称量切除的肿瘤组织。PT2399治疗组的肿瘤体积并未减小,反而呈增大趋势,这表明PT2399对恶病质的快速逆转属于药效学作用,而非肿瘤细胞减少所致。免疫印迹实验证实了PT2399的其他药效学效应,包括细胞周期蛋白D1、NDRG1及HIF2α蛋白水平的下调。②蛋白质组学鉴定出PTHrP是关键的HIF2下游分泌因子。为从机制层面探究OSRC-2细胞如何诱发恶病质,研究将泛素化生物素连接酶(BirA)与内质网靶向信号(ER)融合后导入OSRC-2细胞,并以786-O VHL−/− ccRCC细胞作为对照——该细胞在小鼠异种移植实验中未诱发严重恶病质。研究证实了在OSRC-2细胞中,PT2399能够抑制PTHLH及其编码蛋白PTHrP的表达,且相对于786-O细胞,OSRC-2细胞中这两者的表达水平显著升高。相比之下,在OSRC-2细胞中,GDF15的信使RNA和分泌蛋白水平并未受到PT2399的抑制。此外,OSRC-2细胞条件培养基中的GDF15水平与786-O细胞条件培养基中观察到的水平相当,且标准化后的GDF15 mRNA水平在786-O细胞中高于OSRC-2细胞。IL6的mRNA水平同样未被PT2399抑制。因此,研究重点聚焦于PTHrP。③PTHLH基因是HIF2的直接转录靶点。通过ChIP-seq、RNA-seq、PRO-seq和Polysome profiling多聚核糖体分析,研究证实HIF2能够直接结合在PTHLH基因的调控区域。这表明HIF2在转录和翻译水平上直接调控PTHLH的表达。④PTHrP是肾癌恶病质和高钙血症发生的必要条件。基因敲除PTHLH显著延缓OSRC-2移植小鼠的恶病质进展,延长生存期,且不影响肿瘤生长。诱导表达PTHrP足以在通常不引起恶病质的786-O细胞模型中引发恶病质和高钙血症。重要的是,使用唑来膦酸纠正高钙血症并未改善恶病质,表明 PTHrP 通过独立于钙稳态的机制驱动组织消耗。⑤PTHrP表达升高足以诱导恶病质。在一个本身不引起恶病质的786-O细胞模型中,研究人员通过诱导系统特异性地过表达PTHLH。结果显示,仅PTHrP水平的升高就足以让荷瘤小鼠出现严重的恶病质和高钙血症。⑥临床前模型与患者数据共同揭示:HIF2–PTHrP信号通路驱动恶病质与高钙血症的发生。TCGA数据分析显示,PTHLH在ccRCC中频繁高表达,尤其在12号染色体短臂扩增的肿瘤中。临床研究表明,ccRCC患者血浆PTHrP水平升高,与血钙浓度和骨骼肌指数相关, Belzutifan和NKT2152治疗均能快速降低PTHrP水平和血钙,促进体重增加,且这种效应在肿瘤未缩小的患者中也可观察到。
结论:本研究确立了PTHrP作为HIF2驱动ccRCC恶病质和高钙血症的关键介质。临床前和临床数据均表明,HIF2抑制剂能通过抑制PTHrP产生快速逆转这些副肿瘤综合征。值得注意的是,恶病质的逆转与肿瘤体积变化无关,提示HIF2抑制剂可能对晚期患者具有症状缓解作用。PTHrP水平可能作为HIF2抑制剂药效学的生物标志物,有助于患者分层和治疗决策。未来研究需要探讨PTHrP在其他癌症类型恶病质中的作用,以及PTHrP拮抗剂(直接或通过HIF抑制)与GDF15拮抗剂联合治疗的潜力。本研究为ccRCC相关恶病质的治疗提供了新思路,支持开展前瞻性临床研究评估HIF2抑制剂在肿瘤控制和症状管理中的双重价值。
4. CaboPoint研究:一项关于转移性肾细胞癌患者在接受基于免疫检查点抑制剂的联合疗法后,采用卡博替尼作为二线治疗的II期临床试验
发表期刊:Eur Urol
背景及目的:对于晚期肾细胞癌(aRCC)患者,在接受标准一线免疫检查点抑制剂(CPI)联合疗法后,单纯使用二线卡博替尼的临床数据较为有限。本研究旨在报告前瞻性CaboPoint试验的最终结果。
方法:CaboPoint研究(NCT03945773)是一项II期、多中心、开放标签试验,评估了卡博替尼作为二线治疗在既往接受过伊匹木单抗联合纳武利尤单抗(IpiNivo;队列A)或CPI联合血管内皮生长因子靶向治疗(队列B)的aRCC成人患者中的疗效与安全性。主要终点为经独立中心评审(ICR)评估的队列A患者客观缓解率(ORR,依据实体瘤疗效评价标准1.1)。次要终点包括ICR评估队列B的ORR、研究者评估的ORR、无进展生存期、总生存期及安全性。总计有127名患者在2020年至2023年间于40家机构入组,中位随访时间为19.3个月。
主要结果:中位随访时间为19.3个月:队列A为19.3(11.2–26.5)个月;队列B为20.4(10.3–24.3)个月。所有患者均纳入研究者报告结局的疗效分析集。有8例患者(队列A:n=6;队列B:n=2)缺乏靶病灶的基线中心评估数据,因此119例患者(队列A:n=79;队列B:n=40)构成独立中心评审(ICR)报告结局的疗效分析集。
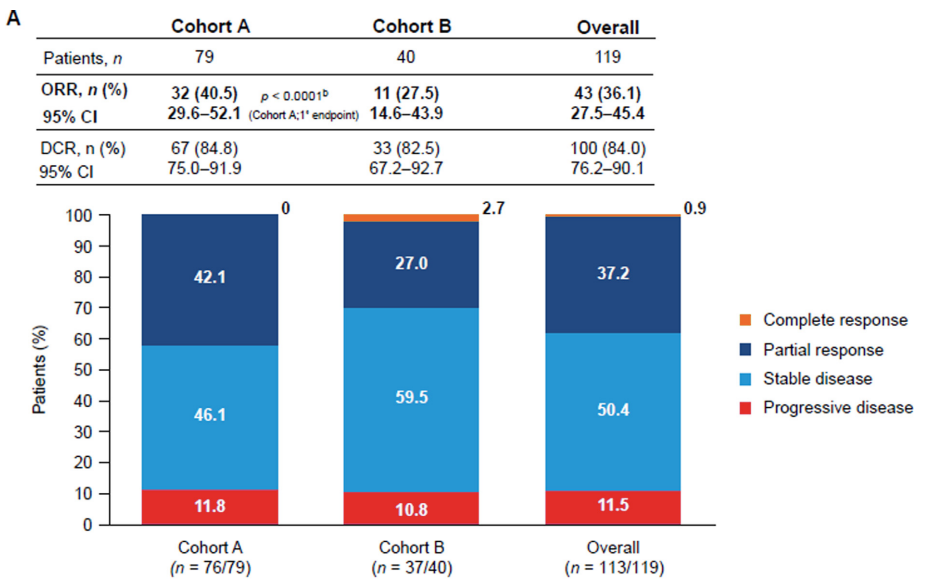
客观缓解率(ORR)在队列A(主要终点)为40.5%(95% CI:29.6–52.1%;32/79),队列B为27.5%(95% CI:14.6–43.9%;11/40),总体为36.1%(95% CI:27.5–45.4%;43/119)(图2A)。主要终点与10%的预设阈值相比具有统计学显著性(P < 0.0001)。两个队列及总体的疾病控制率均超过80%(图2A)。在队列A和队列B中,部分缓解分别为32/76例(42.1%)和10/37例(27.0%),完全缓解分别为0/76例(0%)和1/37例(2.7%)。为保守起见,在ORR分析中将数据缺失患者(每队列各3例)视为无缓解者(疾病进展患者),但其最佳总体缓解数据未在图中展示(图2A和B)。研究者评估的ORR(次要终点)在队列A为49.4%(95% CI:38.4–60.5%),队列B为33.3%(95% CI:19.6–49.5%)(图2B)。
安全性分析显示,绝大多数患者(99.2%)报告了任意级别的治疗期间不良事件(TEAEs),其中大多数为轻至中度。共有96例患者(75.6%)报告了3-4级TEAEs(队列A:71例[83.5%];队列B:25例[59.5%]),最常见的是高血压(32.3%)、腹泻(11.0%)和肺栓塞(7.9%); 大多数TEAEs与治疗相关, 最常见的是腹泻(66.1%)、食欲减退(43.3%)、高血压(42.5%)和口腔炎(40.9%)。治疗相关TEAEs导致治疗中断的比例在队列A和队列B中分别为78.8%和76.2%,导致剂量降低的比例分别为30.6%和26.2%。治疗相关严重TEAEs发生在25.2%的患者中(队列A:29.4%;队列B:16.7%),最常见的是腹泻和肺栓塞(各4例)。无死亡事件归因于治疗相关TEAEs。
结论:综上所述,这项在欧洲开展的II期开放标签研究证实,对于接受过基于CPI联合疗法后进展的晚期肾细胞癌患者,单纯二线卡博替尼治疗具有明确疗效,且未出现新的安全性信号。本研究结果支持在一线CPI疗法进展后的患者中继续应用二线卡博替尼单药治疗,并为未来二线临床试验的疗效评估提供了基准参照。
b 采用单样本二项分布精确检验,以10%(源自METEOR试验)作为阈值进行检验。
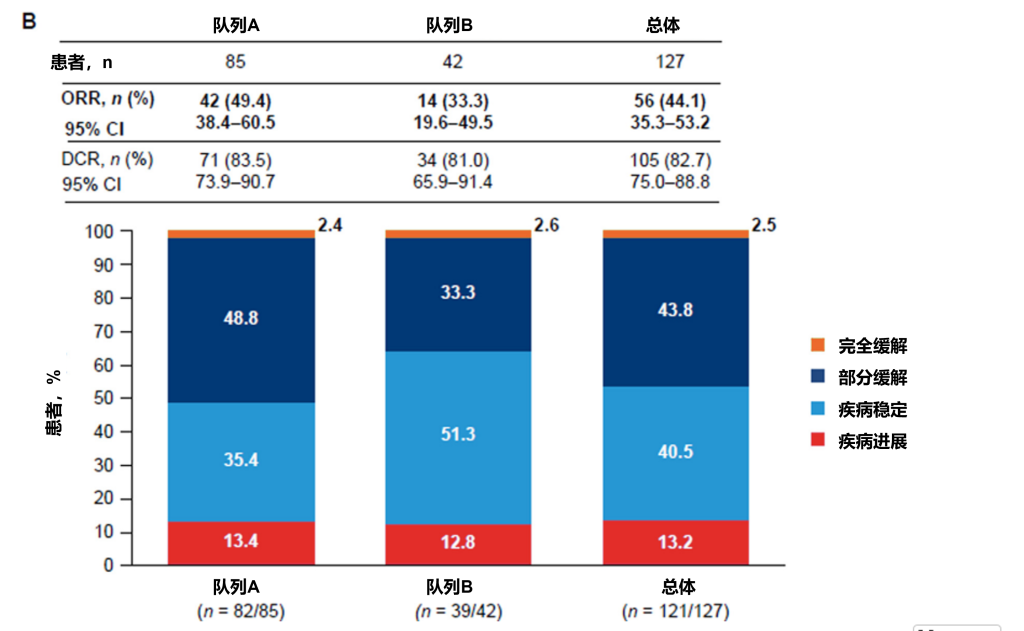
图2. (A) 经独立中心评审(ICR)(n=119)及 (B) 研究者评估(n=127)的队列A(既往接受CPI-CPI治疗)与队列B(既往接受CPI-VEGF靶向治疗)患者的客观缓解率(ORR)与疾病控制率(DCR)
前列腺癌
5. 177Lu-前列腺特异性膜抗原新辅助联合立体定向消融放疗治疗寡复发前列腺癌(LUNAR):一项开放标签、随机对照II期研究
发表期刊:J Clin Oncol
背景及目的:针对寡复发激素敏感性前列腺癌(orHSPC)采用立体定向体部放疗(SBRT)进行转移灶定向治疗后,疾病进展较为常见。本研究旨在评估在SBRT基础上联合新辅助前列腺特异性膜抗原(PSMA)靶向放射性配体治疗能否改善患者结局。
方法:LUNAR试验是一项在加州大学洛杉矶分校开展的单中心、随机、开放标签、对照II期临床试验。符合入组标准的参与者需经PSMA正电子发射断层扫描/计算机断层扫描(PET/CT)确认存在1-5个病灶,定义为orHSPC。根据分期(N1/M1a对比M1b)和病灶数量(1个对比2-3个对比4-5个)分层后,按1:1比例将患者随机分配至两组:单纯接受所有病灶SBRT治疗组,或先接受两个周期177Lu-PNT2002治疗(6.8 GBq/周期,间隔2周)后再进行所有病灶SBRT的联合治疗组。2022年9月2日至2023年11月9日期间,共92例患者完成随机分组(SBRT组n=47,177Lu联合SBRT组n=45),其中87例患者可进行评估(SBRT组n=42,177Lu联合SBRT组n=45)。中位随访时间为22个月时。主要终点为无进展生存期(PFS),评估依据包括PSMA PET/CT进展、挽救性激素治疗或死亡。在出现前列腺特异性抗原进展和/或SBRT治疗后12个月时,系统性地进行PSMA PET/CT评估。所有分析均基于意向治疗人群。
主要结果:在SBRT治疗组中,13例患者(31%)的前列腺特异性抗原下降≥50%,而在177Lu联合SBRT治疗组中,这一数据为23例患者(52%)(P=0.04)。中位随访22个月时,共65例患者(75%)出现疾病进展事件:SBRT组42例患者中有36例(86%),177Lu联合SBRT组45例患者中有29例(64%)。SBRT组的中位无进展生存期为7.4个月(95% CI:6.0-13.5个月),而177Lu联合SBRT组为17.6个月(95% CI:15个月-未达到)(HR=0.37 [95% CI:0.22-0.61];P<0.0001;图3)。
安全性分析显示,两组间不良事件发生率未见显著差异。观察到的唯一3级不良事件为淋巴细胞减少症:SBRT组有2例患者(4.8%)发生,177Lu联合SBRT组有3例患者(6.7%)发生。2级淋巴细胞减少症在SBRT组和177Lu联合SBRT组分别有4例(9.5%)和8例(17.8%)患者出现。1级口干症状在SBRT组有2例患者(5.6%),177Lu联合SBRT组有3例患者(6.8%);而1级干眼症状在SBRT组为0例(0.0%),177Lu联合SBRT组为2例(4.4%)。
结论:综上所述,与单纯SBRT相比,联合使用177Lu-PNT2002与SBRT可显著延长寡复发激素敏感性前列腺癌患者的无进展生存期,且未伴随毒性增加。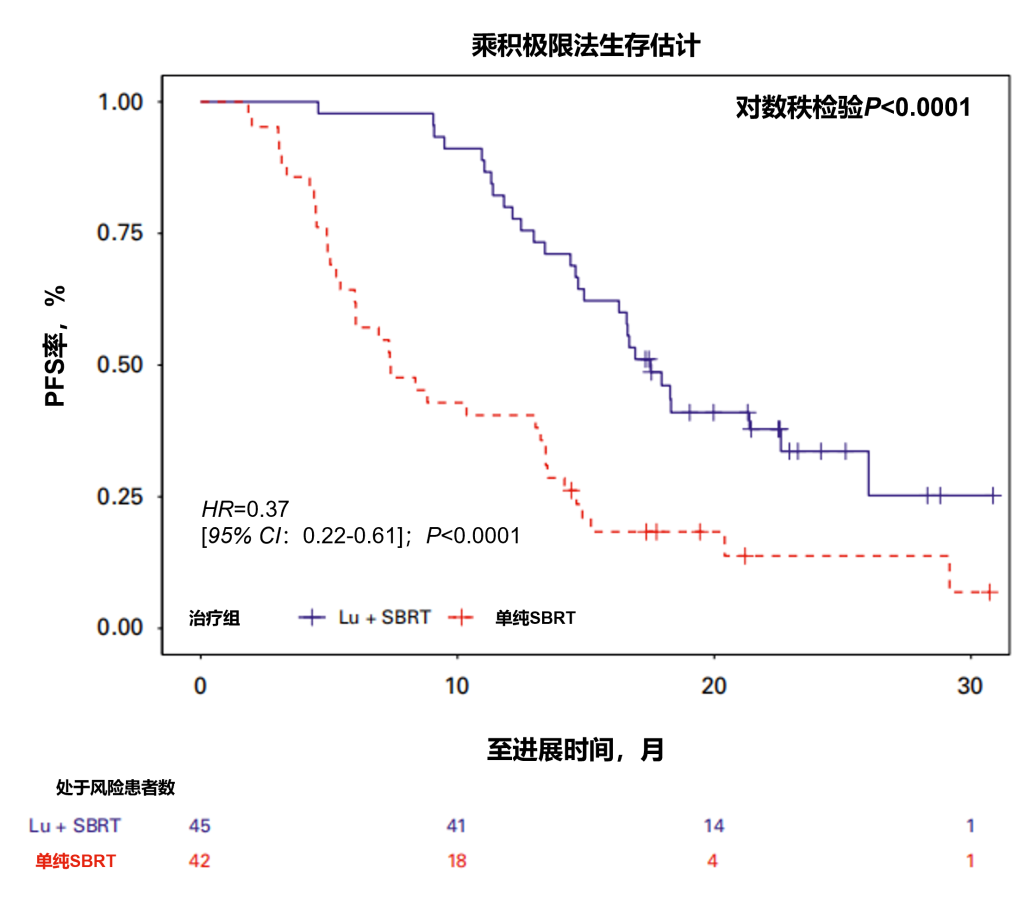
图3. 177Lu联合SBRT组和SBRT组的无进展生存期
6. 局部前列腺癌根治性放疗联合雄激素剥夺治疗的最佳时长:一项荟萃分析
发表期刊:JAMA Oncol
背景及目的:由于临床试验中患者的治疗依从性和治疗时长存在差异,目前对于局部前列腺癌患者接受雄激素剥夺疗法(ADT)的最佳治疗时长尚不明确。本研究旨在确定接受放疗的前列腺癌患者进行ADT治疗的最佳时长。
方法:本研究是一项纳入13项随机III期临床试验的10266例个体患者数据荟萃分析,评估了单独放疗或联合雄激素剥夺疗法(ADT)的治疗效果。患者中位随访时间为11.3年(IQR 9.5-14.5年),ADT疗程为0至36个月。纳入患者中大多数(7392例,72%)为美国国家综合癌症网络(NCCN)高危或极高危患者。采用意向性治疗和实际治疗两种分析方式。根据预后风险组计算了为预防1例10年远处转移需要治疗的患者数(NNT)。分析时间为2023年1月5日至8月15日。
研究终点:本研究主要终点为总生存期,定义为从随机分组至死亡或末次随访的时间。次要终点包括生化复发、远处转移、前列腺癌特异性死亡率及其他原因死亡率。
主要结果:以未接受ADT治疗为参照,长期ADT(LT-ADT)的使用与总生存期的改善相关,但这种获益呈非线性特征,治疗时长需超过约9至12个月才显现。前列腺癌特异性死亡率也呈现相似趋势,与长期ADT治疗存在非线性关联(图4)。相比之下,长期使用ADT与其他原因死亡率呈近似线性上升相关(与0个月ADT相比,28个月ADT的HR=1.28;95% CI:1.09-1.50;P = 0.002)。
按照预设方案,研究根据放疗剂量、NCCN风险分级和年龄进行了分析。基于相对效应量估算的ADT最佳时长不受放疗剂量或风险分组的影响。研究还根据基线预后风险评估了延长ADT治疗的绝对获益。ADT治疗时长每增加6个月时10年远处转移发生率的绝对差异,以及针对不同预后风险患者为预防1例10年远处转移所需治疗的患者数(NNT)。对于仅有1个中危因素、具有2个或更多中危因素、NCCN高危以及NCCN极高危的患者,为不使NNT超过35例,ADT的最佳治疗时长分别为0个月、6个月、12个月和无法确定。
结论:本次荟萃分析的结果表明,对于接受根治性放疗联合ADT治疗的前列腺癌男性患者,ADT治疗时长带来的相对获益呈现非线性特征,超过约12个月后获益有限。ADT疗程延长对前列腺癌特异性死亡率与其他原因死亡率的影响存在差异,因此需要根据患者的预后风险、合并症、预期寿命及个人意愿进行个体化的ADT治疗决策。
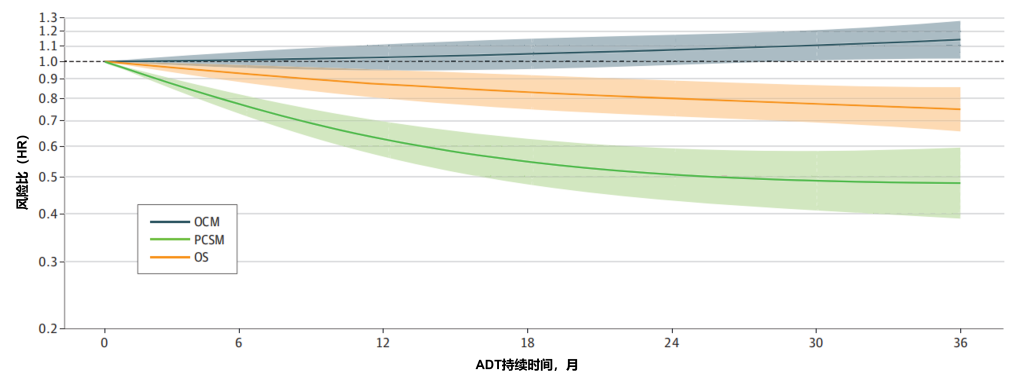
图4. 以平滑样条模型分析:总生存期(OS)、前列腺癌特异性死亡率(PCSM)及其他原因死亡率(OCM)作为雄激素剥夺疗法(ADT)持续时间连续变量的函数关系
7. 激素敏感性前列腺癌的个体化强化治疗
发表期刊:Nat Rev Clin Oncol
背景及目的:传统上,激素敏感性前列腺癌(HSPC)的全身治疗主要依赖于单一的雄激素剥夺疗法(ADT)。然而,在过去十年中,随着对这类癌症广泛生物学基础的深入理解,强化治疗策略已取得显著进展。在ADT基础上联合雄激素受体通路抑制剂(ARPIs)、多西他赛和/或放疗已被证实对特定患者亚组有益,而AKT抑制剂、放射性配体疗法以及聚腺苷二磷酸核糖聚合酶(PARP)抑制剂正在转移性HSPC患者中进行评估。HSPC的临床分期取决于是否存在局限性前列腺癌病史或初诊即为转移性疾病,以及通过传统计算机断层扫描成像和全身骨显像评估的疾病范围。然而,现代核医学成像技术如前列腺特异性膜抗原PET能够检测到计算机断层扫描和全身骨显像无法发现的微小转移灶;这种更早、更精准的转移检测识别出新的患者亚组,使得某些治疗策略(例如在ADT联合ARPI基础上加用多西他赛)可能适用或不适用。在本综述中,旨在探讨非转移性和转移性HSPC的个体化管理,包括如何筛选适合多西他赛治疗的患者、ARPI的选择以及对原发灶和转移灶的放疗应用。同时讨论了HSPC的新型疗法进展及减轻毒性的重要原则。
关键要点:①局部治疗后出现的激素敏感性前列腺癌(HSPC)临床状态,依据常规影像是否检出转移灶,分为转移性HSPC(mHSPC)和非转移性HSPC(nmHSPC);mHSPC还包括首次就诊即伴新发(同步)转移的患者。②以前列腺特异性膜抗原(PSMA)PET为代表的高灵敏度核医学影像迅速提升了前列腺癌转移灶的检出能力,模糊了传统“非转移”与“转移”界限;部分患者常规影像未见转移,但PSMA PET呈阳性。③nmHSPC患者既往局部治疗史及后续前列腺特异性抗原(PSA)动态变化,可指导治疗选择:局部挽救治疗、观察等待、间歇或持续雄激素剥夺治疗(ADT)、恩扎鲁胺单药或联合ADT。④ADT联合雄激素受体通路抑制剂(ARPI)的二联方案是mHSPC系统治疗的基石;高负荷新发转移患者可能最大获益于ADT–ARPI–多西他赛三联方案,低负荷新发转移患者则可能在ADT–ARPI基础上加用前列腺放疗,以改善肿瘤控制与生存。⑤睾酮抑制相关毒性(骨骼健康受损、心血管代谢疾病、血管舒缩症状、体型改变及心理影响)是HSPC治疗的重要考量。⑥正在进行的临床研究探索新型生物标志物指导策略,旨在明确177Lu-PSMA-617、AKT抑制剂及多聚ADP核糖聚合酶(PARP)抑制剂在mHSPC治疗中的地位。
结论与意义:激素敏感性前列腺癌(HSPC)治疗的强化策略对后续去势抵抗性前列腺癌(CRPC)的治疗也产生了持续影响。临床医生现已面对这样的患者群体:他们在接受过睾酮抑制治疗、雄激素受体通路抑制剂、化疗和/或前列腺放疗后,仍需进行CRPC治疗。这一困境反过来要求未来必须继续发展基于生物标志物的治疗方案,其开发依据可能源自一线疗法所引发的多种耐药机制谱系。得益于过去10年间的治疗进展,确诊为HSPC的患者如今有望获得更长的生存期。临床医生现在的责任是确保患者不仅活得更久,还要活得更好——这需要根据新出现的数据和领域发展动态,采用适应性强且个体化的诊疗策略来推进临床实践。
8. 转移性激素敏感性前列腺癌生存率的比较分析:基于疾病负荷与转移时机的网络荟萃分析动态研究
发表期刊:Eur Urol
研究目的:研究旨在评估当代系统性治疗方案在不同临床相关预后亚组(同期高负荷[SHV]与低负荷[SLV]转移,以及异时性高负荷[MHV]与低负荷[MLV]转移)的转移性激素敏感性前列腺癌(mHSPC)患者中的比较疗效。
研究设计:本动态网络荟萃分析采用“动态交互证据合成”(LIvE)框架进行。纳入了评估雄激素受体通路抑制剂(ARPIs)、多西他赛(D)或两者联合进行强化治疗的III期随机对照试验。针对总体人群及每个预后亚组(SHV、SLV、MHV、MLV)进行了混合治疗比较分析,评估指标包括总生存期(OS)和无进展生存期。本次动态系统综述共纳入11项试验(涉及12,668名患者和12种独特治疗方案)。
主要结果:按不同治疗类别分析时,ARPI + D + ADT联合方案相比ARPI + ADT(HR=0.81;95% CI:0.68–0.96)、D + ADT(HR=0.73;95% CI:0.64–0.82)以及单纯ADT(HR=0.56;95% CI:0.48–0.66)均显示出总生存期改善。而ARPI + ARPI + ADT联合方案仅在与单纯ADT比较时表现出具有统计学显著性的总生存期改善(HR=0.65;95% CI:0.55–0.77)。ARPI + D + ADT与ARPI + ARPI + ADT之间、ARPI + ADT与D + ADT之间均未观察到统计学显著差异(图5)。按具体治疗方案分析时,总生存期的结果模式与治疗类别分析一致,无进展生存期也观察到类似结果。
结论与意义:基于LIvE框架的现有证据表明,对于适合接受多西他赛治疗的同期高负荷转移性激素敏感性前列腺癌(SHV mHSPC)患者,三联全身治疗方案是首选。对于其他所有mHSPC亚组患者,雄激素受体通路双重疗法优于单纯ADT治疗。对于能够获得并耐受ARPI治疗的患者,多西他赛双重治疗方案并无应用价值。
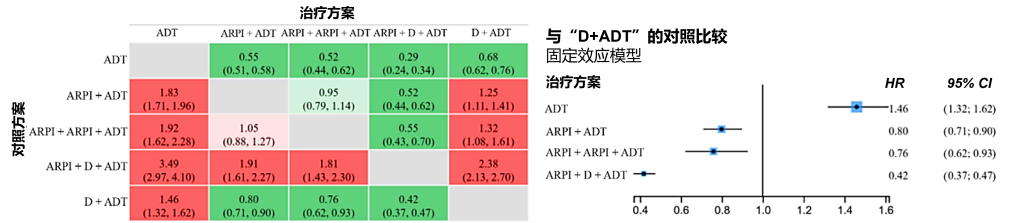
图5. 总体人群中按治疗类别划分的总生存期(OS)与无进展生存期(PFS)混合治疗比较分析结果
9. 去势抵抗性前列腺癌中AR基因位点改变的谱系与临床分级体系
发表期刊:Ann Oncol
背景及目的:体细胞雄激素受体(AR)基因改变是转移性去势抵抗性前列腺癌(mCRPC)治疗耐药的关键驱动因素,但其发生率、临床影响及发生机制仍未完全阐明。为填补这些知识空白,本研究分析了迄今最大规模的mCRPC患者元队列,该队列包含匹配的治疗史与结局数据,并涵盖AR基因及调控位点的可测序区域以及71个在mCRPC中反复出现异常的基因的全面胚系与体细胞测序数据。本研究系统描绘了AR基因改变的谱系与分布特征,定义了新的AR基因型及其与基础基因组学的关系,并阐明了特定AR基因改变对治疗结局的影响。
患者与方法:研究整合了来自8项临床试验和1个地区生物样本库的1751例mCRPC患者,共3048份血浆游离DNA及其匹配的白细胞DNA样本,构建了一个元队列。所有样本均采用定制靶向杂交捕获测序面板(连续多代升级)进行测序,该面板广泛覆盖AR基因位点及71个前列腺癌相关基因,能够全面表征AR基因型特征,包括增强子与基因拷贝数扩增、突变或结构重排。
主要结果:在84%的转移性去势抵抗性前列腺癌(mCRPC)患者中检测到体细胞AR基因改变,这些改变受到包括TP53和DNA修复缺陷在内的基础基因组特征影响。Wnt突变型肿瘤表现出独特的AR扩增结构特征,主要表现为优先整合一种下游替代增强子且拷贝数较低。AR突变存在于19.7%的mCRPC病例中,通常呈亚克隆分布,并在仅存在AR增强子增益的肿瘤中富集。研究根据治疗反应建立了AR基因型的功能等级体系,并鉴定出一类特定的AR重排类型——该重排导致配体结合域在第4内含子或第4外显子处发生截断(ALTR4)。这类重排受到强烈的正向选择,且对AR通路抑制剂的疗效产生显著影响,其机制不同于其他作为AR扩增副产物出现的重排类型。本研究提供证据表明,部分AR扩增通过伴随Xq染色体缺失的断裂-融合-桥循环机制产生。约16%的mCRPC病例未检测到AR改变,且ETS基因融合发生率降低,其中许多病例对AR通路抑制剂表现出显著应答。
结论:综上所述,研究对AR及驱动基因基因组改变的全面解析,为理解转移性前列腺癌中AR通路抑制剂耐药机制提供了框架。这些发现可能指导开发新型AR靶向疗法及生物标志物驱动的治疗策略,以克服晚期前列腺癌的耐药问题。未来整合基因组学、转录组学和蛋白质组学分析的研究,对于全面阐明mCRPC中AR介导耐药的复杂机制至关重要。
尿路上皮癌
10. 注射用维迪西妥单抗联合特瑞普利单抗治疗表达人表皮生长因子受体2(HER2)的晚期尿路上皮癌
发表期刊:N Engl J Med
背景及目的:靶向人表皮生长因子受体2(HER2)的抗体偶联药物单药治疗已在化疗难治性HER2阳性局部晚期或转移性尿路上皮癌患者中显示出初步临床疗效。既往数据显示,HER2特异性药物维迪西妥单抗无论是单药还是与程序性细胞死亡蛋白1(PD-1)靶向免疫疗法联合,均在该癌症治疗中展现出良好的抗肿瘤活性和安全性。本次开展了一项多中心、开放标签、随机分组的III期临床试验(RC48-C016),旨在评估维迪西妥单抗联合特瑞普利单抗对比铂类化疗,在既往未经治疗的局部晚期或转移性尿路上皮癌患者中的疗效和安全性。
本文报道了预设的无进展生存期分析结果及同步开展的总生存期期中分析结果。
方法:在这项多中心、开放标签、随机分组的III期临床试验中,共有484例患者接受随机分组,将既往未经治疗的HER2表达(免疫组化评分1+、2+或3+)局部晚期或转移性尿路上皮癌患者按1:1比例分配至两组:一组每2周接受维迪西妥单抗联合PD-1特异性抗体特瑞普利单抗治疗,另一组每3周接受化疗(吉西他滨联合顺铂或卡铂)。双重主要终点为无进展生存期(由设盲的独立评审委员会评估)和总生存期。次要终点包括客观缓解率和安全性。本文报告预设的无进展生存期分析及总生存期期中分析结果。中位随访时间为18.2个月。
主要结果:双重主要终点分析结果:根据设盲独立评审委员会的评估,维迪西妥单抗+特瑞普利单抗组的无进展生存期显著长于化疗组(中位无进展生存期:13.1个月[95% CI:11.1-16.7]对比6.5个月[95% CI:5.7-7.4];疾病进展或死亡的层叠风险比为0.36[95% CI:0.28-0.46];双侧P<0.001)(图6)。维迪西妥单抗+特瑞普利单抗组预估12个月无进展生存率为54.5%(95% CI:47.3-61.1),化疗组为16.2%(95% CI:10.7-22.8)。无进展生存获益在所有预设亚组中基本一致,包括内脏转移状态、顺铂适用性以及程序性死亡配体1(PD-L1)表达水平。截至数据截止日期,维迪西妥单抗+特瑞普利单抗治疗的总生存期显著长于化疗(中位总生存期:31.5个月[95% CI:21.7-未评估]对比16.9个月[95% CI:14.6-21.7];死亡的层叠风险比为0.54[95% CI:0.41-0.73];双侧P<0.001)(图7)。维迪西妥单抗+特瑞普利单抗组的预估12个月总生存率为79.5%(95% CI:73.6-84.2),化疗组为62.5%(95% CI:55.6-68.6)。
次要终点分析结果:研究者评估的维迪西妥单抗+特瑞普利单抗的无进展生存期获益与设盲独立评审委员会的评估结果一致。在维迪西妥单抗+特瑞普利单抗组中,经设盲独立评审委员会评估,185例患者(76.1% [95% CI:70.3-81.3])达到客观缓解,其中11例为完全缓解,174例为部分缓解。化疗组中,经设盲独立评审委员会评估,121例患者(50.2% [95% CI:43.7-56.7])达到客观缓解,其中3例为完全缓解,118例为部分缓解。所有预设亚组均观察到一致的肿瘤缓解情况。维迪西妥单抗+特瑞普利单抗组的中位缓解持续时间为14.6个月(95% CI:11.3-18.7),化疗组为5.6个月(95% CI:5.3-5.8)。
安全性分析:根据研究者评估,在维迪西妥单抗+特瑞普利单抗组中,243例接受过至少一次试验治疗的患者中有240例(98.8%)出现任意级别的治疗相关不良事件;化疗组中,222例接受过至少一次试验治疗的患者全部(100%)出现任意级别的治疗相关不良事件。治疗相关不良事件导致治疗中止的发生率分别为:维迪西妥单抗联合特瑞普利单抗组12.3%,化疗组10.4%。
研究局限性:本试验除样本量有限外,还存在一些局限性。首先,作为一项仅在中国开展的多中心试验,其研究结果对其他人群的普适性尚未明确。其次,维迪西妥单抗+特瑞普利单抗组和化疗组患者的完全缓解率低于当代其他试验报告的数据(尽管跨试验比较需谨慎解读)。在未经治疗的HER2表达局部晚期或转移性尿路上皮癌中,维迪西妥单抗联合帕博利珠单抗的II期数据显示完全缓解率更高(达35%)。目前正在进行的国际III期试验SGNDV-001旨在研究维迪西妥单抗联合帕博利珠单抗,可能有助于解答上述问题。第三,本试验期间无法使用阿维鲁单抗进行维持治疗,因为该药物尚未在中国获批。然而,真实世界数据显示,仅20%-40%接受铂类药物治疗的患者后续接受了阿维鲁单抗维持治疗[26-28],而临床试验中的比例甚至更低(EV-302试验为30.4%,CheckMate 901试验为10.5%)。
结论:综上所述,本研究显示在未经治疗的HER2表达局部晚期或转移性尿路上皮癌患者中,维迪西妥单抗联合特瑞普利单抗治疗相较于化疗,无进展生存期和总生存期均显著延长。
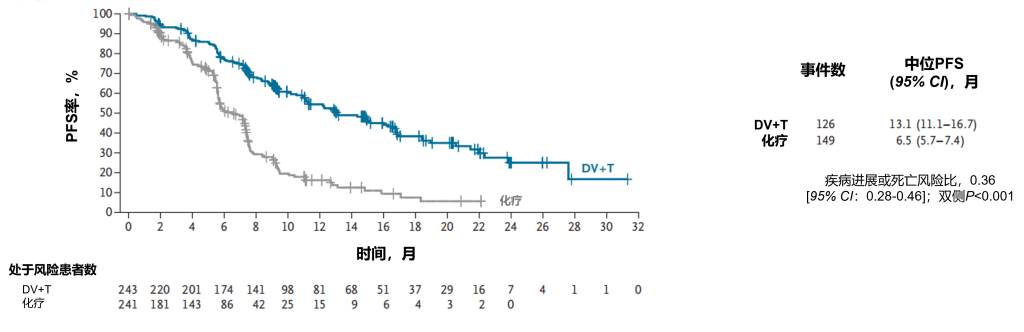
图6. 经设盲独立评审委员会评估的无进展生存期分析
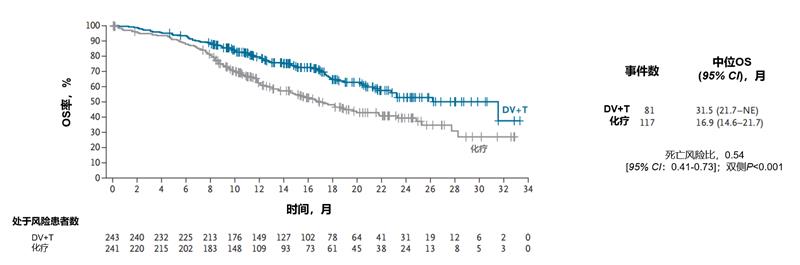
图7. 总生存期分析
参考文献
- Flippot R, Vano YA, Dalban C, et al. Nivolumab in Metastatic Clear-cell Renal Cell Carcinoma: An Integrative Biomarker Analysis from the NIVOREN GETUG-AFU 26 Phase 2 Study[J]. Eur Urol. 2025 Nov 11:S0302-2838(25)04730-X.
- Dawidek MT, Calderon LP, Shah PK, et al. MLH1 Mismatch Repair Deficiency Predicts Exceptional Response to Immune Checkpoint Inhibition in Clear-cell Renal Cell Carcinoma[J]. Eur Urol. 2025 Nov 4:S0302-2838(25)04721-9.
- Abu-Remaileh M, Stransky LA, Bhalerao N, et al. Targeting of HIF2-driven cachexia in kidney cancer[J]. Nat Med. 2025 Nov 28.
- Albiges L, Powles T, Sharma A, et al. CaboPoint: A Phase 2 Study of Second-line Cabozantinib After Checkpoint Inhibitor-based Combination Therapy in Patients with Metastatic Renal Cell Carcinoma[J]. Eur Urol. 2025 Sep 29:S0302-2838(25)00435-X.
- Kishan AU, Valle LF, Wilhalme H, et al. 177Lu-Prostate-Specific Membrane Antigen Neoadjuvant to Stereotactic Ablative Radiotherapy for Oligorecurrent Prostate Cancer (LUNAR): An Open-Label, Randomized, Controlled, Phase II Study[J]. J Clin Oncol. 2025 Dec 20;43(36):3812-3821.
- Zaorsky NG, Sun Y, Nabid A, et al. Optimal Duration of Androgen Deprivation Therapy With Definitive Radiotherapy for Localized Prostate Cancer: A Meta-Analysis[J]. JAMA Oncol. 2025 Nov 20:e254800.
- Cilento MA, Butler LM, Emmett L, et al. Personalized intensification of treatment for hormone-sensitive prostate cancer[J]. Nat Rev Clin Oncol. 2025 Nov 27.
- Riaz IB, Ahmed Naqvi SA, Faisal KS, et al. Comparative Survival in Metastatic Hormone-sensitive Prostate Cancer by Volume of Disease and Timing of Metastasis: A Living Network Meta-analysis[J]. Eur Urol. 2026 Jan;89(1):31-44.
- Virtanen T, Kwan EM, Parekh K, et al. Repertoire and clinical hierarchy of AR locus alterations in castration-resistant prostate cancer[J]. Ann Oncol. 2025 Oct 27:S0923-7534(25)06188-5.
- Sheng X, Zeng G, Zhang C, et al. Disitamab Vedotin plus Toripalimab in HER2-Expressing Advanced Urothelial Cancer[J]. N Engl J Med. 2025 Dec 11;393(23):2324-2337.



