本品适用于对其他系统治疗(如激素或生物制剂)应答不佳或不适宜上述治疗的难治性、中重度特应性皮炎成人和 12 岁及以上青少年患者1。
(1)用量1:
- 本品常规推荐剂量为 100 mg,每日一次。如果每日一次口服 100 mg 本品未实现充分应答,可考虑将剂量增加到 200 mg 每日一次。
- 对于没有血栓形成、主要心血管不良事件和恶性肿瘤高风险的需要更迅速地缓解症状的 65 岁以下成年患者(例如:重度或泛发性的高疾病负担,和/或复发的患者):可考虑以 200 mg 每日一次开始治疗 12 周,然后降低至 100 mg 每日
一次口服,以维持应答。如果剂量降低后无法维持充分应答,则将剂量增加回 200 mg 每日一次。 - 如果发现 200 mg 每日一次应答不足,请停止治疗。应使用维持应答所需的最低有效剂量。
- 用药 12 周后没有治疗获益证据的患者,应考虑停用本品。一些最初没有治疗获益和部分应答的患者在 12 周后继续治疗可能有所改善。
(2)用法(具体请参见说明书)1:
- 应在每天大致相同的时间口服阿布昔替尼,可与食物同服或不同服。
- 如果漏服一剂药物,应尽快服用该剂量,除非与下一次剂量服用时间相距不到 12 小时,在这种情况下,应忽略漏服的剂量。此后,按常规计划时间继续用药。
- 阿布昔替尼片应整片用水吞服,不可压碎、切开或咀嚼服用。
(3)使用限制1:
不建议将本品与其他 Janus 激酶(JAK) 抑制剂、生物免疫调节剂或其他免疫抑制剂联合使用。
见下表1。在轻度和中度肾功能损害患者中,如果未实现充分应答,可将本品的剂量加倍1。
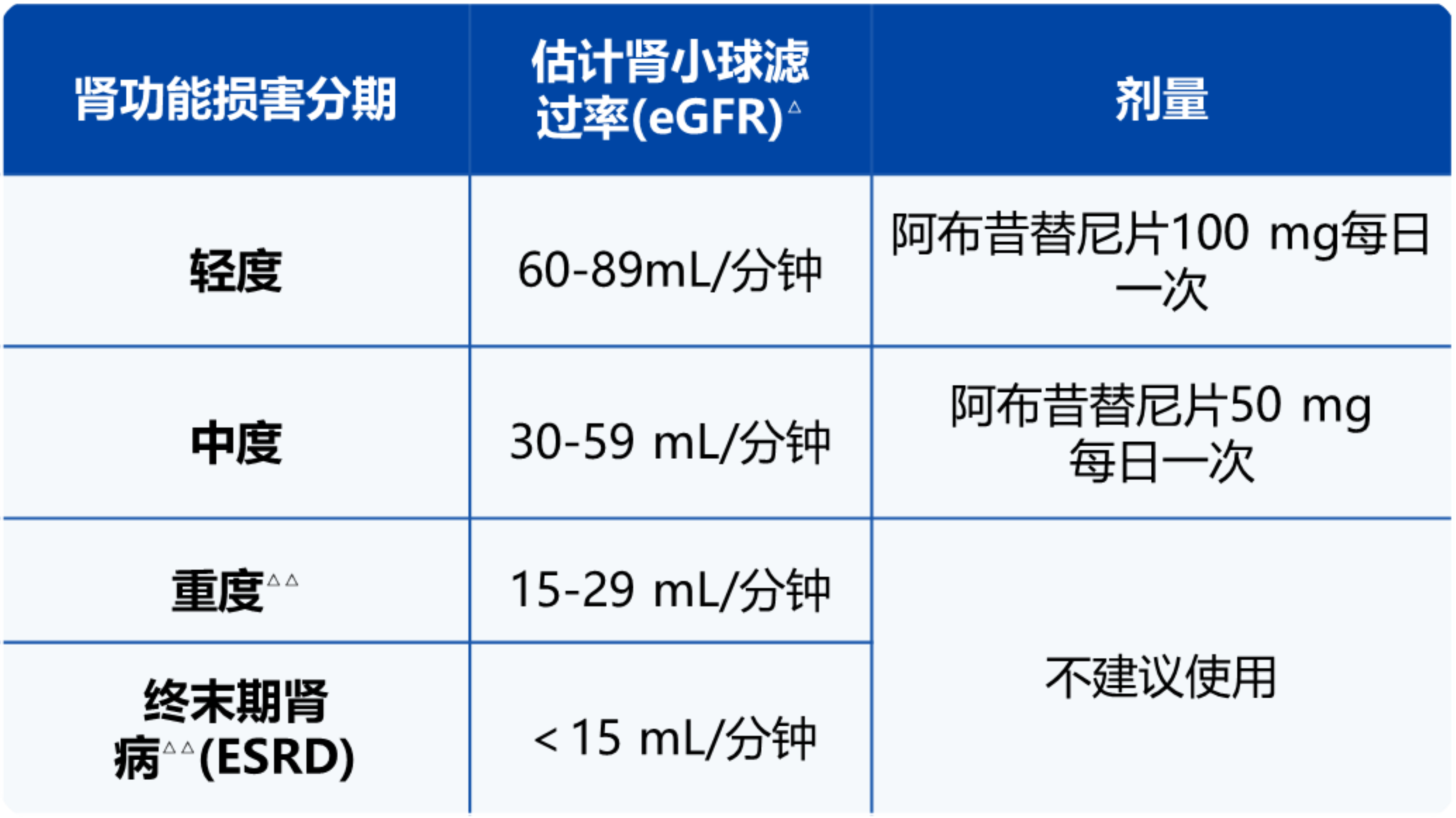
△ 将通过调整肾病患者饮食(MDRD)公式来估算肾小球滤过率。
△△ 重度肾功能损害和终末期肾病包括接受肾脏替代治疗的患者。
轻度(Child Pugh A 级)或中度(Child Pugh B 级)肝功能损害患者无需调整剂量;重度肝功能损害患者不建议使用阿布昔替尼1。
如果患者发生严重或机会性感染,请停止阿布昔替尼治疗并控制感染1。在重新开始阿布昔替尼治疗之前,应仔细考虑使用阿布昔替尼治疗的风险和获益1。
建议在基线时、治疗开始后4 周和剂量增加后4 周进行全血细胞计数(CBC)评估1。对于发生血液学异常的接受长期本品治疗的患者,可延长实验室评估1。
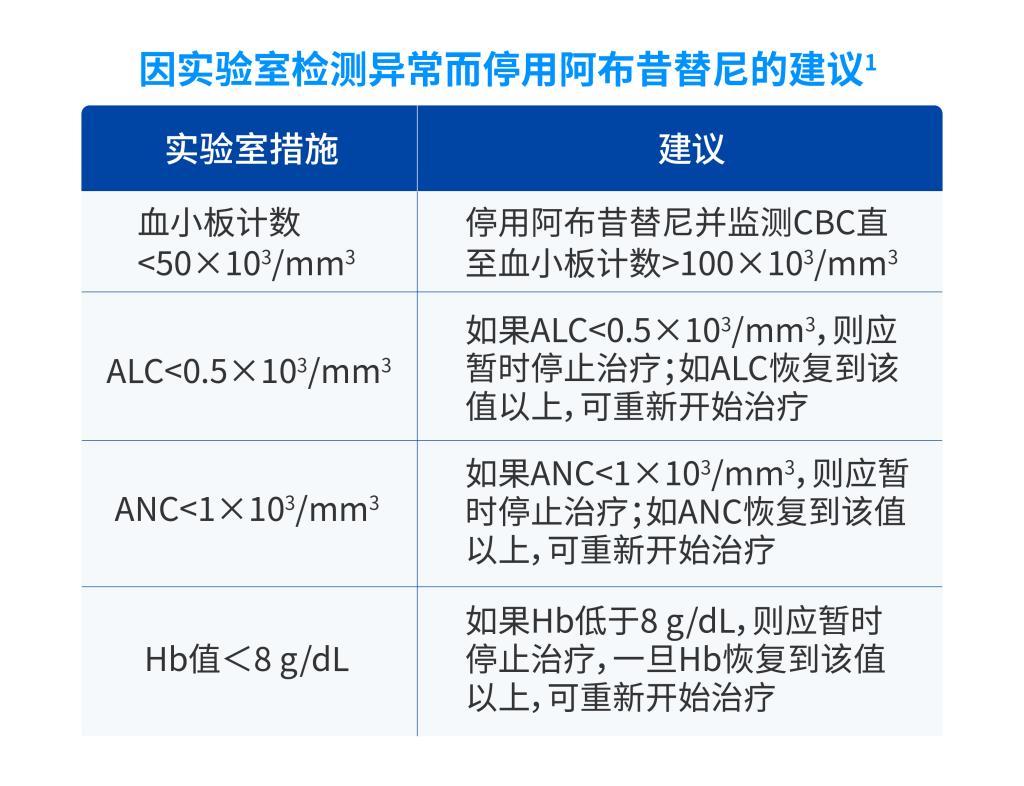
ALC=淋巴细胞绝对计数;ANC=中性粒细胞绝对计数;CBC=全血细胞计数;Hb=血红蛋白
- 妊娠和哺乳期不建议使用本品1。
- 阿布昔替尼临床试验中报告的现有妊娠数据不足以确定主要出生缺陷、流产或其他母体或胎儿不良结局的药物相关风险。适用人群出现严重的出生缺陷和流产的可能的风险尚不明确1。
- 目前尚无阿布昔替尼是否存在于人类乳汁中、对母乳喂养婴儿的影响或对乳汁分泌影响的相关数据。由于在成人中的严重不良结果,包括严重感染、恶性肿瘤和血栓形成的风险,建议女性在阿布昔替尼治疗期间和末次给药后一天(约 5 - 6 个消除半衰期)不要哺乳1。
阿布昔替尼是 Janus 激酶(JAK)1 抑制剂1。
阿布昔替尼通过阻断三磷酸腺苷(ATP)结合位点可逆性地抑制 JAK1。在酶试验中,阿布昔替尼对 JAK1 的选择性高于 JAK2(28 倍)、JAK3(>340 倍)和酪氨酸激酶(TYK)2(43 倍)以及更广泛的激酶组。目前尚不清楚抑制特定JAK 酶与治疗效果之间的相关性1。
阿布昔替尼给药与血清炎症标志物的剂量依赖性降低相关,包括超敏 C 反应蛋白(hsCRP)、白细胞介素-31(IL-31)和胸腺活化调节趋化因子(TARC)。在停药后 4 周内,这些变化恢复至接近基线水平1。
作用机制视频
下表包括具有影响阿布昔替尼的有临床意义的药物相互作用的药物1。
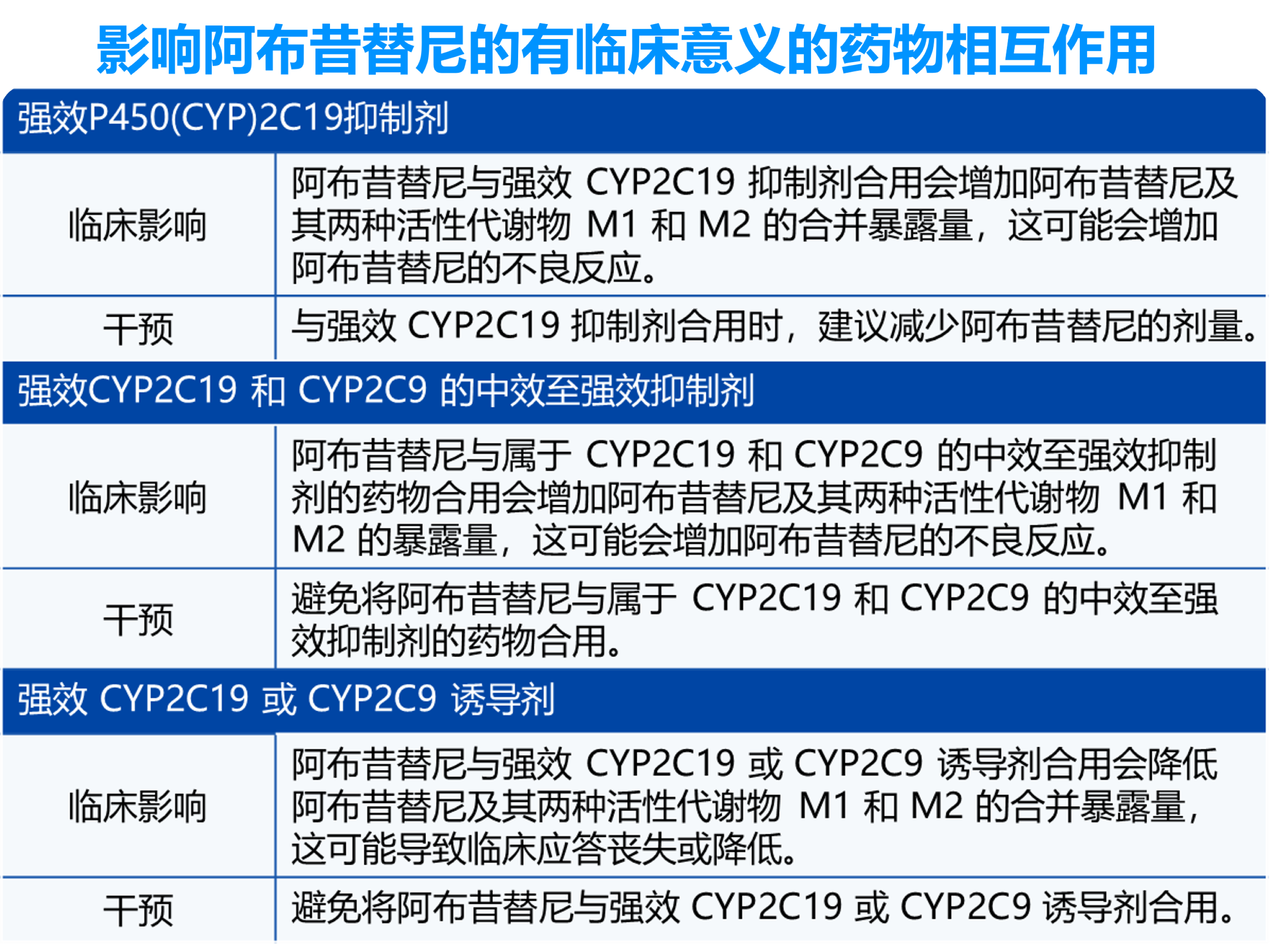
阿布昔替尼对其它药物的影响详见下表1。

在开始阿布昔替尼治疗前,建议患者根据现行免疫接种指南完善所有的免疫接种,包括预防性带状疱疹疫苗接种1。
避免在阿布昔替尼治疗之前、期间和之后立即接种活疫苗1。
- 对本品活性成分或任何辅料成分有超敏反应者1。
- 活动性严重系统性感染,包括结核病1。
- 重度肝功能损伤患者1。
- 妊娠和哺乳期1。
- 阿布昔替尼禁用于在治疗的前 3 个月内接受抗血小板治疗的患者,低剂量阿司匹林(每天≤ 81 mg)除外1。
(1)血常规1:
对于血小板计数<150×103/mm3、淋巴细胞绝对值(ALC)<0.5×103/mm3、中性粒细胞绝对值(ANC)<1×103/mm3 或基线血红蛋白值<8 g/dL的患者,不建议接受阿布昔替尼治疗。
(2)结核病(TB)1:
- 建议在开始治疗前常规对患者进行TB筛查。
- 不建议在活动性TB患者中开始阿布昔替尼治疗。
- 对于潜伏性TB患者或潜伏性TB检测为阴性但具有TB高风险的患者,在开始阿布昔替尼治疗之前应进行针对潜伏性TB的预防性治疗。
(3)病毒性肝炎1:
- 不建议在活动性乙型肝炎或丙型肝炎患者中开始阿布昔替尼治疗。
- 使用本品治疗期间应监测非活动性乙型肝炎患者的乙型肝炎病毒DNA表达。如果在使用本品治疗期间检测到乙型肝炎病毒DNA,请咨询肝脏专科医师。
(1)诱导期的监测1,2
① 建议在治疗开始后的第4周和剂量增加后的第4周监测血常规:
a) 若血小板计数<50×103/mm3应停用阿布昔替尼并监测血常规,直至血小板计数>100×103/mm3;
b) 若淋巴细胞绝对值<0.5×103/mm3、中性粒细胞绝对值<1×103/mm3 或血红蛋白<8 g/dL,则应中断阿布昔替尼治疗,这些指标恢复到上述水平以上可重新开始治疗。
② 应在开始阿布昔替尼治疗后大约4 周时评估血脂参数,并根据高脂血症临床指南进行管理。尚未确定这些血脂参数升高对心血管疾病发病率和死亡率的影响。
③ 使用阿布昔替尼治疗期间及治疗后应密切监测患者是否出现感染体征和症状。
(2)维持期的监测1,2
① 建议在长期维持治疗过程中,至少每12周监测1次上述诱导期监测指标(血常规和血脂)。
② TB高度流行区域的患者可以考虑每年进行TB筛查。
③ 应监测非活动性乙型肝炎患者的乙型肝炎病毒DNA表达。若在使用阿布昔替尼治疗期间检测到乙型肝炎病毒DNA,请咨询肝脏专科医师。
④ 对于皮肤癌高危患者,建议定期进行皮肤检查。
(1)严重感染1
- 接受阿布昔替尼治疗的患者发生可能导致住院或死亡的严重感染的风险增加。最常见的严重感染为单纯疱疹、带状疱疹和感染性肺炎。如果发生严重或机会性感染,请停止阿布昔替尼治疗并控制感染。
- 用于治疗炎症性疾病的Janus激酶(JAK)抑制剂报告的感染:
- 活动性结核病(TB)可表现为肺部或肺外疾病,给药前和给药期间进行潜伏性TB检测,用药前先治疗潜伏性TB,给药期间监测所有患者的活动性TB,即使初始潜伏性TB检测结果为阴性;
- 侵袭性真菌感染包括隐球菌病和肺囊虫病,侵袭性真菌感染的患者可能会表现为播散性疾病而非局灶性疾病;
- 细菌、病毒(包括带状疱疹)和其他机会性病原体引起的感染。
- 避免将阿布昔替尼用于患有活动性、严重感染(包括局部感染)的患者。
- 患有慢性或反复感染的患者在接受阿布昔替尼治疗之前,应当仔细评估治疗的风险和获益。
- 使用阿布昔替尼治疗时和治疗后,应严密监测患者是否出现感染症状和体征,包括治疗前其潜伏性结核病检测结果呈阴性的患者是否可能发展为结核病(参见前文用药前筛查和用药时监测)。
(2)死亡1
- 在一项针对50岁及以上且至少有一个心血管风险因素的类风湿关节炎(RA)患者的大型、随机、上市后安全性研究中,将另一种JAK抑制剂与肿瘤坏死因子(TNF)抑制剂治疗进行比较,观察到JAK抑制剂治疗的全因死亡率较高,包括心源性猝死。
- •阿布昔替尼尚未被批准用于RA患者。
(3)恶性肿瘤1
- 在使用阿布昔替尼治疗的患者中已报告恶性肿瘤。在接受JAK抑制剂治疗炎症性疾病的患者中曾观察到淋巴瘤和其他恶性肿瘤。
- 在接受另一种JAK抑制剂治疗的RA患者中,与TNF抑制剂相比,观察到恶性肿瘤(不包括非黑色素瘤皮肤癌)的发生率更高。
- 当前或既往吸烟患者的风险额外增加。
(4)主要心血管不良事件1
- 在接受阿布昔替尼治疗的患者中报告了主要心血管不良事件。
- 在有至少一个心血管风险因素的50 岁及以上RA患者中,与TNF抑制剂相比,接受另一种JAK抑制剂治疗的患者的主要心血管不良事件(定义为心源性死亡、心肌梗塞和卒中)的发生率较高。
- 当前或既往吸烟患者的风险额外增加。
- 在发生过心肌梗塞或卒中的患者中停止阿布昔替尼治疗。
(5)血栓形成1
- 接受阿布昔替尼治疗的患者中已报告深静脉血栓形成(DVT)和肺栓塞(PE)。接受JAK抑制剂用于治疗炎症性疾病的患者中已报告血栓形成,包括PE、DVT 和动脉血栓形成。这些不良反应很多是严重的,有些甚至导致死亡。
- 在有至少一个心血管风险因素的50 岁及以上RA患者中,与TNF抑制剂相比,接受另一种JAK抑制剂治疗的患者的血栓形成发生率较高。
- 有风险的患者应避免使用阿布昔替尼。如果出现血栓形成症状,应停用阿布昔替尼并进行适当治疗。
在特应性皮炎临床研究中,最常报告的不良反应有1:
- 恶心(15.1%)
- 头痛(7.9%)
- 痤疮(4.8%)
- 单纯疱疹(4.2%)
- 血磷酸肌酸激酶升高(3.8%)
- 呕吐(3.5%)
- 头晕(3.4%)
- 上腹痛(2.2%)
最常见的严重不良反应是感染(0.3%)。
• 下表按系统器官分类和频率列出的不良反应采用以下分类1:
- 非常常见(≥ 1/10)
- 常见(≥ 1/100 至< 1/10)
- 不常见(≥ 1/1000 至< 1/100)
- 罕见(≥ 1/10,000 至< 1/1000)
- 非常罕见(< 1/10000)
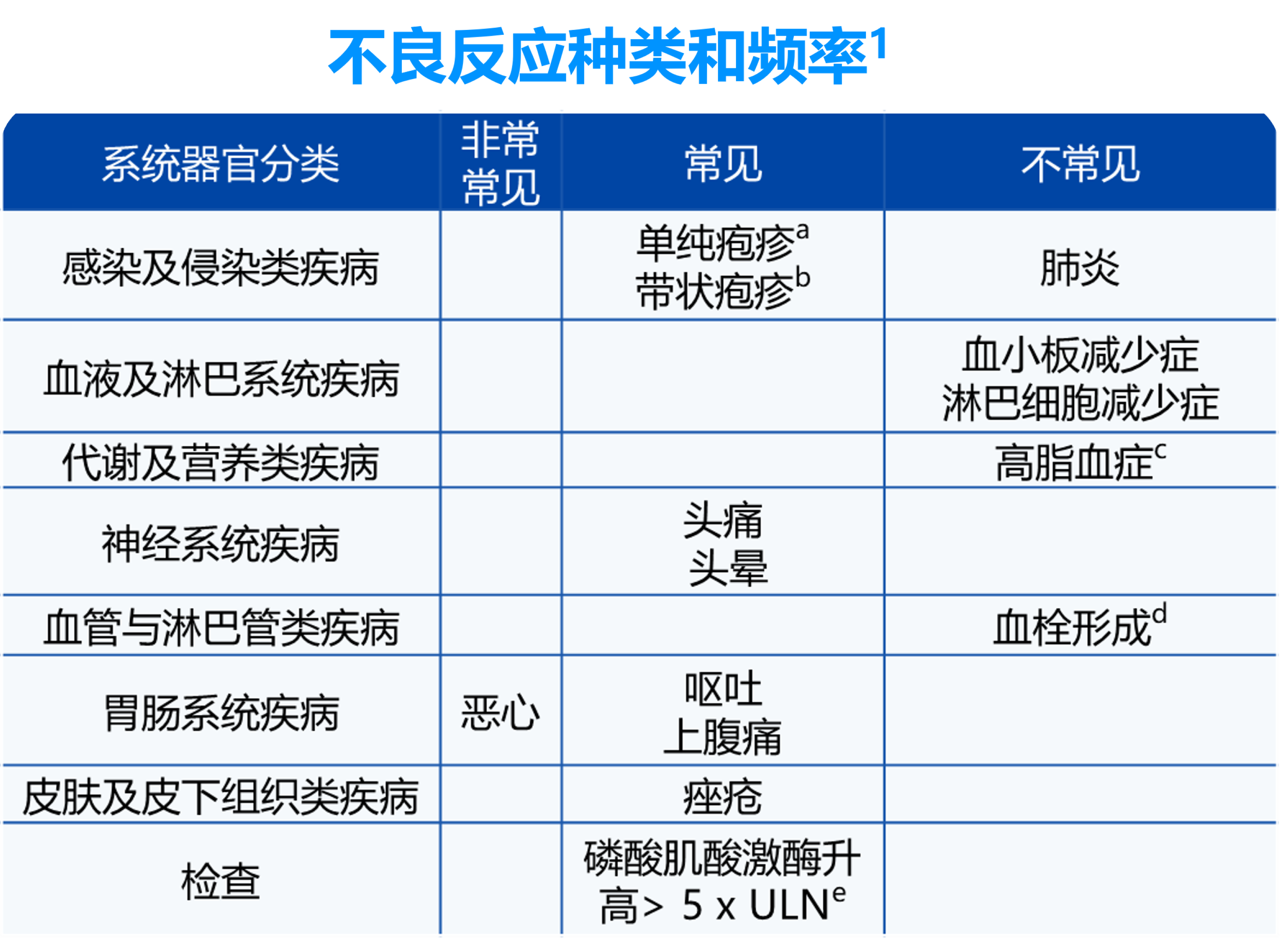
a. 单纯疱疹包括口腔疱疹、眼单纯疱疹、生殖器疱疹和疱疹性皮炎。
b. 带状疱疹包括眼带状疱疹。
c. 高脂血症包括血脂异常和高胆固醇血症。
d. 血栓形成包括肺栓塞和深静脉血栓形成。
e. 实验室监测期间检测到的变化。
- 根据目前已公布的数据,在适用的患者人群及推荐剂量下,阿布昔替尼短期和长期安全性及耐受性良好,大多数不良事件为轻度,且具有自限性,通常不需要停药2。
- 大多数患者的不良反应严重程度为轻度至中度,随餐服用可能会减轻恶心症状12。
(1)血小板减少症1
- 在长达 16 周的安慰剂对照研究中,治疗与剂量相关的血小板计数下降有关。观察到其对血小板计数的最大影响发生于治疗后的 4 周内,此后尽管继续治疗,血小板计数可恢复至基线水平。0.1%接受阿布昔替尼 200 mg 的受试者报告了经复查确认的血小板计数< 50 x 103/mm3,接受 100 mg 或安慰剂治疗的受试者没有报告此类事件。在临床研究(包括长期扩展研究)中接受固定剂量(阿布昔替尼 100 mg 或 200 mg)治疗的所有受试者中,经确认血小板计数< 50×103/mm3 的发生率为 200 mg 组 0.15/100 患者年,100 mg 组 0/100 患者年,大多数发生在第 4 周。在≥65 岁和血小板计数< 75 × 103/mm3 的受试者中发生率更高。
- 若血小板计数<50×103/mm3,应停用阿布昔替尼并监测血常规直至血小板计数>100×103/mm3。
(2)淋巴细胞减少症1
- 在长达 16 周的安慰剂对照研究中,0.3%接受 200 mg 治疗的受试者出现经复查确认的淋巴细胞绝对计数< 0.5×103/mm3,接受 100 mg 或安慰剂治疗的受试者没有报告此类事件。这两例事件均发生在暴露后的前 4 周。在临床研究(包括长期扩展研究)中接受固定剂量(阿布昔替尼 100 mg 或 200 mg)治疗的所有受试者中,接受 200 mg 治疗的受试者(0.34/100 患者年)和接受 100 mg 治疗的受试者(0.05/100 患者年)报告了经复查确认的 ALC < 0.5 × 103/mm3,在≥ 65 岁的受试者中观察到最高的比例。
- 若淋巴细胞绝对值<0.5×103/mm3,则应暂时停止治疗,如淋巴细胞绝对计数恢复到该值以上,可重新开始治疗。
(3)血脂升高1
- 在长达 16 周的安慰剂对照研究中,与安慰剂相比,第 4 周时低密度脂蛋白胆固醇(LDL-c)、总胆固醇和高密度脂蛋白胆固醇(HDL-c)出现剂量相关性增加,且一直维持至治疗期最终访视。与安慰剂组受试者相比,阿布昔替尼组受试者的 LDL/HDL 比值未发生有意义的变化。0.4%暴露于阿布昔替尼 100 mg 的受试者、0.6%暴露于 200 mg 的受试者和 0%暴露于安慰剂的受试者发生了高脂血症相关事件。
- 应在开始阿布昔替尼治疗后大约 4 周时评估血脂参数,并根据高脂血症临床指南进行管理。
(4)磷酸肌酸激酶(CPK)升高1,2
- 在长达 16 周的安慰剂对照研究中,1.8%接受安慰剂治疗的受试者、1.8%接受 100 mg阿布昔替尼治疗的受试者和 3.8%接受 200 mg阿布昔替尼治疗的受试者报告了血 CPK 升高事件(>5×ULN)。大多数升高事件均为一过性事件,且均未导致停药。
- 若出现严重不良反应,应由专科医生进行评估,必要时停药。
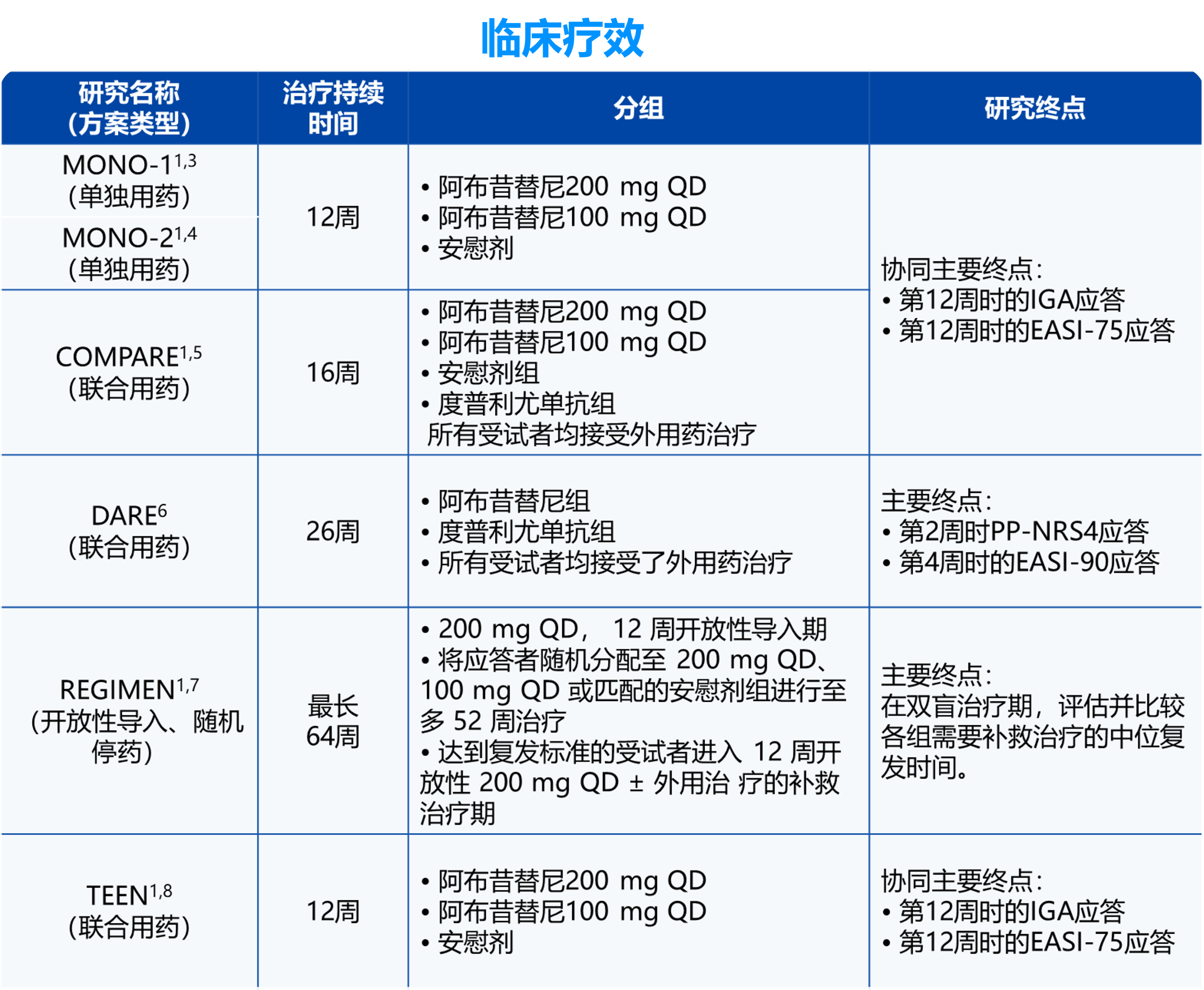
QD:每日一次。IGA应答:研究者整体评估(IGA)评分达到0分(清除)或1分(几乎清除)(5分制量表)且相对于基线下降≥2 分。 EASI-75应答:湿疹面积和严重程度指数(EASI)相对于基线改善≥75%。 EASI-90应答: EASI相对于基线改善≥90%。PP-NRS4应答:峰值瘙痒数字评估量表(PP-NRS)相对于基线改善≥4 分。
备注:阿布昔替尼适用于对其他系统治疗(如激素或生物制剂)应答不佳或不适宜上述治疗的难治性、中重度特应性皮炎成人和 12 岁及以上青少年患者。
阿布昔替尼常规推荐剂量为 100 mg,每日一次。如果每日一次口服 100 mg 本品未实现充分应答,可考虑将剂量增加到 200 mg 每日一次。
对于没有血栓形成、主要心血管不良事件和恶性肿瘤高风险的需要更迅速地缓解症状的 65 岁以下成年患者(例如:重度或泛发性的高疾病负担,和/或复发的患者):可考虑以 200 mg 每日一次开始治疗 12 周,然后降低至 100 mg 每日一次口服,以维持应答。如果剂量降低后无法维持充分应答,则将剂量增加回 200 mg 每日一次。
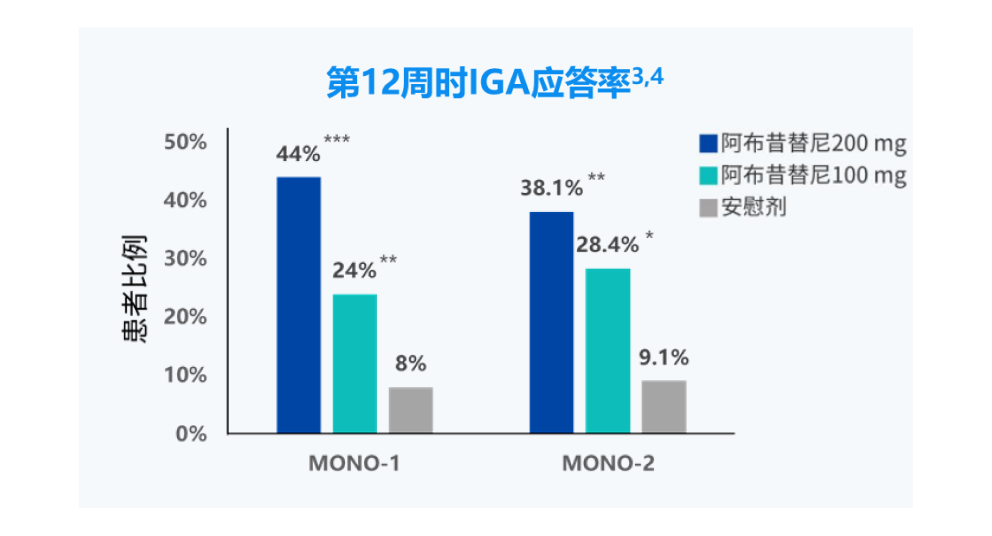
IGA应答:研究者整体评估(IGA)评分达到0分(清除)或1分(几乎清除)(5分制量表)且相对于基线下降≥2 分。
***:与安慰剂相比,P<0.0001。
**:与安慰剂相比,P<0.01。
*:与安慰剂相比,P<0.05。
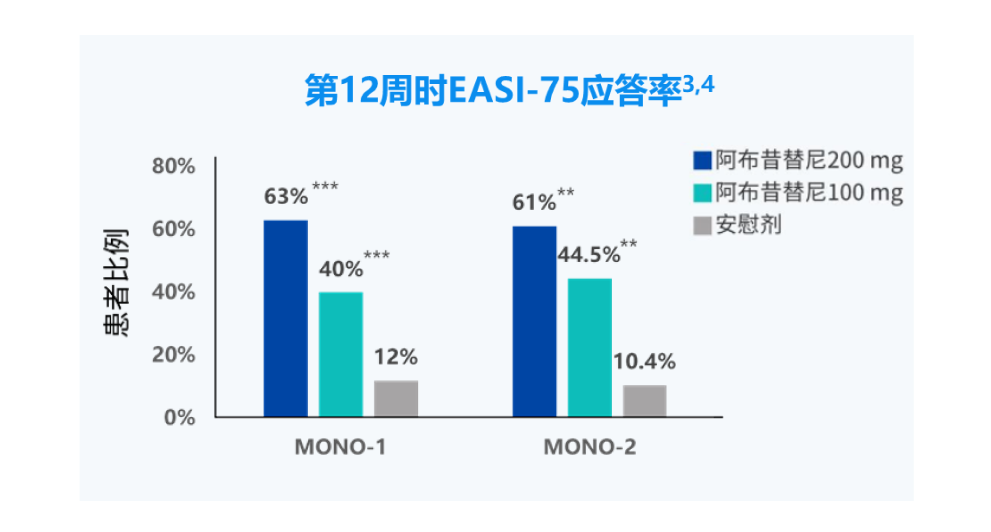
EASI-75应答:湿疹面积和严重程度指数(EASI)相对于基线改善≥75%。
***:与安慰剂相比,P<0.0001
**:与安慰剂相比,P<0.01。
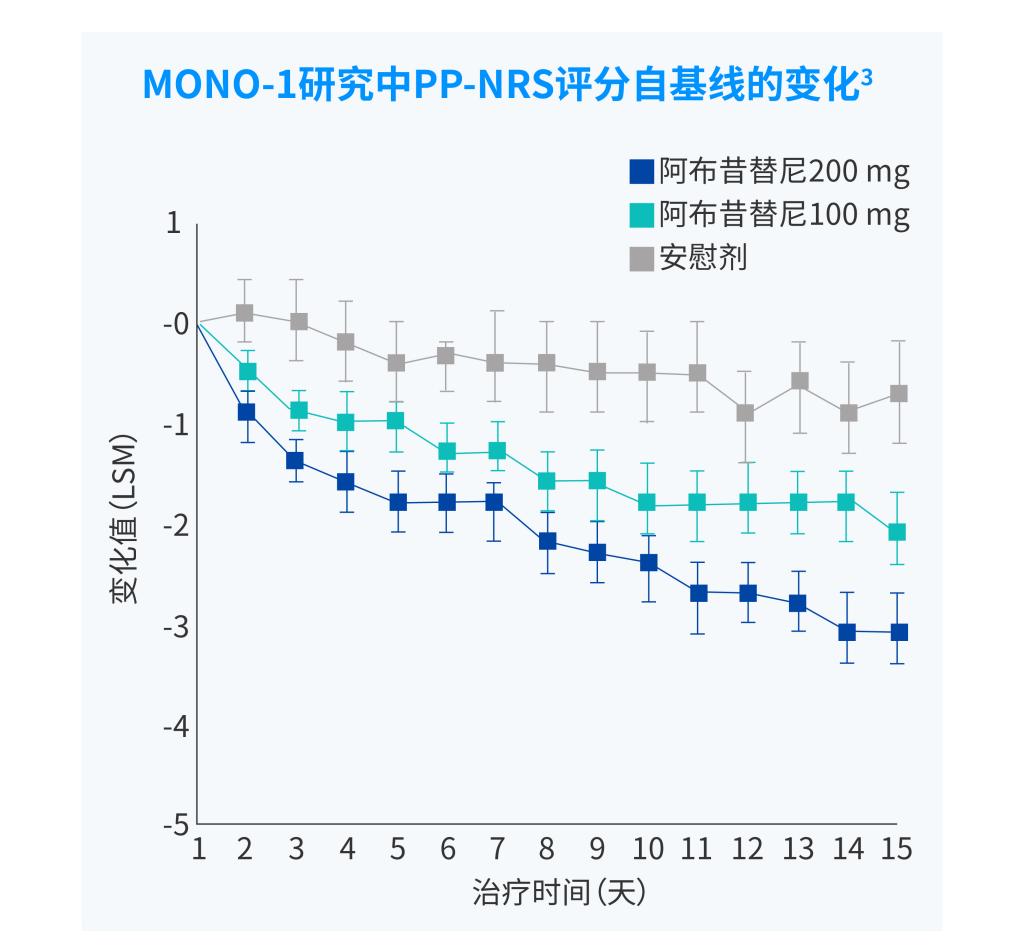
PP-NRS,峰值瘙痒数字评估量表
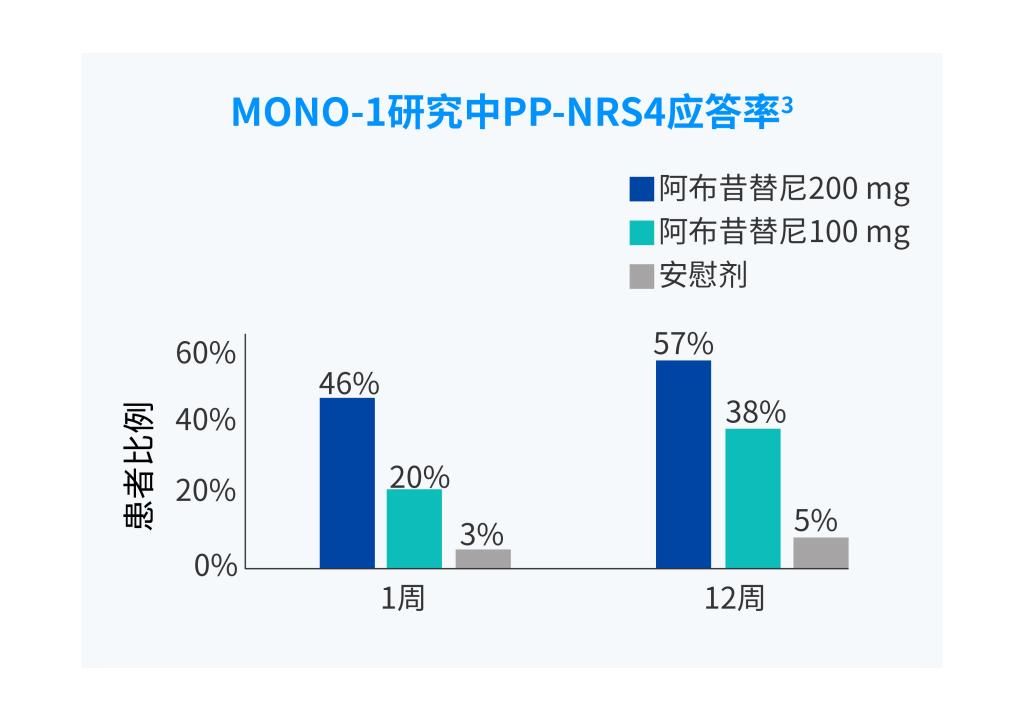
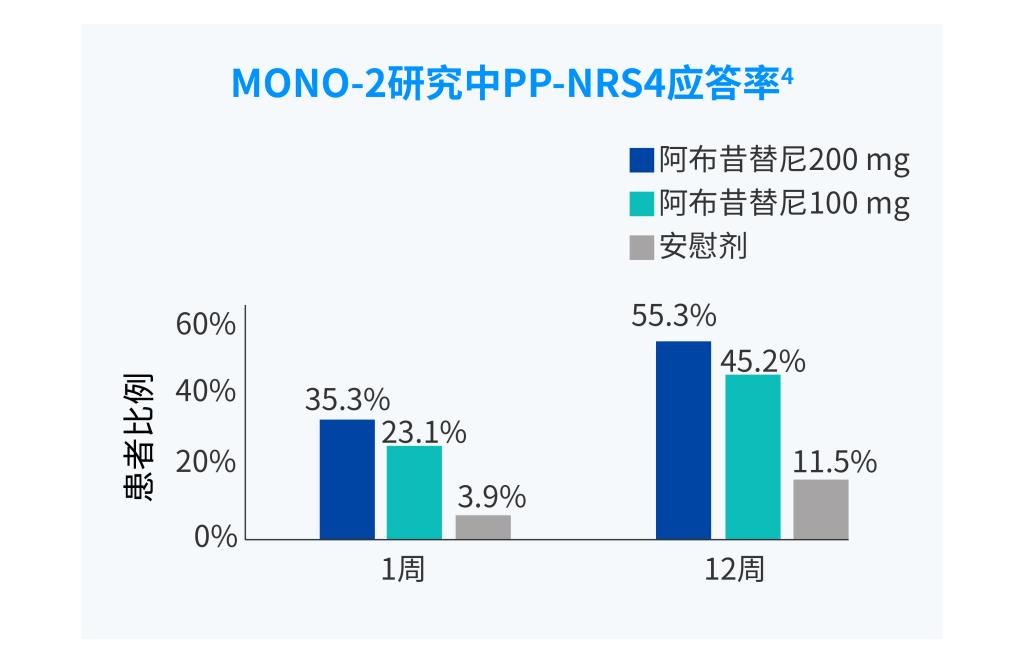
PP-NRS4应答:峰值瘙痒数字评估量表(PP-NRS)相对于基线改善≥4 分。
备注:阿布昔替尼适用于对其他系统治疗(如激素或生物制剂)应答不佳或不适宜上述治疗的难治性、中重度特应性皮炎成人和 12 岁及以上青少年患者。
阿布昔替尼常规推荐剂量为 100 mg,每日一次。如果每日一次口服 100 mg 本品未实现充分应答,可考虑将剂量增加到 200 mg 每日一次。
对于没有血栓形成、主要心血管不良事件和恶性肿瘤高风险的需要更迅速地缓解症状的 65 岁以下成年患者(例如:重度或泛发性的高疾病负担,和/或复发的患者):可考虑以 200 mg 每日一次开始治疗 12 周,然后降低至 100 mg 每日一次口服,以维持应答。如果剂量降低后无法维持充分应答,则将剂量增加回 200 mg 每日一次。
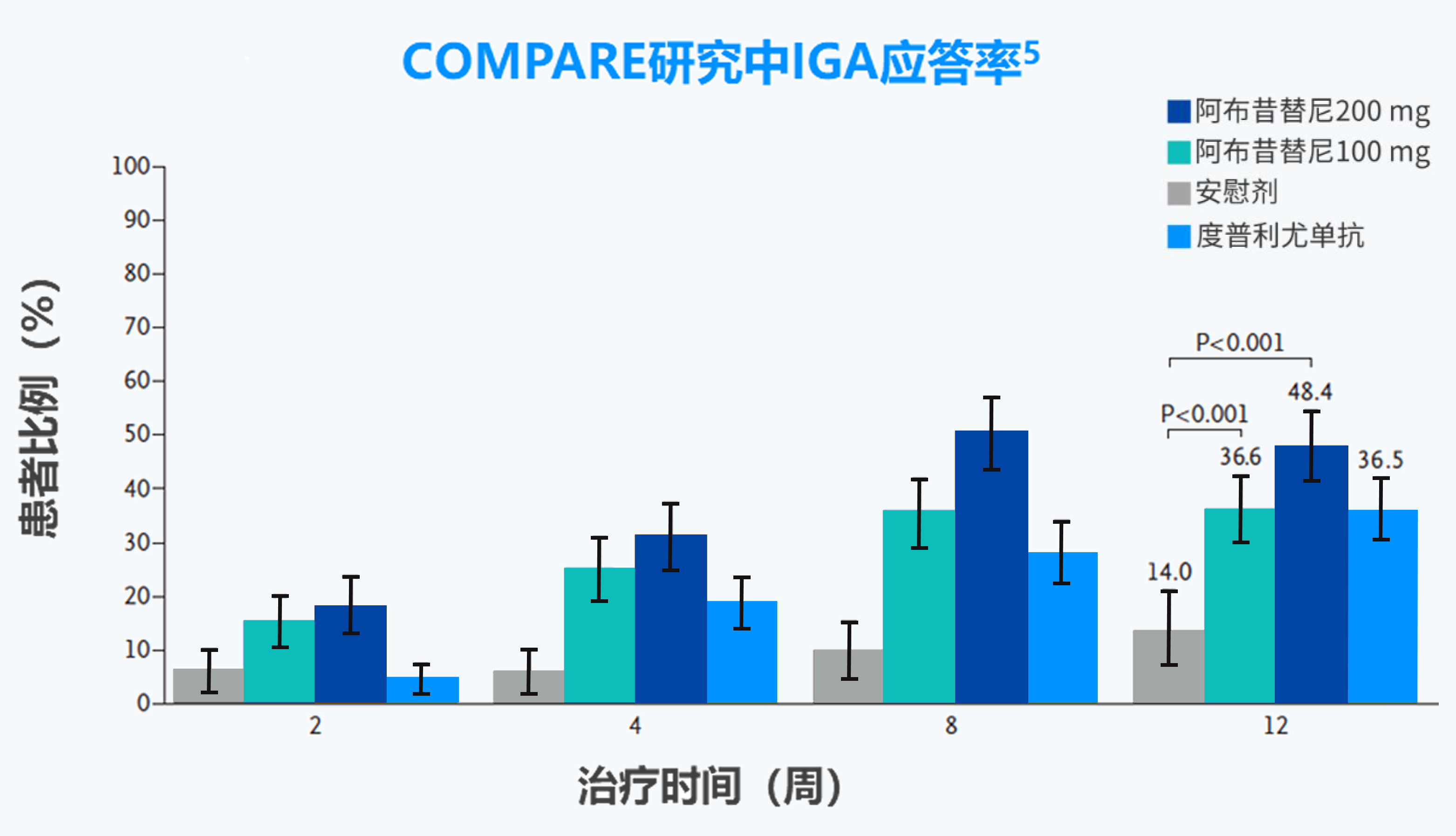
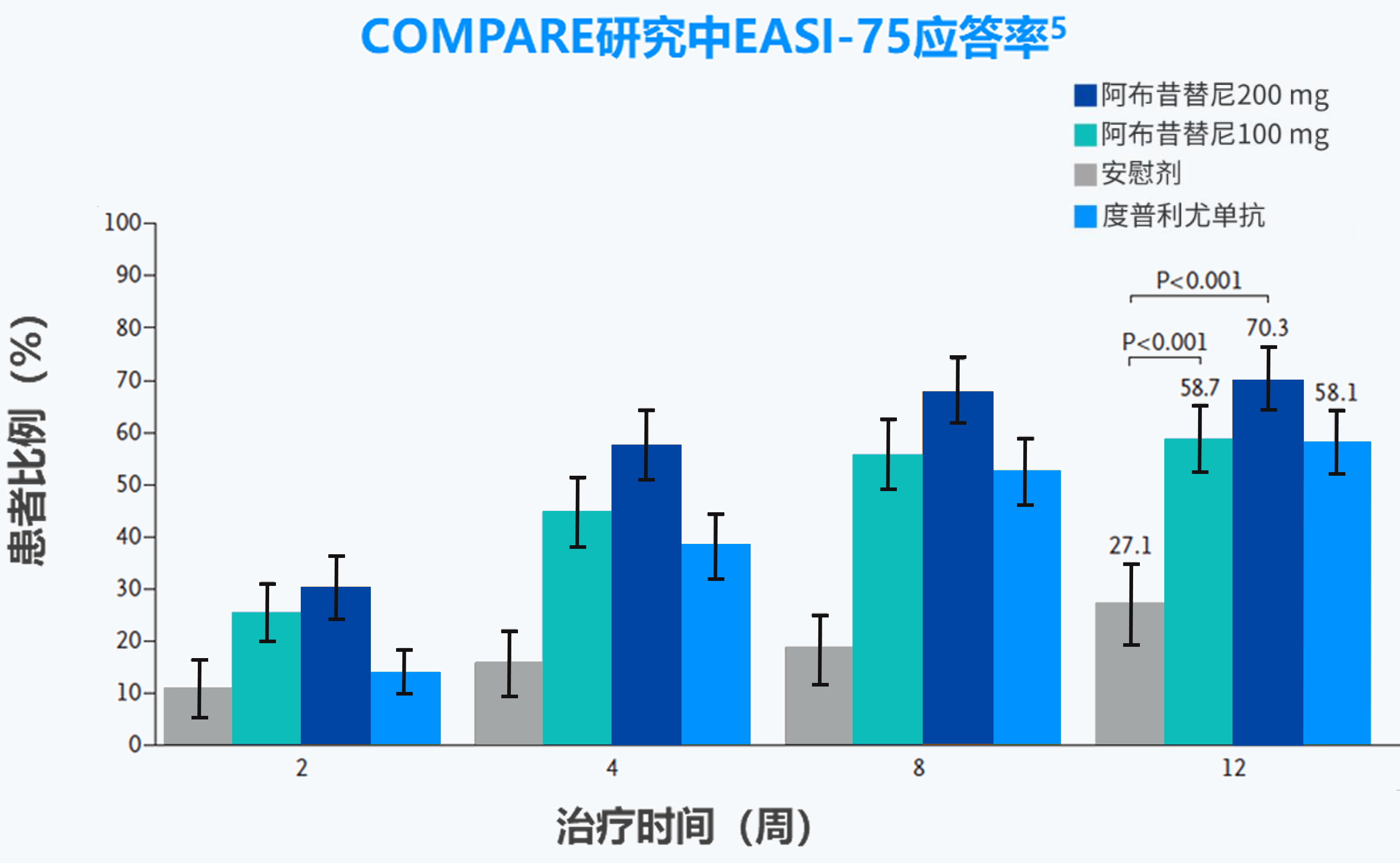
IGA应答:研究者整体评估(IGA)评分达到0分(清除)或1分(几乎清除)(5分制量表)且相对于基线下降≥2 分。
EASI-75应答:湿疹面积和严重程度指数(EASI)相对于基线改善≥75%。
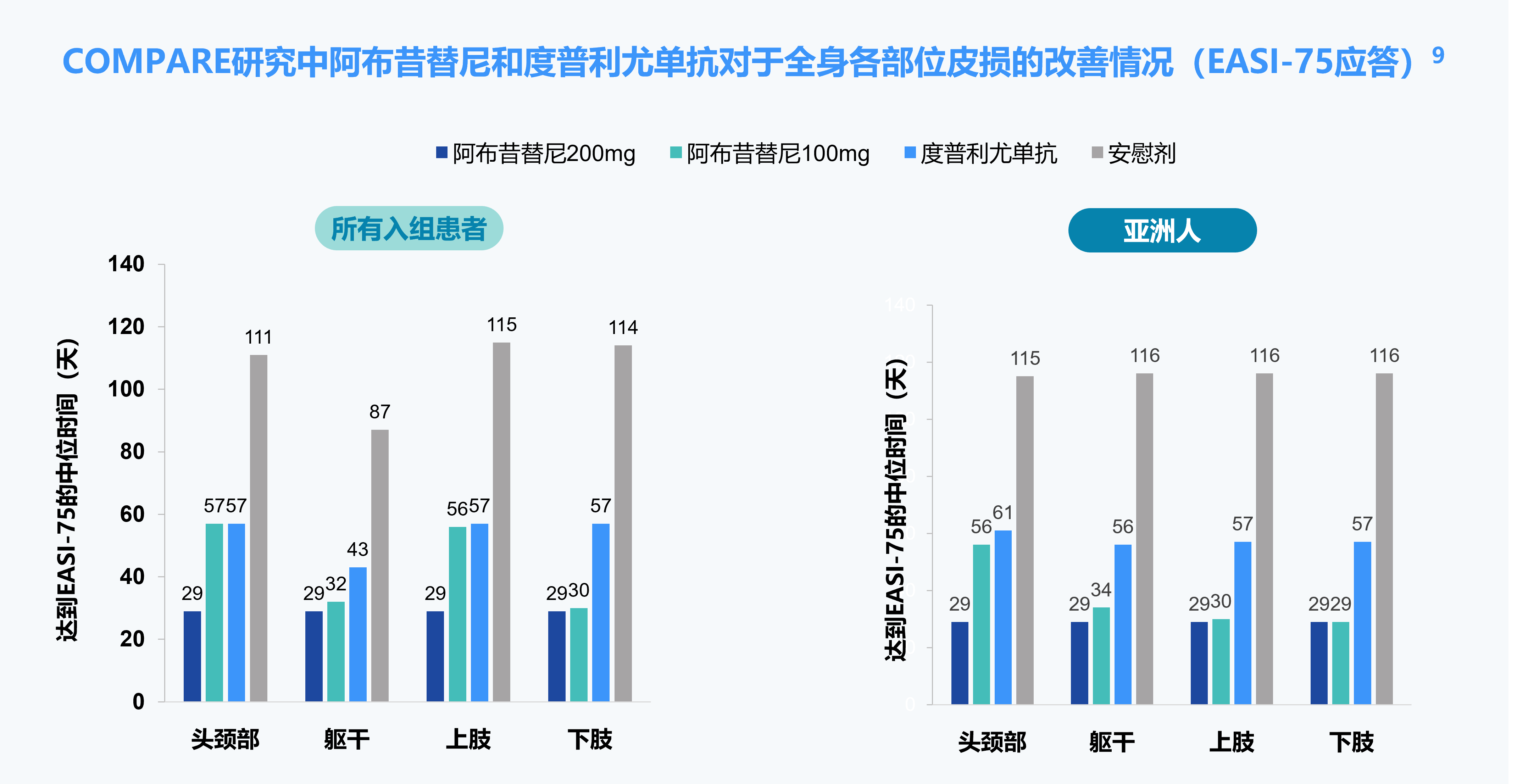
EASI-75应答:湿疹面积和严重程度指数(EASI)相对于基线改善≥75%
备注:阿布昔替尼适用于对其他系统治疗(如激素或生物制剂)应答不佳或不适宜上述治疗的难治性、中重度特应性皮炎成人和 12 岁及以上青少年患者。
阿布昔替尼常规推荐剂量为 100 mg,每日一次。如果每日一次口服 100 mg 本品未实现充分应答,可考虑将剂量增加到 200 mg 每日一次。
对于没有血栓形成、主要心血管不良事件和恶性肿瘤高风险的需要更迅速地缓解症状的 65 岁以下成年患者(例如:重度或泛发性的高疾病负担,和/或复发的患者):可考虑以 200 mg 每日一次开始治疗 12 周,然后降低至 100 mg 每日一次口服,以维持应答。如果剂量降低后无法维持充分应答,则将剂量增加回 200 mg 每日一次。
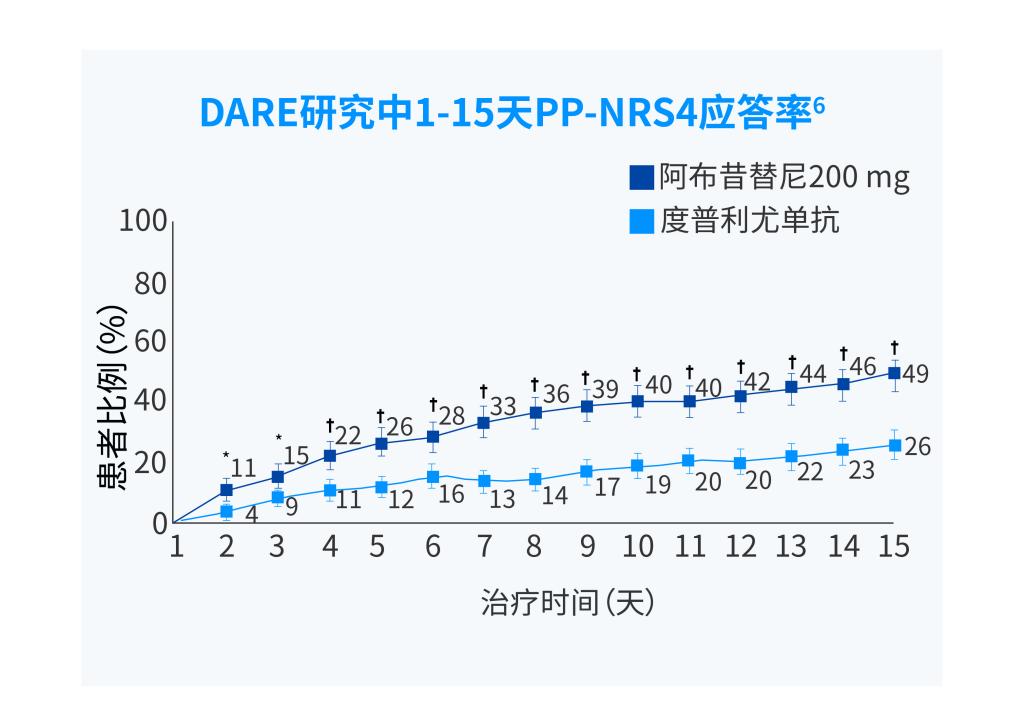
PP-NRS4应答:峰值瘙痒数字评估量表(PP-NRS)相对于基线改善≥4 分。
*第2天,p=0.0006;第3天,p=0.0078;†p<0.0001。
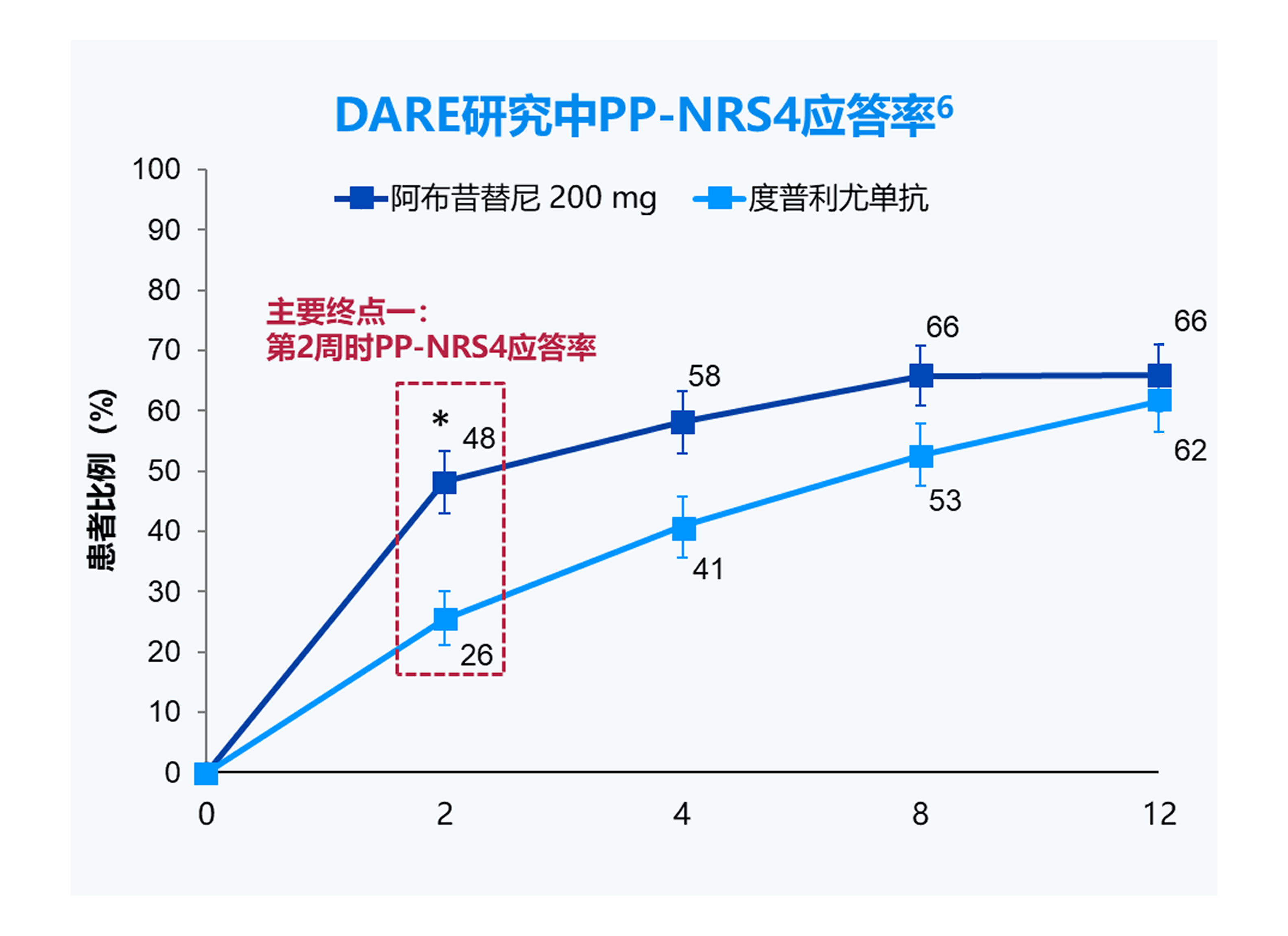
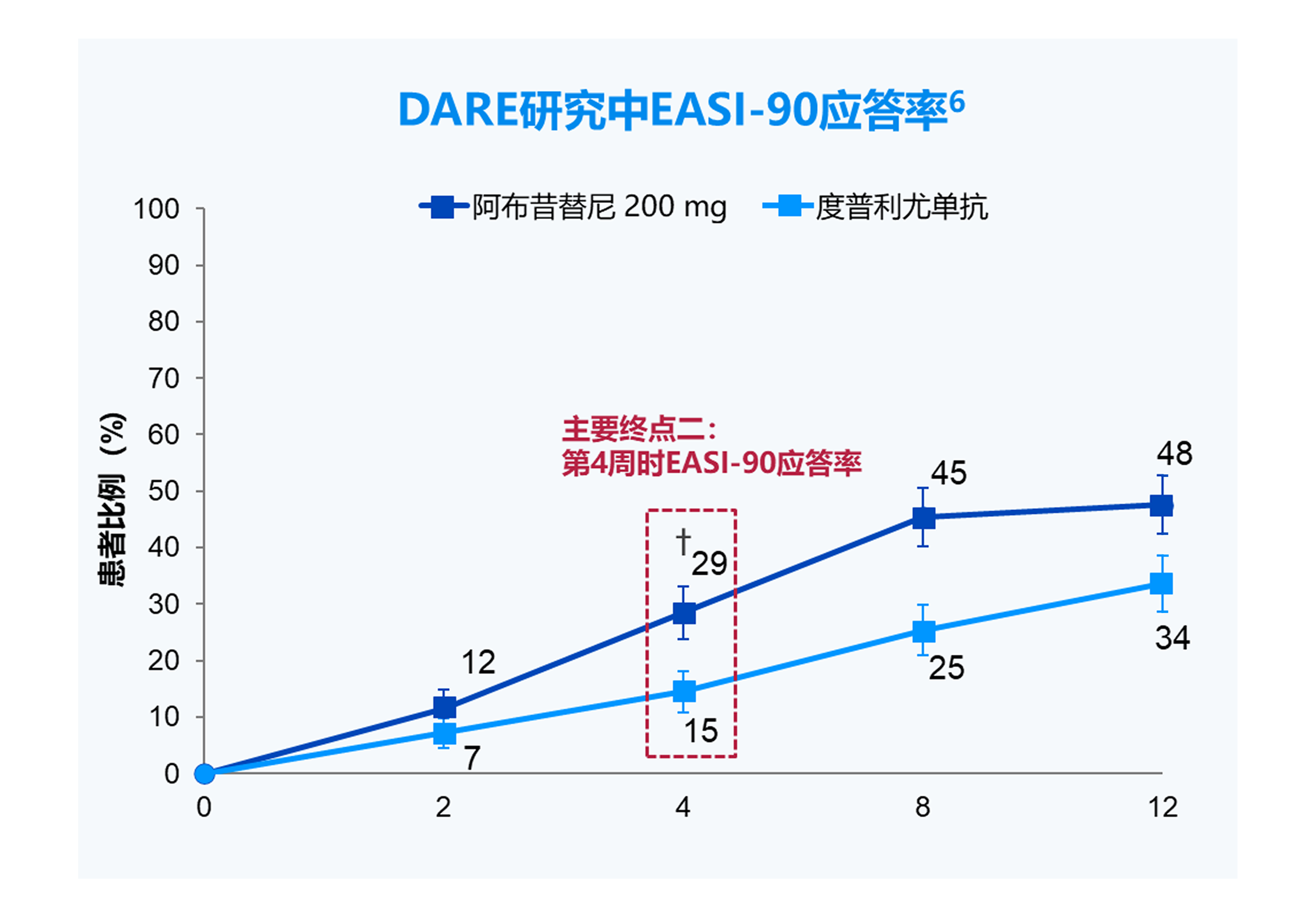
PP-NRS4应答,峰值瘙痒数字评估量表(PP-NRS)相对于基线改善≥4 分;
EASI-90应答,湿疹面积和严重程度指数(EASI)相对于基线改善≥90%。
*p=0.0008; †p<0.0001。
备注:阿布昔替尼适用于对其他系统治疗(如激素或生物制剂)应答不佳或不适宜上述治疗的难治性、中重度特应性皮炎成人和 12 岁及以上青少年患者。
阿布昔替尼常规推荐剂量为 100 mg,每日一次。如果每日一次口服 100 mg 本品未实现充分应答,可考虑将剂量增加到 200 mg 每日一次。
对于没有血栓形成、主要心血管不良事件和恶性肿瘤高风险的需要更迅速地缓解症状的 65 岁以下成年患者(例如:重度或泛发性的高疾病负担,和/或复发的患者):可考虑以 200 mg 每日一次开始治疗 12 周,然后降低至 100 mg 每日一次口服,以维持应答。如果剂量降低后无法维持充分应答,则将剂量增加回 200 mg 每日一次。
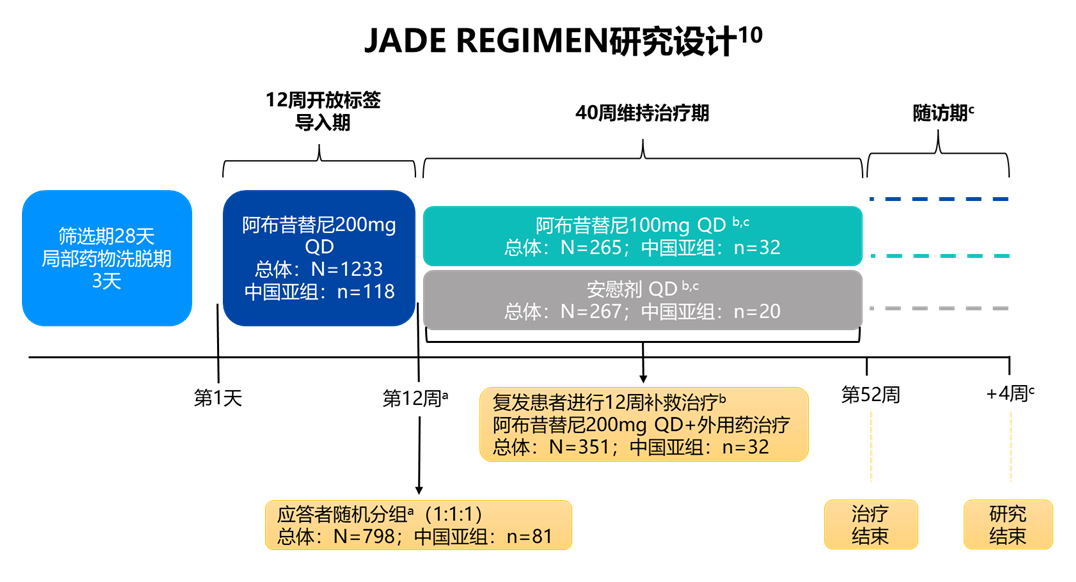
a应答定义为研究者整体评估(IGA)评分达到0分(清除)或1分(几乎清除)(5分制量表)且相对于基线下降≥2 分,以及湿疹面积和严重程度指数(EASI)相对于基线改善≥75%。
b复发定义为第12周时EASI恶化≥50%且IGA评分≥2。
c 不适合随机分配至维持期的患者;在诱导、维持或补救阶段停止治疗的患者;或未进入长期扩展研究的患者在停药后随访4周。
QD,每日一次。
该研究主要终点为:在双盲治疗期,评估并比较各组需要补救治疗的中位复发时间。
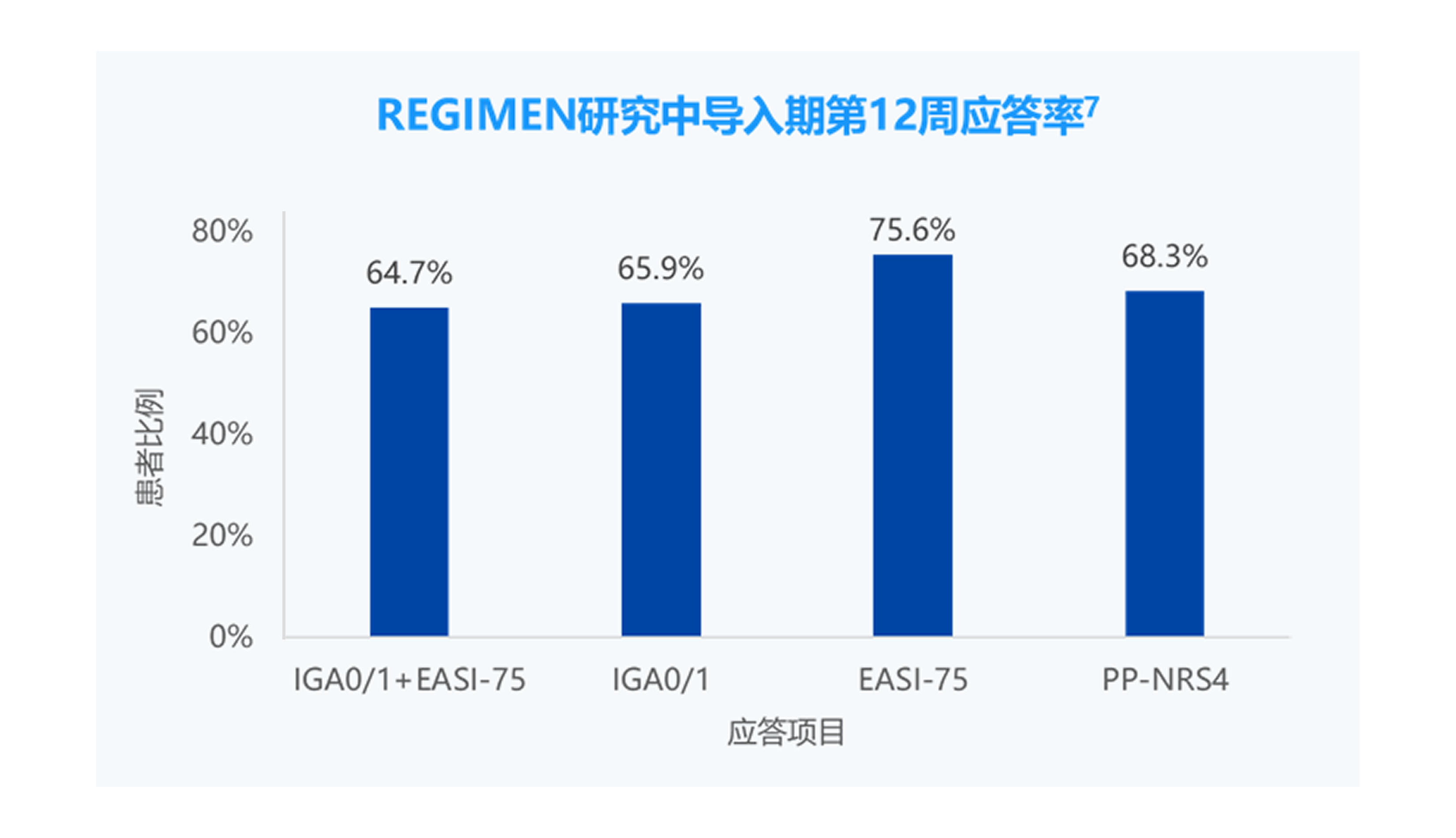
IGA0/1,研究者整体评估(IGA)评分达到0分(清除)或1分(几乎清除)(5分制量表)。
EASI-75,湿疹面积和严重程度指数(EASI)相对于基线改善≥75%。
PP-NRS4,峰值瘙痒数字评估量表(PP-NRS)相对于基线改善≥4 分。
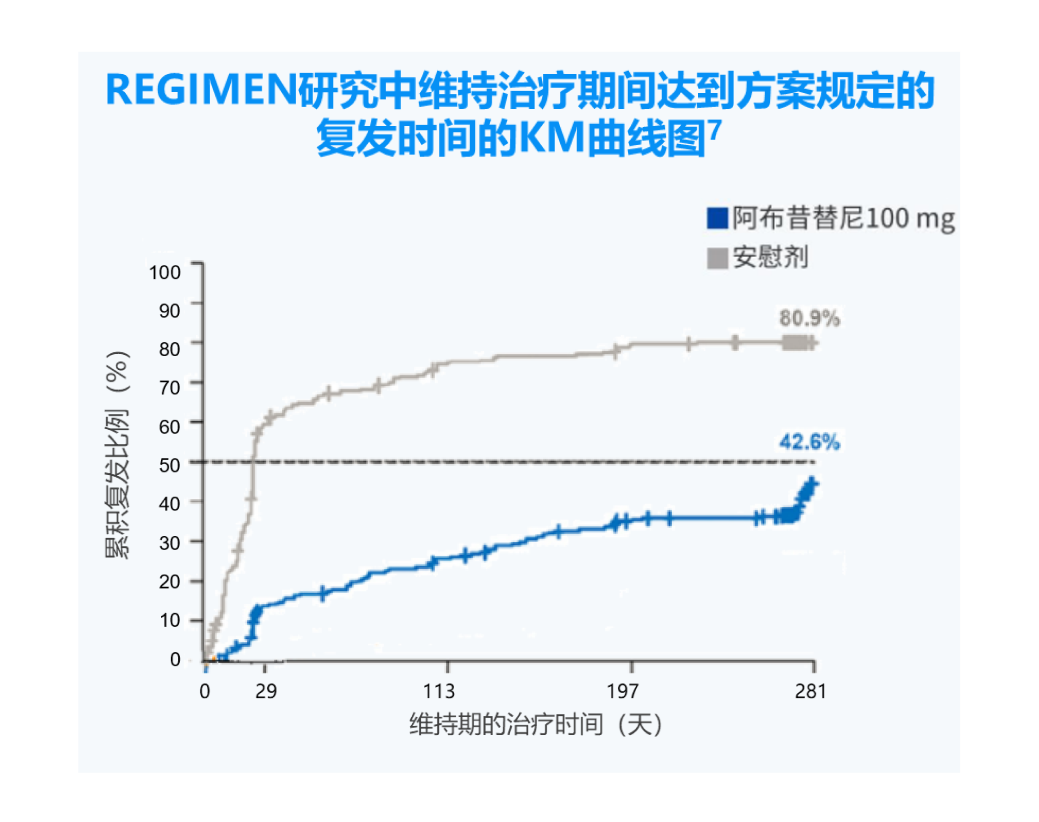
“复发”被定义为受试者于第12周获得的湿疹面积和严重程度指数(EASI)评分改善至少减少50%,且研究者整体评估(IGA)评分≥2。
维持治疗期间,安慰剂组复发时间中位数为28天;阿布昔替尼100 mg组复发中位时间为323天(已超过280天)
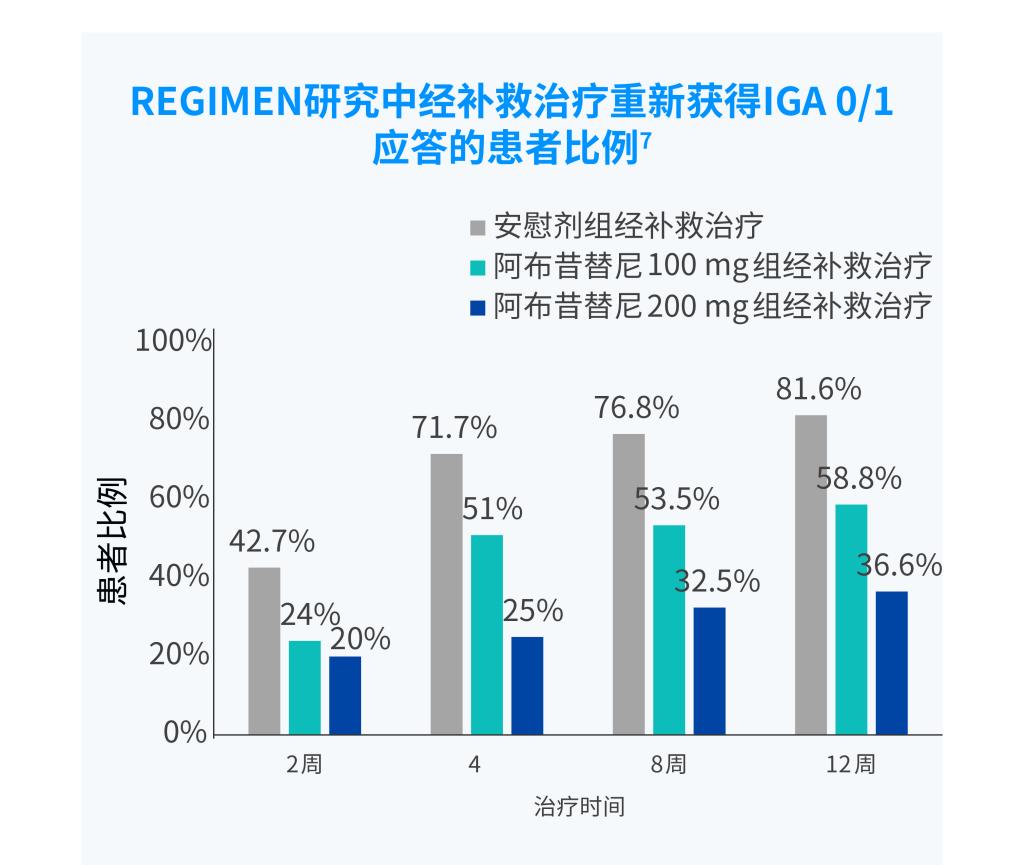
IGA0/1应答,研究者整体评估(IGA)评分达到0分(清除)或1分(几乎清除)(5分制量表)。
阿布昔替尼维持治疗期间复发患者给予阿布昔替尼联合局部药物治疗仍可获得应答。
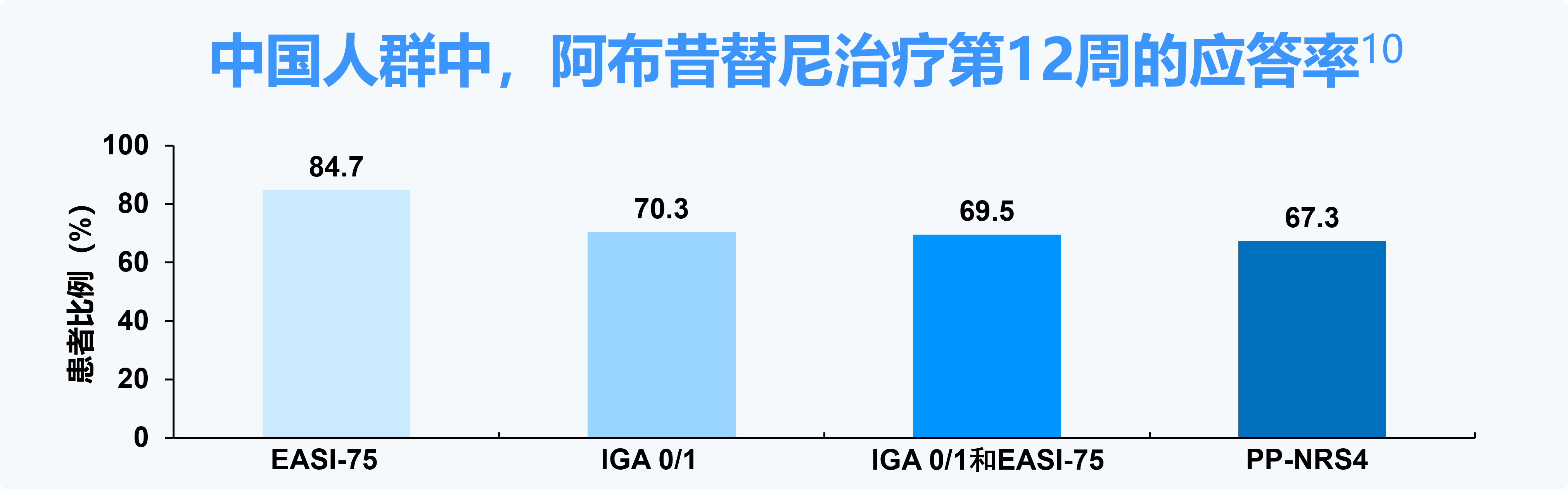
EASI-75:湿疹面积和严重程度指数较基线改善至少75%;IGA 0/1=研究者对AD评分的总体评估为“清除”或“几乎清除”且较基线降低≥2分;PP-NRS4=峰值瘙痒数值评分较基线改善≥4分。
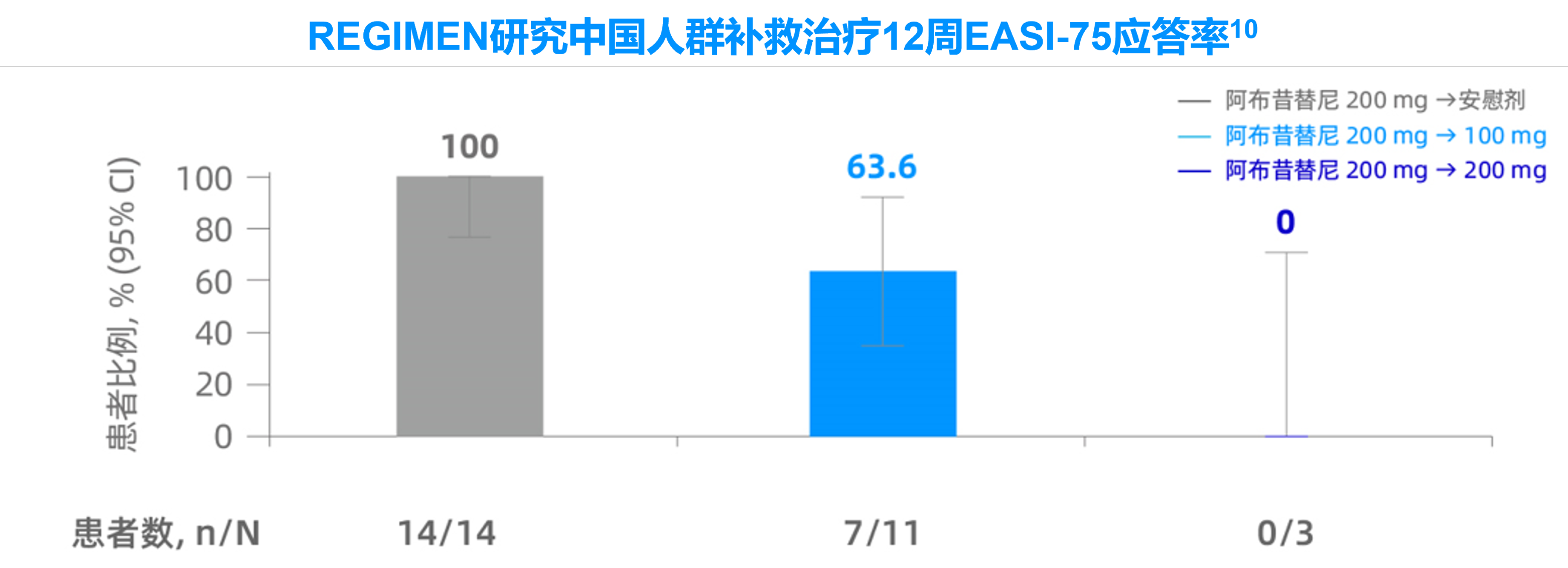
EASI-75:湿疹面积和严重程度指数较基线改善至少75%
备注:阿布昔替尼适用于对其他系统治疗(如激素或生物制剂)应答不佳或不适宜上述治疗的难治性、中重度特应性皮炎成人和 12 岁及以上青少年患者。
阿布昔替尼常规推荐剂量为 100 mg,每日一次。如果每日一次口服 100 mg 本品未实现充分应答,可考虑将剂量增加到 200 mg 每日一次。
对于没有血栓形成、主要心血管不良事件和恶性肿瘤高风险的需要更迅速地缓解症状的 65 岁以下成年患者(例如:重度或泛发性的高疾病负担,和/或复发的患者):可考虑以 200 mg 每日一次开始治疗 12 周,然后降低至 100 mg 每日一次口服,以维持应答。如果剂量降低后无法维持充分应答,则将剂量增加回 200 mg 每日一次。
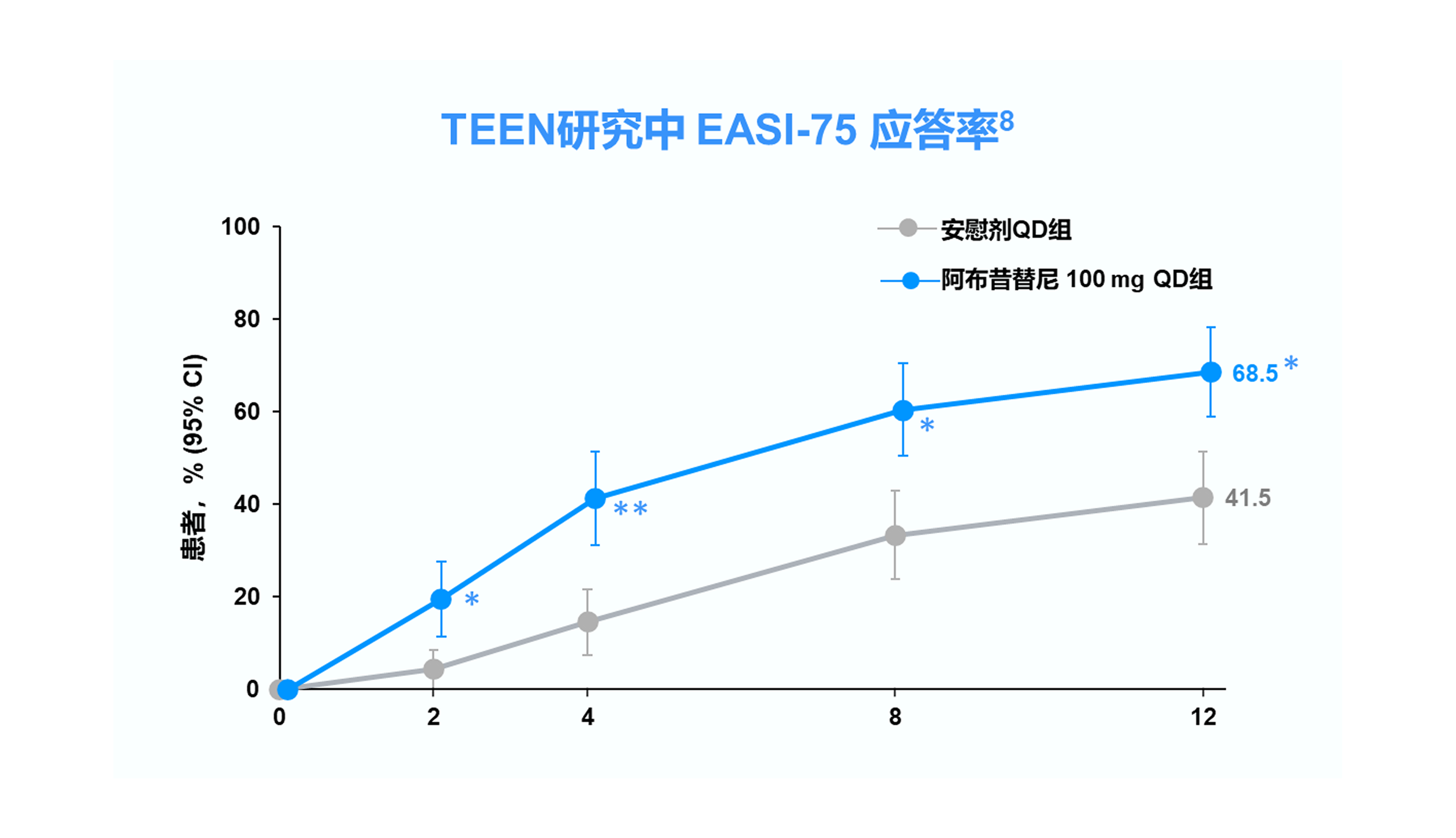
*p<0.05 vs. 安慰剂;**p<0.001 vs. 安慰剂
EASI-75=湿疹面积和严重程度指数评分较基线改善至少75%;CI=置信区间;QD=每日一次
*p<0.05 vs. 安慰剂
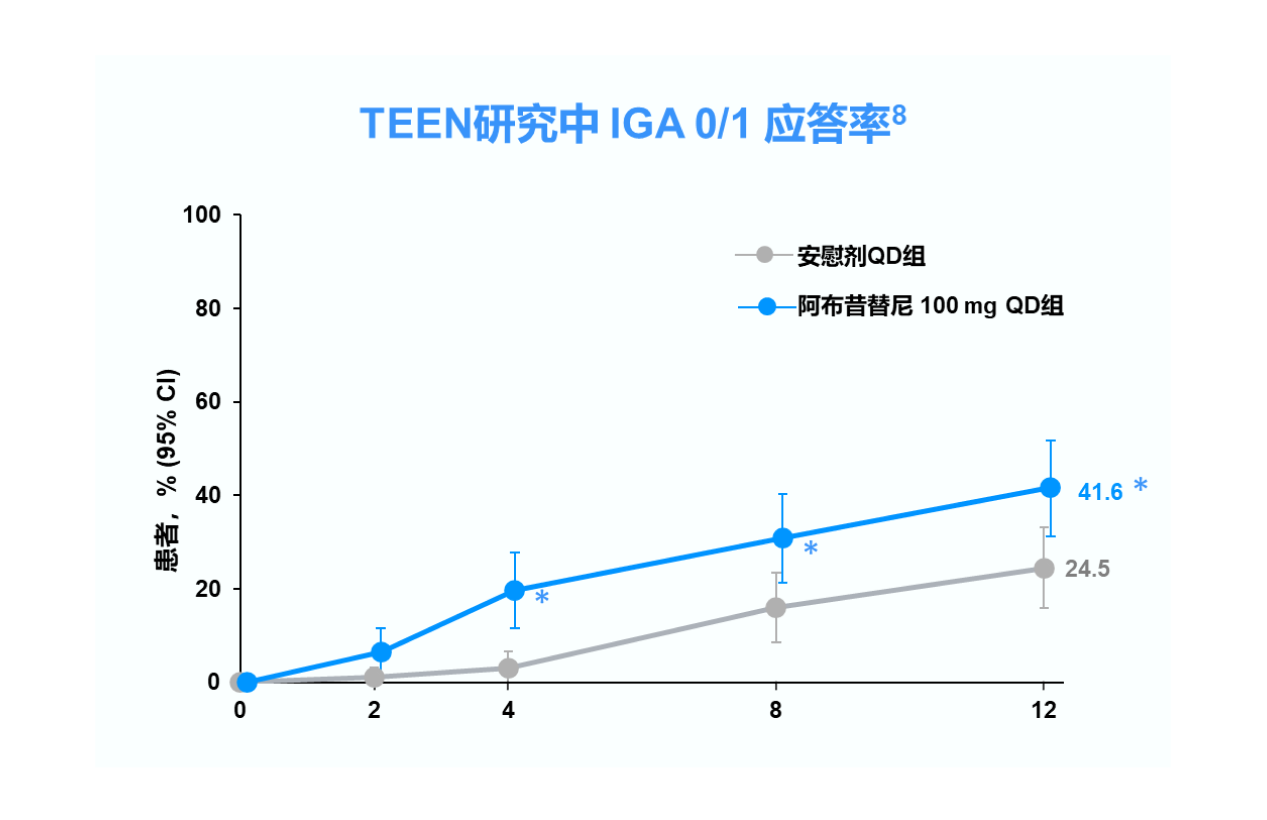
IGA 0/1=研究者对AD评分的总体评估为“清除”或“几乎清除”且较基线降低≥2分;CI=置信区间;QD=每日一次
*p<0.05 vs. 安慰剂
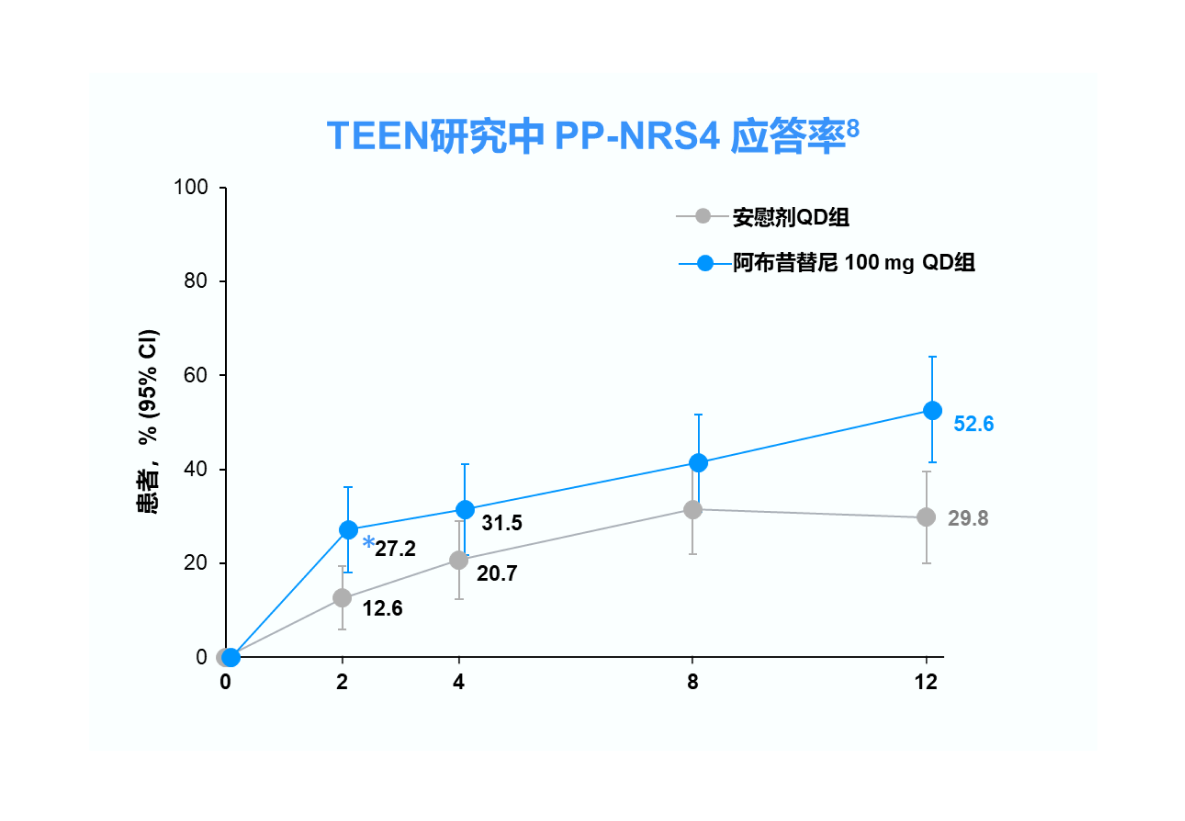
PP-NRS4=峰值瘙痒数值评定量表评分较基线改善≥4分;CI=置信区间;QD=每日一次
TEEN研究中纳入的 285 例青少年患者中有 52 例(18.2%)来自中国,其中接受阿布昔替尼 100 mg 和安慰剂的患者分别有 18 和 20 例。 8
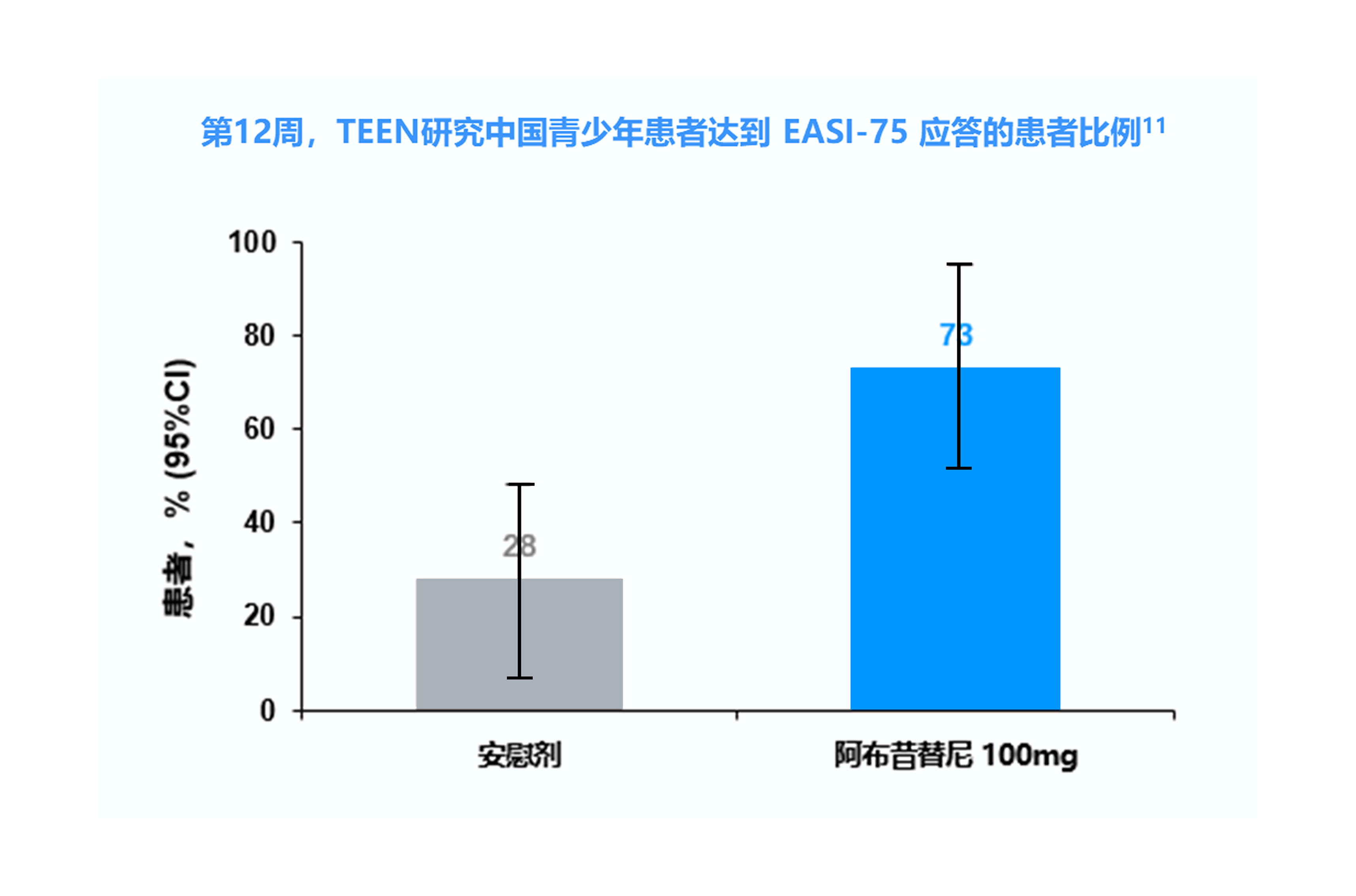
EASI-75=湿疹面积和严重程度指数评分较基线改善至少75%
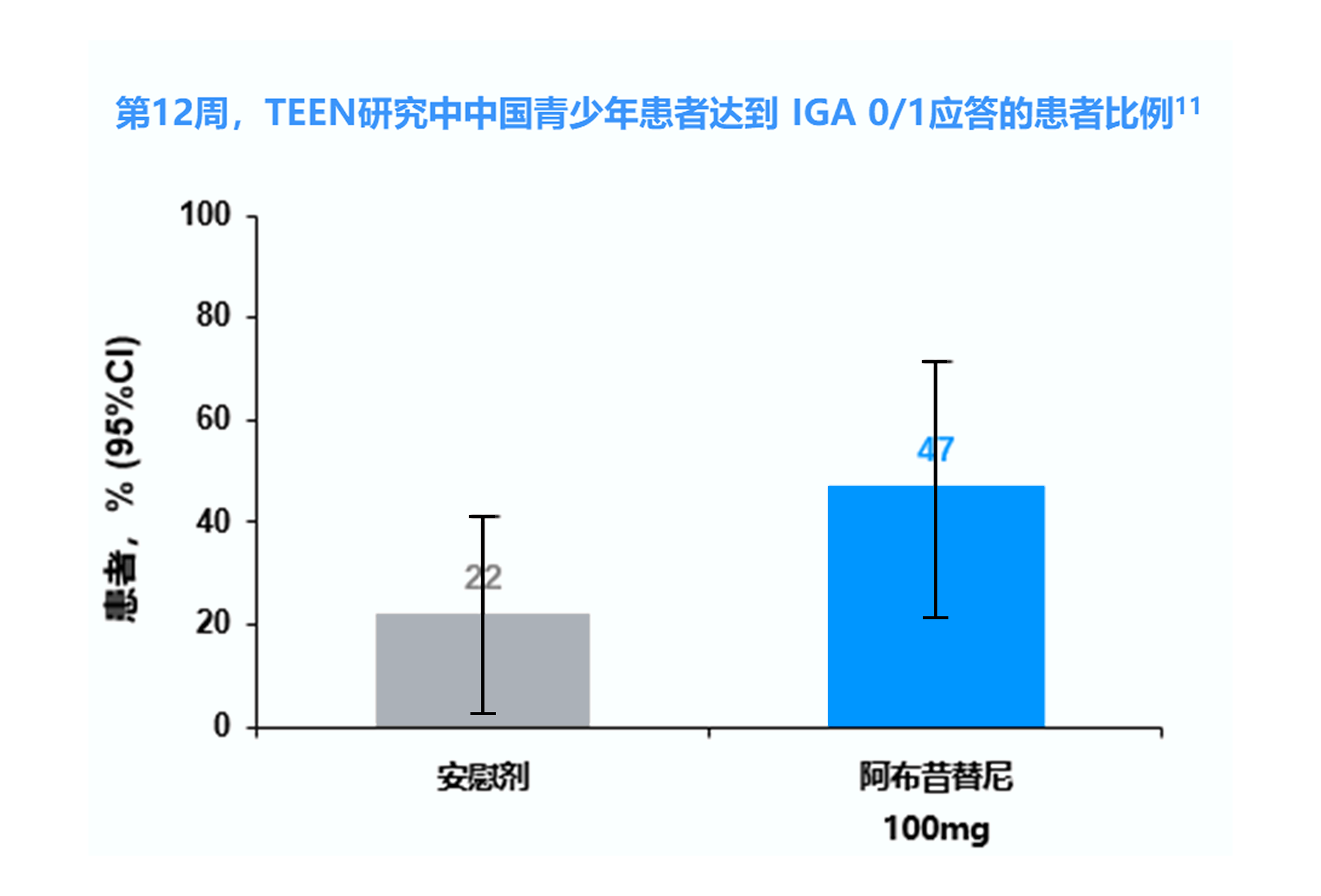
IGA 0/1=研究者对AD评分的总体评估为“清除”或“几乎清除”且较基线降低≥2分
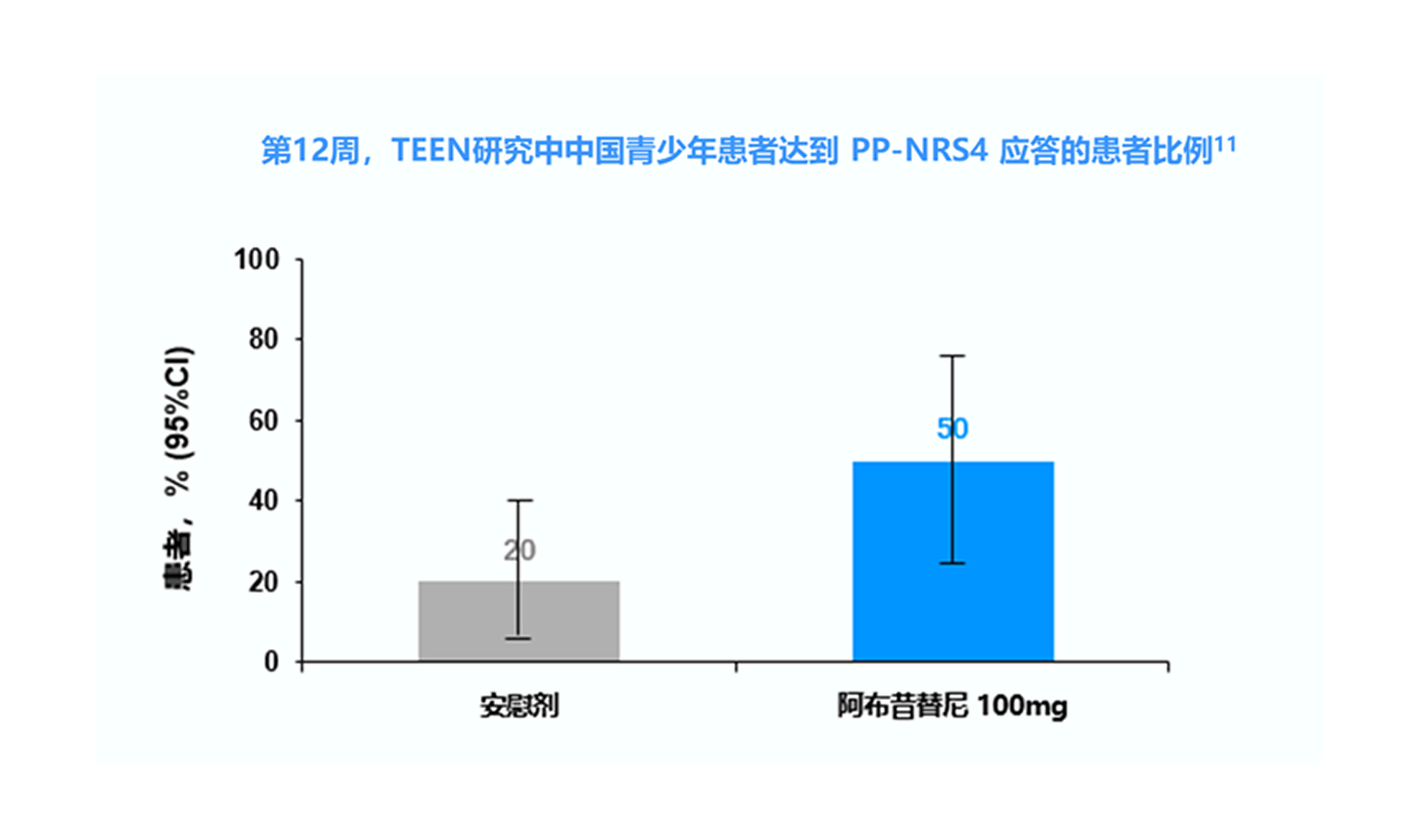
PP-NRS4=峰值瘙痒数值评定量表评分较基线改善≥4分
备注:阿布昔替尼适用于对其他系统治疗(如激素或生物制剂)应答不佳或不适宜上述治疗的难治性、中重度特应性皮炎成人和 12 岁及以上青少年患者。
阿布昔替尼常规推荐剂量为 100 mg,每日一次。如果每日一次口服 100 mg 本品未实现充分应答,可考虑将剂量增加到 200 mg 每日一次。
对于没有血栓形成、主要心血管不良事件和恶性肿瘤高风险的需要更迅速地缓解症状的 65 岁以下成年患者(例如:重度或泛发性的高疾病负担,和/或复发的患者):可考虑以 200 mg 每日一次开始治疗 12 周,然后降低至 100 mg 每日一次口服,以维持应答。如果剂量降低后无法维持充分应答,则将剂量增加回 200 mg 每日一次。
(1)张氏诊断标准13,14:
① 病程超过6 个月的对称性湿疹;
② 特应性个人史和/或家族史(包括湿疹、过敏性鼻炎、哮喘、过敏性结膜炎等);
③ 血清总IgE 升高和/或外周血嗜酸性粒细胞升高和/或过敏原特异性IgE 阳性(过敏原特异性IgE 检测2 级或2 级以上阳性);
符合第1 条外加第2 条或第3 条的任何一条即可诊断特应性皮炎。
(2)姚氏诊断标准13:
① 瘙痒;
② 典型的形态和部位(屈侧皮炎)或不典型的形态和部位同时伴发干皮症;
③慢性或慢性复发性病程;
同时具备以上3 条即可诊断特应性皮炎。
另,典型的形态和部位(屈侧皮炎)包括儿童面部和肢端受累。
不典型的形态和部位包括:
① 典型的湿疹样皮疹,发生在非屈侧部位(头皮皮炎、眼睑湿疹、乳头湿疹、外阴湿疹、钱币状湿疹、指尖湿疹、非特异性手部或足部皮炎/特应性冬季足、甲或甲周湿疹和身体其他部位的湿疹样皮疹);
② 非典型湿疹样皮疹,单纯糠疹、唇炎、耳下和耳后/鼻下裂隙、痒疹、汗疱疹、丘疹性苔藓样变异。
张氏标准推荐用于成人/青少年,姚氏标准推荐用于儿童13。
(1)Hanifin & Rajka标准14
- 基本特征:
- 瘙痒;
- 典型的皮疹形态和分布:成人屈侧苔藓化或条状表现,婴儿和儿童面部及伸侧受累;
- 慢性或慢性复发性皮炎;
- 个人或家族特应性疾病史(哮喘、过敏性鼻炎和特应性皮炎)。
- 次要特征:
- 干皮症;
- 鱼鳞病/掌纹症/毛周角化症;
- 即刻型(Ⅰ型)皮试反应;
- 血清IgE 增高;
- 早年发病;
- 皮肤感染倾向(特别是金黄色葡萄球菌和单纯疱疹)/细胞介导免疫受损;
- 非特异性手足皮炎倾向;
- 乳头湿疹;
- 唇炎;
- 复发性结膜炎;
- Dennie⁃Morgan 眶下褶痕;
- 圆锥角膜;
- 前囊下白内障;
- 眶周黑晕;
- 苍白脸/面部红斑;
- 白色糠疹;
- 颈前皱褶;
- 出汗时瘙痒;
- 羊毛与脂类溶剂不耐受;
- 毛周隆起;
- 食物过敏;
- 病程受环境/情绪因素影响;
- 白色划痕征/延迟发白。
符合基本特征中3条或3条以上,加次要特征中3条或3条以上即可诊断特应性皮炎。
该标准主要用于临床研究14。
(2)Williams标准13,14
必须具有皮肤瘙痒史,加以下5 条中的3条或3条以上:
- 屈侧皮肤受累史,包括肘窝、腘窝、踝前或颈周(10 岁以下儿童包括颊部);
- 个人哮喘或过敏性鼻炎史(或4岁以下儿童的一级亲属特应性疾病史);
- 全身皮肤干燥史;
- 可见屈侧湿疹;
- 2 岁前发病(4 岁以下儿童不适用)。
该标准过于强调“屈侧皮炎”和“2 岁前发病”,使其在成人特应性皮炎的诊断中敏感性有所降低14。
总体而言:张氏标准和姚氏标准的敏感性高于Hanifin & Rajka标准和Williams标准13。
特应性皮炎的评估工具有很多,最新(2022年8月)发布的《中重度特应性皮炎系统药物达标治疗专家建议》推荐了以下评估工具15:
① 评估瘙痒严重程度:
峰值瘙痒数值评估量表(PP-NRS)
② 患者自行评估症状:
患者湿疹自我检查评分量表(POEM)
③ 评估体征:
湿疹面积和严重程度指数(EASI);
特应性皮炎评分指数(SCOARD)
④ 评估生活质量:
皮肤病生活质量指数(DLQI)
⑤ 评估疾病长期控制情况:
特应性皮炎控制工具(ADCT)
此外,《中国特应性皮炎诊疗指南(2020版)》13还推荐了研究者整体评分法(IGA)和痒程度视觉模拟尺评分(VAS;中文版16,英文版17)来评估特应性皮炎的严重度。
注:以上各评估量表版权归原作者所有。
3. 中国中重度特应性皮炎诊疗临床路径专家共识(2023版)
7. 系统Janus激酶抑制剂治疗特应性皮炎专家共识(2022年)
9. Systemic Therapy for Atopic Dermatitis in Children and Adolescents: A United States Expert Consensus
13. Living EuroGuiDerm Guideline for the systemic treatment of Atopic Eczema
14. Guidelines of care for the management of atopic dermatitis in adults with topical therapies
如需指南共识原文,请您联系辉瑞医学信息部: [email protected],或通过辉瑞医学信息网站在线提问获取。
1. 阿布昔替尼片说明书.
2. 《阿布昔替尼临床应用专家讨论意见》要点. 医学参考报, 2022-05-05(E7).
3. Simpson EL, et al. Lancet, 2020, 396(10246): 255-266.
4. Silverberg JI, et al. JAMA Dermatol, 2020, 156(8): 863-873.
5. Bieber T, et al. N Engl J Med, 2021, 384(12): 1101-1112.
6. Reich K, et al. Lancet, 2022, 400(10348): 273-282.
7. Blauvelt A, et al. J Am Acad Dermatol, 2022, 86(1): 104-112.
8. Eichenfield LF, et al. JAMA Dermatol. 2021;157(10):1165-1173.
9. Alexis A, et al. Dermatol Ther (Heidelb). 2022 Mar;12(3):771-785.
10. Li H, et al. Presented at the Revolutionizing Atopic Dermatitis (RAD) Virtual Conference; December 11, 2022. Poster 352.
11. Yao Z, et al. Presented at Revolutionizing Atopic Dermatitis (RAD) Conference; April 2023. Poster 522.
12. 中国中西医结合学会皮肤性病专业委员会环境与职业性皮肤病学组.实用皮肤病学杂志,2022,15(3):129-135.
13. 中华医学会皮肤性病学分会免疫学组, 等. 中华皮肤科杂志, 2020, 53(2): 81-88.
14. 张建中. 中华皮肤科杂志, 2017, 50(1): 67-69.
15. 赵作涛, 等. 中国皮肤性病学杂志, 2022, 36(8): 855-864.
16. 中国医师协会皮肤科分会变态反应性疾病专业委员会. 中华皮肤科杂志, 2018, 51(7): 481-485.
17. Manuel Pedro Pereira, et al. Allergol Int, 2017, 66(1): 3-7.



