- 成分:本品为白色、均匀混悬液,每剂0.5ml ,含1、3、4、5、6A、7F、9V、14、18C、19A、19F 和23F型多糖各2.2μg,6B型多糖4.4μg ,与CRM197载体蛋白结合后吸附于磷酸铝佐剂(铝含量0.125mg)。另含氯化钠、琥珀酸、聚山梨酯80和注射用水。
- 贮藏:冰箱(2℃-8℃)保存。不得冷冻,如已冷冻不能再用。请将本品放置在儿童不能触及的地方。
- 有效期:36个月
- 本品接种用于婴幼儿的主动免疫,以预防由肺炎球菌血清型1、3、4、5、6A、6B、7F、9V、14、18C、19A、19F和23F引起的侵袭性疾病(包括菌血症性肺炎、脑膜炎、败血症和菌血症等)。
- 本品只能对该疫苗所含肺炎球菌血清型具有预防保护作用,不能预防本品以外的血清型别和其它微生物导致的侵袭性疾病、肺炎或中耳炎。
- 本品适用于 6 周龄至 5 岁(6 周岁生日前)婴幼儿和儿童。
对本品中任何活性成分、辅料或白喉类毒素过敏者禁用。
沛儿13推荐接种程序
6周龄至6月龄婴儿:
推荐常规免疫接种程序:共接种4剂。基础免疫在2、4、6月龄各接种一剂,加强免疫在
12~15月龄接种一剂。基础免疫首剂最早可以在6周龄接种,之后各剂间隔1~2个月。
7至11月龄婴儿:
共接种3剂。首剂与第2剂间隔至少1个月。建议在出生后第二年(满12月龄以后)接种第3剂,与第2剂间隔至少2个月。
12至23月龄幼儿:
共接种2剂,接种间隔至少2个月。
2至5岁儿童(6周岁生日前):
接种1剂。
- 本品使用前应充分摇匀。仅供肌肉注射1
- 首选注射部位:婴儿为大腿前外侧(股外侧肌),幼儿为上臂三角肌。1
- 进针方法:90°进针,迅速将针头向下进入皮肤和肌肉,缓慢注射以减少疼痛。3,4
- 注意避免神经和血管中或其附近部位注射本品。1
股外侧肌的安全接种体位:搂抱式,将孩子大腿裸露,侧抱于母亲腿上,家长按住孩子的双腿3,4
搂抱式
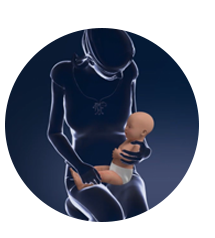
将孩子大腿裸露,侧抱于母亲腿上
家长按住孩子的双腿
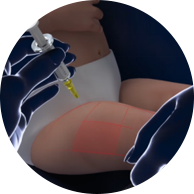
股外侧肌注射部位4
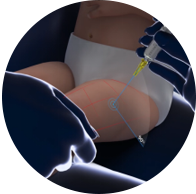
90° 进针
迅速将针头向下进入皮肤和肌肉,缓慢注射以减少疼痛3,4
- 长期静置保存时,注射液呈澄清状且有白色沉淀,此属正常现象不代表产品变质。
- 将空气从注射针筒中排出前,请剧烈振摇疫苗以获得均匀的白色混悬液;注射给药前,请目视检查注射液是否有任何颗粒物质和/或者其它外观异常。如果发现产品外观有任何异样,请勿使用该支疫苗。任何未使用的疫苗或废弃物应依照当地规定处置。
- 本品严禁静脉注射。不能在臀部注射本品。
- 同所有其它注射用疫苗一样,接种本品时,应备有相应的医疗及抢救措施以防接种后出现罕见的超敏反应。
- 本品只能对该疫苗所含肺炎球菌血清型具有预防保护作用,不能预防本品以外的血清型别和其它微生物导致的侵袭性疾病、肺炎或中耳炎。
- 与其它疫苗一样,本品不能保证所有受种者都不会罹患肺炎球菌性疾病。
- 与其它肌肉注射一样,血小板减少症、任何凝血障碍或接受抗凝血剂治疗者接种本品时应非常谨慎。
- 尚无免疫功能受损者(例如恶性肿瘤、肾病综合征患者)接种本品的安全性和免疫原性数据,因此应根据患者个体情况进行接种。
- 有限的数据表明:7价肺炎球菌结合疫苗(3剂基础免疫)用于镰状细胞病患儿时能诱发适当的免疫应答,且其安全性特征与非高危人群大体相同。
- 在≥24月龄的镰状红细胞病、无脾、HIV 感染、慢性疾病或其他免疫功能受损的儿童中,使用本品结合疫苗并不能代替23价肺炎球菌多糖疫苗(PPV23)。
- 与所有注射用儿童疫苗一样,早产儿进行基础免疫时应该考虑到有呼吸暂停的潜在风险。按推荐程序接种仍在住院的极早产儿(出生时≤30 孕周)时,接种本品后应考虑进行至少48 小时的监测。考虑到早产儿接种疫苗的获益,不建议停止接种或推迟接种本品。
与其他疫苗一样,患急性、严重发热性疾病者应暂缓接种沛儿13。1 但是,轻微感染(如感冒)可以不用推迟接种疫苗。5
6周龄至5岁婴幼儿和儿童临床试验不良反应汇总
| 系统器官类别 | 十分常见 (≥10%) | 常见 (≥1% 且 <10%) | 偶见 (≥ 0.1% 且 <1%) | 罕见 (≥ 0.01% 且 <0.1%) |
|---|---|---|---|---|
| 免疫系统疾病 | 超敏反应,包括面部水肿、呼吸困难和支气管痉挛 | |||
| 代谢和营养性疾病 | 食欲下降 | |||
| 精神系统疾病 | 易激惹 | 哭闹 | ||
| 神经系统疾病 | 嗜睡/睡眠增加;入睡困难/睡眠减少 | 惊厥(包括热性惊厥) | 低张力~低反应事件 | |
| 胃肠道疾病 | 腹泻;呕吐 | |||
| 皮肤和皮下组织疾病 | 皮疹 | 荨麻疹或荨麻疹样皮疹 | ||
| 全身症状以及接种部位症状 | 发热;接种部位红斑,硬结/肿胀、疼痛/触痛; 接种部位红斑或硬结/肿胀2.5 cm~ 7.0 cm(接种幼儿剂次后) | 超过39°C的发热;接种部位红斑或硬结/肿胀2.5 cm~7.0 cm(接种婴儿剂次后);接种部位疼痛/触痛并影响运动 | 接种部位红斑或硬结/肿胀大于7.0 cm |
国内注册临床试验对本品的安全性进行了评价,其中试验组1182名婴儿(6周龄至11周龄)至少接种1剂本品,阳性对照组472名婴幼儿至少接种1剂沛儿(7价)。
| 全身不良反应分级 | 本品 (3、4、5和12月龄) Na=447~472 %b | 本品 (2、4、6和12月龄) Na=446~472 %b | 本品 (3、5和12月龄) Na=225~233 %b | 沛儿(7价) (3、4、5和12月龄) Na=432~470 %b |
|---|---|---|---|---|
| 红斑 | ||||
| 任何程度的红斑 | 1.9~3.4 | 1.7~5.7 | 1.7~3.4 | 1.9~4.0 |
| 轻度 c | 1.7~3.2 | 1.1~5.5 | 0.4~3.4 | 1.7~4.0 |
| 中度 c | 0.0~1.6 | 0.6~1.3 | 0.0~1.3 | 0.2~1.4 |
| 重度 c | 0.0 | 0.0 | 0.0~0.4 | 0.0 |
| 肿胀 | ||||
| 任何程度的肿胀 | 1.9~4.0 | 2.4~5.5 | 1.7~5.6 | 1.9~5.5 |
| 轻度 c | 1.9~3.4 | 2.2~5.1 | 1.7~5.2 | 1.9~4.9 |
| 中度 c | 0.2~1.3 | 0.4~1.3 | 0.4~1.8 | 0.0~1.6 |
| 重度 c | 0.0 | 0.0 | 0.0~0.4 | 0.0 |
| 触痛 | ||||
| 任何程度的触痛 | 2.4~4.9 | 3.5~7.6 | 2.6~5.3 | 2.8~6.5 |
| 出现触痛 | 1.9~4.5 | 3.3~7.6 | 2.6~5.3 | 2.6~6.5 |
| 显著触痛 d | 0.2~0.4 | 0.0~0.7 | 0.0~1.3 | 0.0~0.6 |
| 上述任何局部反应 | 4.5~7.2 | 5.0~12.1 | 3.4~9.4 | 6.1~9.4 |
| ||||
7月龄至5岁婴幼儿和儿童临床试验征集性局部不良反应发生情况
| 局部反应分级 | 7~11月龄 | 12~23月龄 | 2~5岁 |
|---|---|---|---|
| Na=194~236%b | Na=146~164% b | Na=137~138% b | |
| 红斑 | |||
| 任何程度的红斑 | 1.5~24.6 | 5.5~23.2 | 26.1 |
| 轻度 c | 0.5~13.1 | 2.1~7.9 | 8.0 |
| 中度 c | 1.0~11.4 | 3.4~15.2 | 17.4 |
| 重度 c | 0.0 | 0.0 | 0.7 |
| 肿胀 | |||
| 任何程度的肿胀 | 0.5~14.8 | 4.1~10.4 | 19.6 |
| 轻度 c | 0.0~9.3 | 2.1~2.4 | 5.8 |
| 中度 c | 0.5~5.5 | 2.1~7.3 | 13.8 |
| 重度 c | 0.0 | 0.0 ~ 0.6 | 0.0 |
| 触痛 | |||
| 任何程度的触痛 | 1.0~7.2 | 2.1~11.0 | 19.0 |
| 出现触痛 | 1.0~7.2 | 2.1~11.0 | 17.5 |
| 显著触痛 d | 0.0 | 0.0 | 1.5 |
| 上述任何局部反应 | 2.1~28.0 | 6.2~27.4 | 34.8 |
| |||
国内注册临床试验对本品的安全性进行了评价,其中试验组1182名婴儿(6周龄至11周龄)至少接种1剂本品,阳性对照组472名婴幼儿至少接种1剂沛儿(7价)。
6周龄至6月龄婴儿临床试验征集性全身不良反应发生情况
| 全身不良反应分级 | 本品 (3、4、5和12月龄) Na=447~472 %b | 本品 (2、4、6和12月龄) Na=446~473 %b | 本品 (3、5和12月龄) Na=225~233 %b | 沛儿(7价) (3、4、5和12月龄) Na=432~470 %b |
|---|---|---|---|---|
| 发热 | ||||
| 体温≥38ºC | 1.1~6.7 | 1.7~6.7 | 1.3~6.2 | 0.6~3.2 |
| 体温 ≥38ºC但是≤39ºC | 1.1~6.5 | 1.7~6.3 | 1.3~6.2 | 0.6~3.2 |
| 体温 >39ºC 但是≤40ºC | 0.0~0.9 | 0.0~0.4 | 0.0 | 0.0~0.2 |
| 体温 >40ºC | 0.0~0.2 | 0.0 | 0.0 | 0.0 |
| 食欲下降 | 1.3~2.5 | 2.0~4.7 | 0.4~2.2 | 2.4~4.3 |
| 易激惹 | 2.1~3.7 | 3.3~12.3 | 0.9~4.3 | 2.4~5.4 |
| 睡眠增加 | 0.0~0.6 | 0.0~7.4 | 0.4~0.9 | 0.6~2.6 |
| 睡眠减少 | 0.9~2.2 | 1.3~5.7 | 0.0~2.6 | 0.2~2.8 |
| 使用药物预防或者治疗症状 | 1.5~5.4 | 2.0~5.4 | 0.9~4.4 | 1.5~5.3 |
| 上述任何全身不良反应 c | 4.3~9.2 | 5.4~19.7 | 2.6~8.9 | 4.3~8.9 |
| ||||
7月龄至23月婴幼儿和儿童临床试验征集性全身不良反应发生情况
| 全身不良反应分级 | 7-11 月龄 | 12~23 月龄 |
|---|---|---|
| Na=194~236 %b | Na=146~164 %b | |
| 发热 | ||
| 体温≥38ºC | 0.5 ~ 10.0 | 2.1~10.4 |
| 体温 ≥38ºC但是≤39ºC | 0.5~8.7 | 2.1~7.9 |
| 体温 >39ºC 但是≤40ºC | 0.0~1.4 | 0.0~2.4 |
| 体温 >40ºC | 0.0 | 0.0 |
| 食欲下降 c | ||
| 任何程度的食欲下降 | 0.0~1.8 | 0.0 ~ 7.9 |
| 轻度 | 0.0~1.4 | 0.0 ~ 4.9 |
| 中度 | 0.0~0.5 | 0.0 ~ 3.0 |
| 重度 | 0.0 | 0.0 |
| 嗜睡(睡眠增加)d | ||
| 任何程度的嗜睡 | 0.0 ~ 1.7 | 0.0 ~ 1.8 |
| 轻度 | 0.0 ~ 1.7 | 0.0 ~ 0.6 |
| 中度 | 0.0 ~ 0.5 | 0.0 ~ 0.6 |
| 重度 | 0.0 | 0.0 ~ 0.6 |
| 易激惹 e | ||
| 任何程度的激惹 | 0.0 ~ 0.8 | 0.7 ~ 4.3 |
| 轻度 | 0.0 ~ 0.4 | 0.7 ~ 1.8 |
| 中度 | 0.0 ~ 0.5 | 0.0 ~ 1.8 |
| 重度 | 0.0 | 0.0 ~ 0.6 |
| 上述任何全身不良反应 f | 0.5~10.5 | 2.7~15.9 |
| 使用退烧药 g | 1.0 ~ 6.8 | 2.1~12.2 |
| ||
2岁至5岁儿童临床试验征集性全身不良反应发生情况
| 全身不良反应分级 | Na=137~138 %b |
|---|---|
| 发热 | |
| 体温≥38ºC | 5.1 |
| 体温 ≥38ºC但是≤39ºC | 3.6 |
| 体温 >39ºC 但是≤40ºC | 1.5 |
| 体温 >40ºC | 0.0 |
| 疲乏 | |
| 任何程度的疲乏 | 5.1 |
| 轻度 | 4.3 |
| 中度 | 0.7 |
| 重度 | 0.0 |
| 头痛 c | |
| 任何程度的头痛 | 1.4 |
| 轻度 | 1.4 |
| 中度 | 0.0 |
| 重度 | 0.0 |
| 关节痛 c | |
| 任何程度的关节痛 | 1.5 |
| 轻度 | 1.5 |
| 中度 | 0.0 |
| 重度 | 0.0 |
| 肌肉痛 C | |
| 任何程度的肌肉痛 | 2.9 |
| 轻度 | 2.2 |
| 中度 | 0.7 |
| 重度 | 0.0 |
| 呕吐 d | |
| 任何程度的呕吐 | 2.9 |
| 轻度 | 2.9 |
| 中度 | 0.0 |
| 重度 | 0.0 |
| 腹泻 e | |
| 任何程度的腹泻 | 0.7 |
| 轻度 | 0.7 |
| 中度 | 0.0 |
| 重度 | 0.0 |
| 上述任何全身不良反应 f | 12.3 |
| 使用退烧药 g | 5.8 |
| |
声明
- 沛儿13用药指南旨在提供沛儿13说明书和医学资源中描述的处理策略。辉瑞公司无法对特定患者的治疗做出任何建议,应由医生根据特定患者的病史和临床状况做出临床判断,以采取合适的治疗措施。
局部不良反应,如局部红肿、局部疼痛、局部硬结处置原则
- 红肿直径和硬结<15mm的局部反应,一般不需任何处理。
- 红肿直径和硬结在15~30mm的局部反应,可用干净的毛巾先冷敷,出现硬结者可热敷,每日数次,每次10~15分钟。
- 红肿和硬结直径≥30mm的局部反应,应及时到医院就诊。
声明
- 沛儿13用药指南旨在提供沛儿13说明书和医学资源中描述的处理策略。辉瑞公司无法对特定患者的治疗做出任何建议,应由医生根据特定患者的病史和临床状况做出临床判断,以采取合适的治疗措施。
发热处置原则3
- 受种者发热在≤37.5℃时,应加强观察,适当休息,多饮水,防止继发其他疾病。
- 受种者发热>37.5℃或≤37.5℃并伴有其他全身症状、异常哭闹等情况,应及时到医院诊治。
严重过敏反应的处理方法2
- 保持肾上腺素和其他管理急性过敏反应的药物随时可用,一旦在使用过程中出现急性严重过敏性反应,应立即给予肾上腺素肌肉注射及其他管理过敏反应的药物。
1.沛儿13®说明书.
2.Prevnar 13 US Food and Drug Administration Package Insert. https://www.fda.gov/media/107657/download Accessed April 28, 2025
3.中华人民共和国国家卫生和计划生育委员会.2016.预防接种工作规范(2016年版). 国卫办疾控发[2016]51号.
4.Australian Government Department of Health.2020.The Australian Immunisation Handbook 10th Edition. https://immunisationhandbook.health.gov.au/vaccination-procedures/administration-of-vaccines. Accessed August 16 , 2024.
5.Contraindications and Precautions. General Best Practice Guidelines for Immunization: Best Practices Guidance of the Advisory Committee on Immunization Practices (ACIP). Accessed July 25, 2024.



