
前言
细胞周期蛋白依赖性激酶4/6抑制剂 (CDK4/6i) 为晚期HR+/HER2-乳腺癌带来了更高的临床获益,重塑了HR+/HER2-乳腺癌的治疗格局,但仍有部分早期以及几乎所有晚期患者在接受CDK4/6i联合内分泌治疗后会产生耐药,导致疾病进展。CDK4/6i的原发或继发耐药问题为内分泌治疗提出了新的挑战,许多研究试图了解CDK4/6i耐药的机制,并关注与耐药相关的遗传改变。虽然目前已有研究描述了几种与乳腺癌复发相关的分子突变特征,但现有结果不足以指导临床实践或产生新的合理治疗方案。近期发表的两篇研究利用转录组分析揭示了驱动不同CDK4/6i药物耐药的不同机制和生物标记物,这些生物标记物可能有助于指导CDK4/6i使用后疾病进展患者的后续治疗策略。
CDK4/6i的耐药机制
CDK4/6i的耐药驱动因素可大致分为两类,包括(i)细胞周期调节的改变和(ii)致癌相关信号转导通路的激活。CDK4/6抑制剂通过Cyclin-CDK-Rb-E2F-细胞周期相关通路产生作用,肿瘤抑制因子RB缺失或突变、Aurora激酶AURKA的过表达、CDK6的过表达、细胞周期蛋白CCNE1/2的过表达等参与了细胞周期特异性的耐药机制。
在致癌信号通路激活方面,肿瘤抑制因子PTEN的缺失可以上调AKT/mTOR信号,导致CDK2和CDK4表达增加;AKT1激活通过降低p27活性导致下游CCNE1/2和CDK2过度激活;RAS/MAPK通路的激活、FGFR通路激活、以及ERBB2激活也可刺激致癌信号通路,并介导CDK4/6i耐药1。需要注意的是,不同的CDK4/6i药物之间耐药的机制可能存在不同,分析不同药物的耐药机制,有助于确定药物使用顺序或靶向不同信号通路,可能有效地延缓疾病进展和/或改善患者生存。
基于CDK4/6i耐药后转录组特征的分层治疗策略
目前,三款治疗乳腺癌的CDK4/6i哌柏西利、瑞波西利、阿贝西利在无进展生存(PFS)方面的获益相似:
- PALOMA-2研究显示,哌柏西利联合AI的PFS比单独使用AI延长10.3个月(24.8个月 vs 14.5个月);
- MONARCH-3研究显示,阿贝西利联合AI的的PFS比单独使用AI延长13.4个月(28.1个月 vs 14.7个月);
- MONALEESA-2研究显示,瑞波西利联合AI的PFS比单独使用AI延长9.3个月(25.3个月 vs 16.0个月)。
虽然这三种CDK4/6i具有相似的靶点和mPFS,但它们在结构、次要靶点、毒性谱和给药方案方面存在差异。相比阿贝西利,哌柏西利和瑞波西利在结构上更相似。阿贝西利通过靶向CDK4/6以外的激酶,包括其他CDKs,显示出更广泛的次要效应。由于不同CDK4/6i具有各自独特的多重药理学作用,而非仅抑制CDK4和CDK6激酶,导致每种抑制剂的耐药机制各不相同。
此外,不同CDK4/6i在临床毒性方面的差异可能会影响患者的使用偏好。更好地了解肿瘤对每种抑制剂敏感的途径,特别是在初始CKD4/6i进展后,对于确定哪些患者将受益于哪种CDK4/6i,以及如何在疾病进展后选择最佳后续治疗策略至关重要2。
近期发表的两篇研究分析了驱动不同CDK4/6i耐药的相关机制。Navarro-Yepes J等人3的研究分析了哌柏西利和阿贝西利耐药的不同机制,该研究以CDK4/6i进展的患者来源的哌柏西利或阿贝西利耐药的ER+/HER2-乳腺癌细胞系、患者源性肿瘤组织异种移植物(PDX)和PDX来源类器官为研究模型,分析哌柏西利或阿贝西利耐药细胞的转录组学和蛋白质组学特征。研究结果发现,相比阿贝西利耐药,哌柏西利耐药细胞G2-M通路存在上调。来自哌柏西利耐药乳腺癌患者的PDX和类器官模型也具有G2-M通路上调的特征,并且对阿贝西利仍有反应。
从机制上看,用阿贝西利治疗哌柏西利耐药细胞导致G2期积累和抑制CDK1-Y15/T14磷酸化增加,阻碍细胞进入有丝分裂。在哌柏西利耐药时,与G2-M检查点通路相关的基因组上调,使哌柏西利耐药肿瘤细胞对阿贝西利敏感。而阿贝西利耐药细胞则上调癌高度依赖氧化磷酸化 (OXPHOS)通路,研究通过阻断细胞OXPHOS通路可抑制耐药细胞增殖,对阿贝西利和哌柏西利均耐药的PDX和类器官模型也对OXPHOS抑制敏感。
该研究揭示了阿贝西利和哌柏西利耐药模型中信号通路的差异,提出G2/M通路富集的患者在哌柏西利进展后最有可能从阿贝西利治疗中获益,而OXPHOS通路富集的患者最有可能为难治性。研究结果也为评估阿贝西利治疗CDK4/6i耐药患者的前瞻性试验提供了理论依据。此外,该研究提示,哌柏西利耐药和阿贝西利耐药肿瘤细胞表现出不同的转录组学和蛋白质组学特征,而基因组改变存在差异,不能一致地预测对不同CDK4/6i耐药的反应差异。
El-Botty等人4通过对ER+乳腺癌患者的原发性肿瘤样本、PDX模型和同基因细胞系的转录组和代谢组进行分析,发现一部分转移性ER+乳腺OXPHOS。在ER+乳腺癌患者中,OXPHOS 相关基因的高表达预示预后不良。在内分泌和哌柏西利耐药的细胞模型和PDX模型中,阻断OXPHOS 通路可抑制肿瘤生长;在OXPHOS抑制无应答组中,存在G2-M检查点相关基因的上调。
综上,两项研究中的耐药模型显示出相似的基因表达特征,CDK4/6i进展患者可以通过转录组学特征 (未来有可能进行免疫组化分析) 分层到不同二线治疗方案(图1):
在CDK4/6i进展后,G2-M检查点基因高表达的患者可以从进一步的CDK4/6i治疗中获益(如果最初使用哌柏西利治疗,则换用阿贝西利);OXPHOS相关基因高表达的患者则可以通过抑制OXPHOS获益。此外,瑞波西利尚无相关研究,未来可进一步研究其在耐药过程中的基因表达改变和特征。
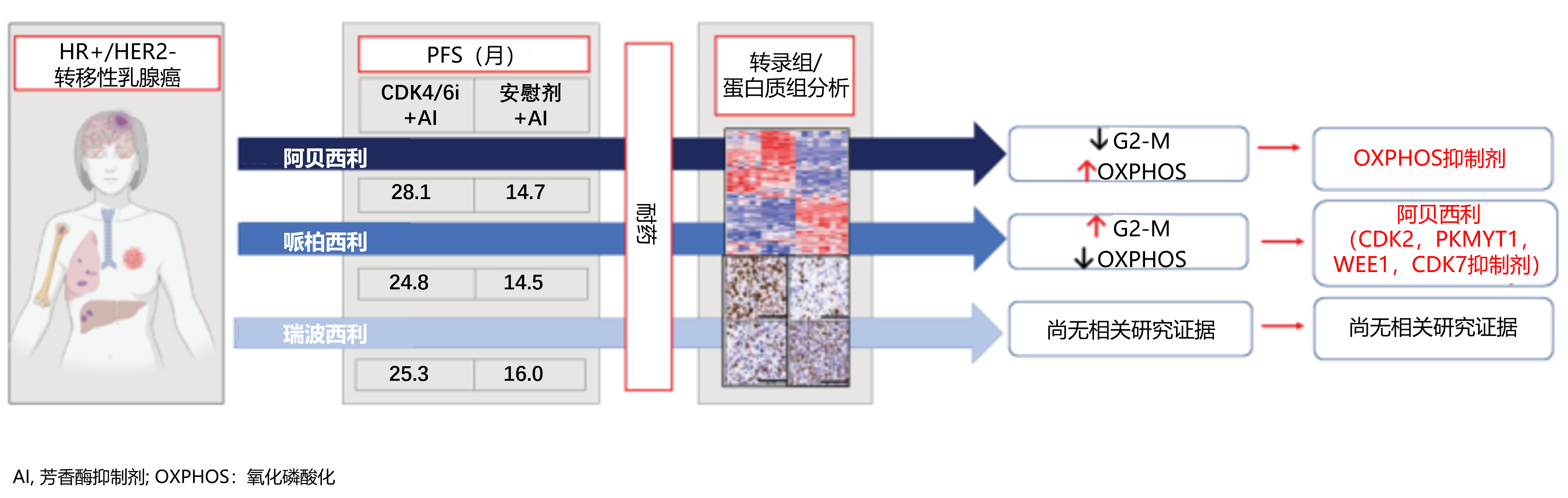
图1 基于CDK4/6i耐药肿瘤转录组学特征的分层治疗策略
基于转录组特征的分层治疗策略中,哌柏西利耐药后的用药方案
上述策略提出在CDK4/6i进展阶段具有G2-M检查点基因高表达特征的患者可以从进一步的CDK4/6i中获益,如果最初使用哌柏西利治疗,可换用阿贝西利。
除了CDK4/6i的再使用,作用于G2-M检查点的激酶抑制剂如靶向CDK2、WEE1、PKMYT1和CDK7的激酶抑制剂等也具有治疗潜力。以CDK2靶点为例,CDK4/6抑制无法诱导完全且持久的细胞周期停滞的限制,与持续的G1-S期细胞周期蛋白表达和CDK2信号传导介导的早期适应有关5。CCNE1/2通过与CDK2的关联促进细胞周期进程,PALOMA-3研究的基因表达分析表明,在CCNE1 mRNA高表达的患者中,哌柏西利的疗效降低,CCNE1高表达组的中位PFS为7.6个月,而CCNE1低表达患者为14.1个月。通过耐药肿瘤活检的WES分析, CCNE2扩增也被确定为耐药的潜在因素1。研究发现,由于CCNE1扩增而获得CDK4/6i抗性的细胞,可以通过靶向CDK2来重新对治疗敏感5。
此外,近期研究发现抑制CDK2后,细胞表现出底物磷酸化的快速丧失,并在数小时内反弹。CDK4/6活性可阻止CDK2的抑制,并通过维持Rb1过度磷酸化、活跃的E2F转录和细胞周期蛋白cyclin A2表达来维持增殖,从而在药物存在下重新激活CDK2。这些研究结果增强了我们对CDK可塑性的理解,并表明可能需要同时抑制CDK2和CDK4/6,来抑制对CDK4/6i的耐药。
结论
上述研究强调了使用转录组学和/或蛋白质组学生物标志物来探索CDK4/6i进展后治疗选择的潜在靶点的必要性。CDK4/6i进展患者可以通过转录组学特征分层到二线治疗:在进展阶段具有G2-M基因高表达特征的患者可以从进一步的CDK4/6i治疗中获益(如果最初使用哌柏西利治疗,则换用阿贝西利);此外,抑制G2-M检查点激酶(如CDK2等靶点)也可逆转CDK4/6i耐药;对于CDK4/6i耐药后出现OXPHOS相关基因高表达,未来可探索抑制OXPHOS通路的治疗方案。尽管CDK4/6i已取得很大进展,但未来仍需更深入地了解CDK4/6i耐药的机制,识别和验证有临床价值的疗效预测和预后生物标志物。
参考文献
- Lloyd M R, Spring L M, Bardia A, et al. Mechanisms of Resistance to CDK4/6 Blockade in Advanced Hormone Receptor-positive, HER2-negative Breast Cancer and Emerging Therapeutic Opportunities [J]. Clin Cancer Res, 2022, 28(5): 821-30.
- Wingate H F, Keyomarsi K. Distinct Mechanisms of Resistance to CDK4/6 Inhibitors Require Specific Subsequent Treatment Strategies: One Size Does Not Fit All [J]. Cancer Res, 2023, 83(19): 3165-7.
- Juliana Navarro-Yepes, Nicole M Kettner, Xiayu Rao, et al. Abemaciclib Is Effective in Palbociclib-Resistant Hormone Receptor–Positive Metastatic Breast Cancers [J]. Cancer research, 2023, 83(19): 3264-83.
- El-Botty R, Morriset L, Montaudon E, et al. Oxidative phosphorylation is a metabolic vulnerability of endocrine therapy and palbociclib resistant metastatic breast cancers [J]. Nat Commun, 2023, 14(1): 4221.
- Herrera-Abreu M T, Palafox M, Asghar U, et al. Early Adaptation and Acquired Resistance to CDK4/6 Inhibition in Estrogen Receptor-Positive Breast Cancer [J]. Cancer Res, 2016, 76(8): 2301-13.



