- 通用名称:注射用醋酸地加瑞克1
- 英文名称:Degarelix Acetate for Injection1
本品为促性腺激素释放激素(GnRH)拮抗剂,适用于需要雄激素去势治疗的前列腺癌患者1。
- 本品主要活性成份为地加瑞克1
- 化学名称1:
D‐丙氨酰胺,N‐乙酰基‐3‐(2‐萘基)‐D‐丙氨酰‐4‐氯代‐D‐苯丙氨酰‐3‐(3‐吡啶基)‐D‐丙氨酰‐L‐丝氨酰‐4‐[[[(4S)‐六氢‐2,6‐二氧代‐4‐嘧啶基]甲酰基] 氨基]‐L‐苯丙氨酰‐4‐[(氨甲酰基)氨基]‐D‐苯丙氨酰‐L‐亮氨酰‐N6‐(1‐甲基乙基)‐L‐赖氨酰‐L‐脯氨酰
- 化学结构式1:
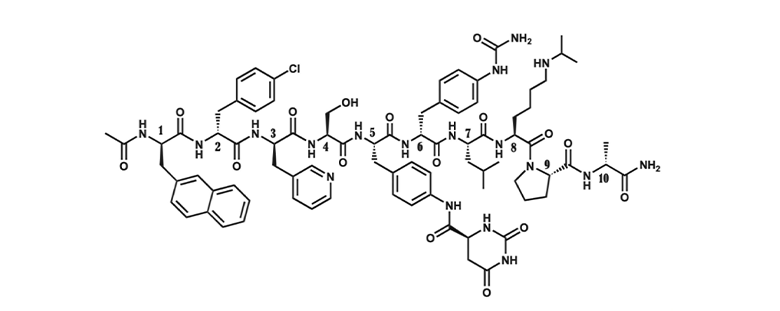
- 分子式:C82H103N18O16ClnC2H4O2
- 分子量:1632.3 (以C82H103N18O16Cl计)
- 辅料:粉针为甘露醇;溶剂为注射用水
粉针为白色至类白色冻干块状物;溶剂为无色的澄明液体1。
地加瑞克是一种选择性的促性腺激素释放激素(GnRH)拮抗剂,可竞争性和可逆地结合垂体GnRH受体,从而快速减少促性腺激素、促黄体激素 (LH)及促卵泡激素 (FSH)的释放,并减少睾丸分泌睾酮(T)。目前已知前列腺癌被认为对雄激素敏感,且去雄激素治疗对其具有疗效。不同于GnRH激动剂,GnRH拮抗剂在初始治疗后不会诱导LH激增和随后的睾酮激增/肿瘤刺激以及潜在的症状加重1。
(1) 80mg1;
(2) 120mg (以地加瑞克计)1
| 起始剂量 | 维持剂量(每28天给药一次) |
|---|---|
| 240mg,分2次连续皮下注射,每次120mg,浓度为40mg/mL | 一次皮下注射80mg,浓度为20mg/mL |
起始剂量给药28天后给予首个维持剂量。
起始剂量1
- 单个起始剂量包含240mg地加瑞克,分为两次注射,每次3mL/120mg。
- 注射用粉末120mg:1瓶含有120mg地加瑞克。每瓶需要用1支含3mL无菌注射用水的预充式注射器复溶。3mL无菌注射用水溶解120mg地加瑞克,得到的终浓度为40mg/mL。
维持剂量1
- 单个维持剂量包含80mg地加瑞克,单次注射4mL/80mg。
- 注射用粉末80mg:1瓶含有80mg地加瑞克。每瓶需要用1支含4.2mL无菌注射用水的预充式注射器复溶。4mL无菌注射用水溶解80mg地加瑞克,得到的终浓度为20mg/mL。
禁忌1
- 对本品所含活性成份或任何辅料过敏者;已经或可能怀孕的女性禁用地加瑞克。
特殊人群1
- 肝功能受损患者轻、中度肝功能受损的患者无需调整剂量。尚未对伴有严重肝功能受损的患者进行研究,故用药时需谨慎。
- 肾功能受损患者轻度肾功能受损的患者无需调整剂量。中、重度肾功能受损患者的研究数据有限,故用药时需谨慎。
- 老年人无需调整剂量。
复溶和给药说明1
*本品必须由专业医疗人员给药。
- 和其他皮下注射给药的药物一样,本品应定期改变注射部位。应避免在暴露于压力的腹部区域注射,如不要靠近腰带部位,也不要靠近肋骨。
- 本品以冻干粉形式提供,需使用无菌注射用水复溶。应严格按照复溶说明操作。不建议使用其它浓度给药。注射前请阅读完整的说明。
注意: 本品仅在腹部皮下给药。
- 复溶后的药物必须在加入无菌注射用水后的1小时内注射。
- 请勿振摇药瓶。
- 遵守无菌操作。
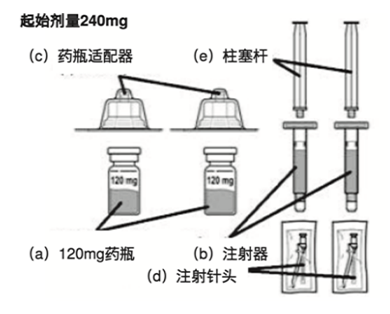
本品240mg起始剂量药盒包含1:
- 2支含有120mg地加瑞克冻干粉的药瓶 (a)
- 2 支含无菌注射用水的注射器 (b)
- 2个药瓶适配器 (c)
- 2支注射针头 (d)
- 2个柱塞杆 (e)
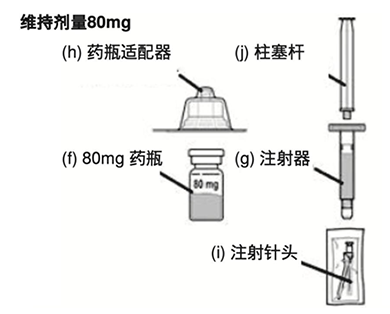
本品80mg维持剂量药盒包含1:
- 1 支含有80mg地加瑞克冻干粉的药瓶 (f)
- 1 支含无菌注射用水的注射器 (g)
- 1 个药瓶适配器 (h)
- 1 支注射针头 (i)
- 1 个柱塞杆 (j)
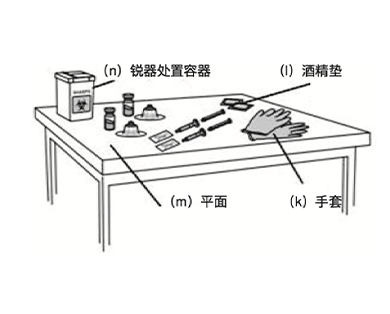
另外,医疗人员还需配备1:
- 手套 (k)
- 酒精垫 (l)
- 清洁的平面 (m),用于在上面操作,如桌子
- 锐器处置容器 (n),用于收集使用过的针头和注射器
*必须按照下面的说明配制药品
*注意:对于起始剂量的2次注射,在腹部皮下给药之前,必须重复混合操作。
步骤1:将药瓶适配器连接到药瓶上1
- 彻底洗手,戴干净的手套。
- 将需要的所有材料放在清洁的平面上。
- 检查确认本品的药瓶内有冻干粉,无菌注射用水澄清、无颗粒物。
*重要:如果药瓶内无冻干粉或无菌注射用水已变色,请勿使用。
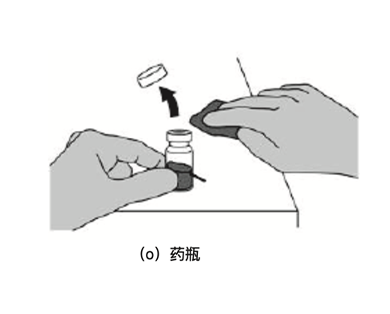
- 打开装本品冻干粉药瓶瓶盖 (o)。
- 用酒精垫擦拭药瓶橡皮塞。
*重要:擦拭后不要触碰药瓶顶部。
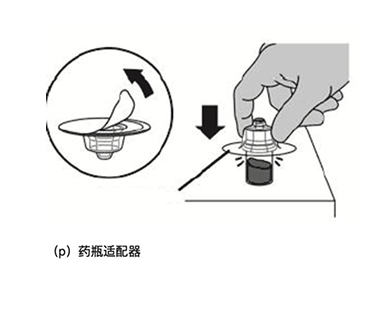
- 揭开药瓶适配器盖上的密封
*重要:不要触碰药瓶适配器。
- 将药瓶适配器 (p)紧压在装本品冻干粉的药瓶上,直至适配器卡入到位。
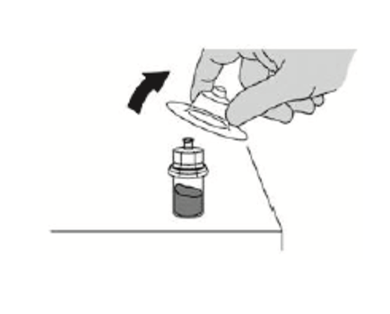
- 将药瓶适配器的盖子从药瓶上取下。
步骤2:装配注射器1
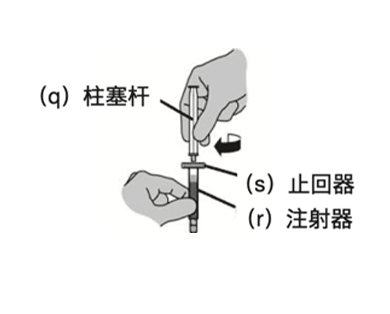
- 将柱塞杆(q)插入装无菌注射用水(r)的预充式注射器,按顺时针方向旋紧柱塞杆。
*重要:不要将止回器(s)从注射器上拉下来。
- 说明:在将柱塞杆拧到位的过程中会有轻微阻力。
步骤3:将无菌注射用水由注射器注入药瓶内1
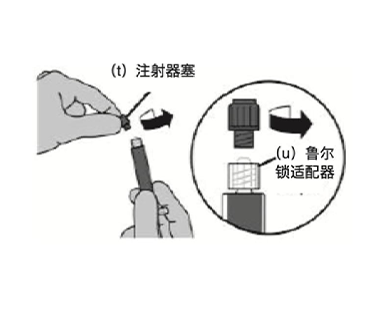
- 拧开连在注射器鲁尔锁适配器上的灰色注射器塞 (t)。
*重要:不要拉掉鲁尔锁适配器 (u)。
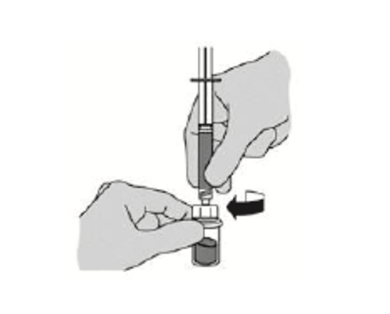
- 小心地将装无菌注射用水的预充式注射器拧在本品冻干粉药瓶的适配器上,直至拧紧。
*重要:小心不要过度拧注射器。
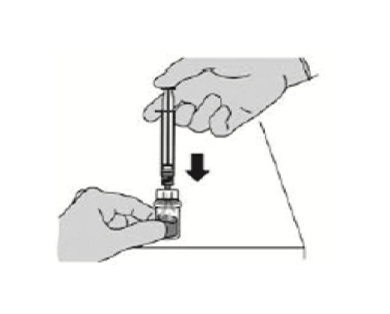
- 缓慢按压柱塞,将所有无菌注射用水由注射器转移至本品冻干粉药瓶。
步骤4:复溶注射剂1
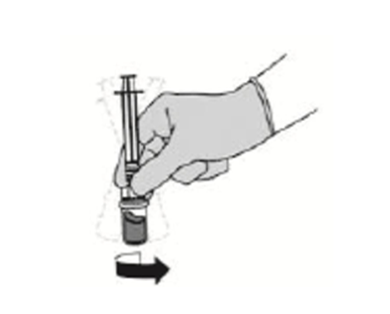
- 保持注射器连在药瓶适配器上,轻轻旋动,直至液体澄清、无粉末或可见颗粒物。
重要:
*不要振摇药瓶,避免产生气泡。
*注射给药前复溶。
注意:
- 如果粉末附着在药瓶的侧壁,可轻轻倾斜药瓶。液体表面的小气泡是可以接受的。
- 复溶时间最长可持续15分钟,但通常仅需要几分钟。
步骤5:将液体转移至注射器1
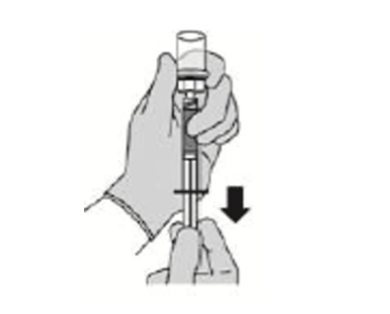
- 将药瓶完全颠倒后,向下拉柱塞,将所有复溶的液体由药瓶吸入注射器内。
- 用手指轻敲注射器,将气泡逐至注射器的尖端。
- 按压柱塞至注射器上的刻线处,排出所有气泡。
步骤6:准备使用注射器注射1
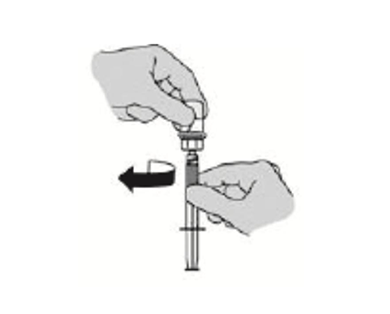
- 手握药瓶适配器,从药瓶适配器上将注射器旋开,使注射器与药瓶分离。 注意:注射给药前复溶。
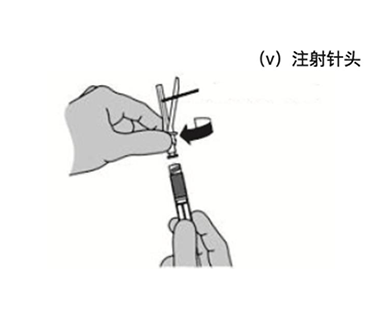
- 手握注射器,尖端朝上,按顺时针方向。(向右)将注射针头(v)拧到注射器上。
步骤7:患者准备1
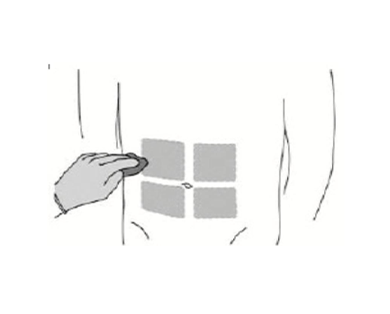
- 选择腹部的4个可用注射部位中的一个。
重要:
*不要在会暴露于压力的区域注射,如束腰带的周围或靠近肋骨处。
*治疗期间应定期改变注射部位,以最大程度地降低患者的不适。
- 使用酒精垫清洁注射部位。
步骤8:进行注射1
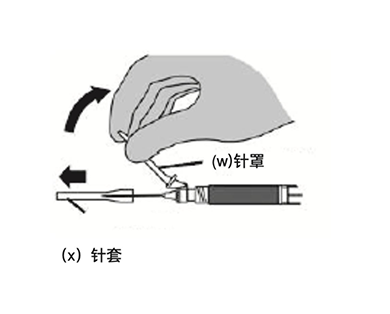
- 从针头上移开针罩 (w),并小心除去针套 (x)
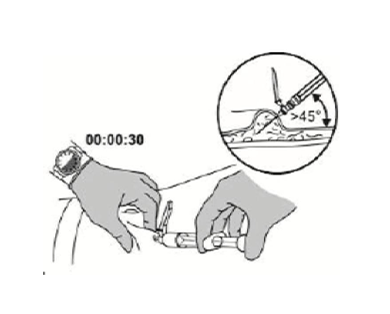
- 捏住并提起腹部皮肤。
- 始终保持与皮肤成45度角,将针头插入皮下。
- 不要注射进静脉或肌肉。轻轻往回拉柱塞,检查是否有血液被抽出。
*重要:如果注射器内出现回血,不要注射药品。停止注射并将注射器和针头弃去(为该患者重新复溶同等剂量)。
至少30秒以上,缓慢地深层皮下注射。
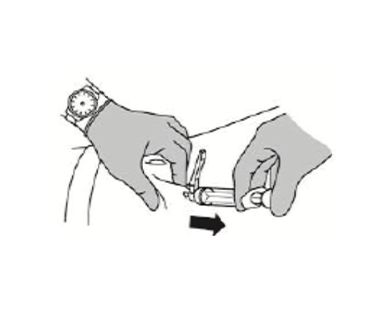
- 取下针头,然后松开皮肤。
*重要:收回针头后不要摩擦注射部位。
步骤9:将针收回针罩内1
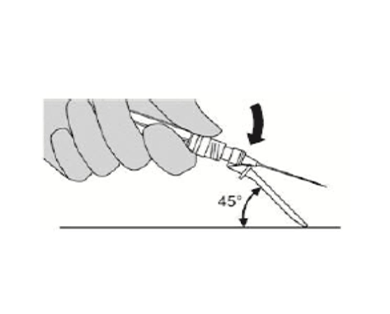
- 将针罩放在与平面成约45度的位置。
- 快速按下针头,直至听到清晰的“咔嗒”声
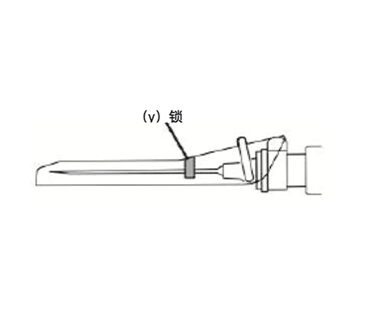
- 确认针头已经完全收回在锁 (y)下。
*重要:注射器仅供一次性使用。不要再次使用注射器和针头。
步骤10:告知患者1
- 指导患者不要摩擦或抓挠注射部位。
- 告知患者,在注射后的数天内注射部位可能会有肿块,并出现发红、疼痛和不适。
处置已使用过的针头和注射器1
- 酒精棉签、针头和注射器在使用后应立即放入锐器处置容器内。请勿将针头和注射器随意丢在垃圾桶里。
- 尚未进行药物相互作用研究1。
- 由于雄激素阻断治疗可能延长QTc间期,地加瑞克用药时同时使用已知可延长QTc间期的药物或可能诱发尖端扭转型室性心动过速的药物如IA类(如奎尼丁、丙吡胺)或III类(如胺碘酮、索他洛尔、多非利特、伊布利特)抗心律失常药物、美沙酮、莫西沙星、抗精神病药等,需谨慎评估(参见【注意事项】)1。
- 地加瑞克不是CYP450酶的底物,在体外并未显示可诱导或抑制CYP1A2,CYP2C8,CYP2C9,CYP2C19,CYP2D6、CYP2E1或CYP3A4/5。因此,不存在与这些同功酶相关的具有临床意义的药代相关的药物‐药物相互作用1。
目前尚无本品过量用药的报道。如有患者过量用药,停用本品,给予对症及支持治疗1。
2008
2014
2020
2020
- 在前列腺癌患者中开展一项开放、多中心、随机、平行组临床试验评价地加瑞克的安全性和有效性。共有620名患者随机分配接受地加瑞克的两种给药方案之一或亮丙瑞林,持续1年1。
- 地加瑞克,起始剂量240mg (40mg/mL),维持剂量为160mg (40mg/mL) 每28天一次,皮下注射。
- 地加瑞克,起始剂量240mg (40mg/mL),维持剂量为80mg (20mg/mL) 每28天一次,皮下注射。
- 亮丙瑞林,7.5mg肌内注射,每28天一次。
- 血清睾酮水平在筛选期、第1个月的第0、1、3、7、14和28天、之后每月一次直至研究结束进行测定1。
- 各治疗组临床试验人群(n=610)的总年龄中位值约为73 (范围:50-98)岁。人种/种族分布为84%为白人,6%为黑人,10%为其他。临床分期大致分布如下:20%为转移期,29%为局部进展期 (T3/T4 Nx M0或N1 M0),31%为局限性 (T1或T2 N0 M0),20%被归类为其他 (包括疾病转移状态不能确定的患者‐或初次根治性治疗后PSA复发的患者)。此外,各治疗组在基线时的睾酮水平中位值约为400ng/dL1。
- 主要目的是证明在12个月的治疗中,地加瑞克能够有效地达到并维持睾酮抑制至去势水平 (T ≤ 50ng/dL)。试验结果见表1所示1。
表1 自第28天至第364天的药物去势率 (睾酮 ≤ 50ng/dL)
| 地加瑞克 240/80mg N=207 | 亮丙瑞林 7.5mg N=201 | |
|---|---|---|
| 应答者的数目 | 202 | 194 |
| 去势率(95% CIs)* | 97.2% (93.5;98.8) | 96.4% (92.5;98.2) |
*组内的Kaplan Meier估计值
- 图1显示了睾酮自基线至第28天的变化百分数(中位值及四分位间距),表2总结了达到药物去势(睾酮 ≤ 50ng/dL)患者的百分数1。
图1 睾酮自基线至第28天的变化的百分数 (中位值及四分位间距),按治疗组列出
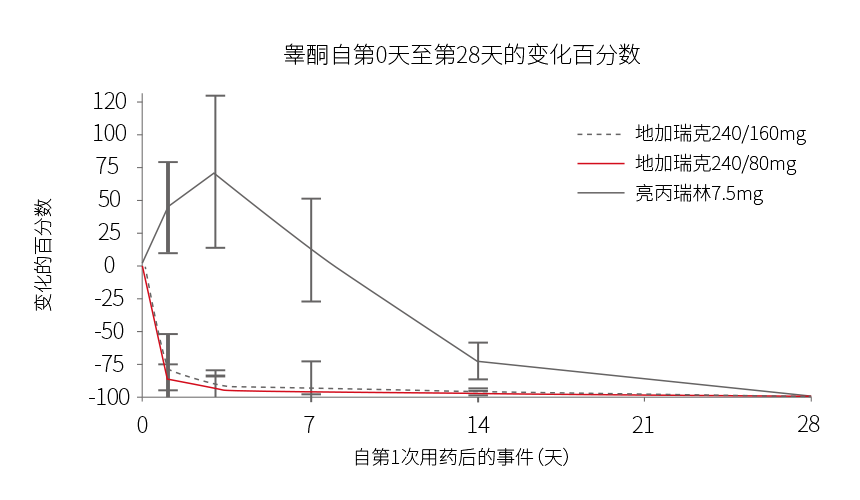
表2 在第一个28天内达到睾酮 ≤ 50ng/dL的患者的百分数
| 地加瑞克 240/80mg N=207 | 亮丙瑞林 7.5mg N=201 | |
|---|---|---|
| 第1天 | 52% | 0% |
| 第3天 | 96% | 0% |
| 第7天 | 99% | 1% |
| 第14天 | 99% | 18% |
| 第28天 | 100% | 100% |
- 在该临床试验中,还检测了PSA水平作为次要终点。在地加瑞克给药2周后,PSA水平降低了64%,给药1个月后降低了85%,给药3个月后降低了95%,并且在一年治疗期内维持抑制状态。由于入组患者群体的异质性,应谨慎解读PSA结果。没有证据表明PSA的快速降低与临床获益有关1。
- 一项在中国前列腺癌患者中进行的开放、多中心、随机、平行组研究评价了地加瑞克的安全性和有效性。共有285名患者被随机分配至地加瑞克治疗组或戈舍瑞林治疗组,持续1年1。
- 地加瑞克,起始剂量240mg (40mg/mL),随后为每28天一次的80mg (20mg/mL)剂量,皮下注射。
- 戈舍瑞林,3.6mg 皮下注射,每28天一次。
- 分别在筛选、第1个月的第0、3和28天、之后每月一次直至研究结束,测定了血清睾酮水平1。
- 两组全分析集人群 (n=283)的年龄中位值约为74 (范围:47-91)岁。疾病阶段大致分布如下:入选时有68名 (24%)有局部前列腺腺癌、174名 (61%)有转移性前列腺癌、30名 (11%)有局部进展期前列腺癌和11名 (4%)有未分类疾病。基线时睾酮平均值在地加瑞克组为4.66ng/mL, 在戈舍瑞林组为4.84ng/mL1。
- 主要目的证明在12个月的治疗中,地加瑞克能够有效地达到并维持睾酮抑制至去势水平 (T ≤ 0.5ng/mL)。试验结果见表3所示。图2展示了睾酮自基线至第364天的变化 (中位值及四分位距离)1。
表3 自第28天 至第364天的药物去势率 (睾酮 ≤ 0.5ng/mL)
| 地加瑞克 240/80mg N=142 | 戈舍瑞林 7.5mg N=140 | |
|---|---|---|
| 去势率 (95% CIs) | 97% (92.3; 98.9) | 93.4% (87.7; 96.5) |
图2 睾酮:试验期间 (观察病例)的中位值 (四分位差)-全分析集
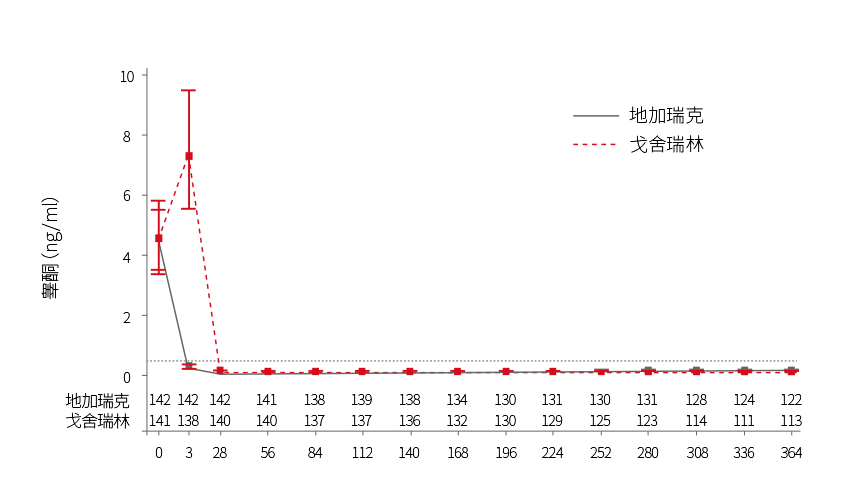
- 地加瑞克组睾酮水平快速抑制至去势水平( ≤ 0.5ng/mL)。第3天,地加瑞克组96%患者的睾酮水平 ≤ 0.5ng/mL,相比而言,戈舍瑞林组无患者睾酮水平 ≤ 0.5ng/mL。两个治疗组第3天睾酮≤0.5ng/mL的患者比例具有统计学差异(p < 0.0001)。与戈舍瑞林治疗相比,使用地加瑞克的治疗可更加快速抑制前列腺特异性抗原水平。治疗第3天,与戈舍瑞林组 (8.65%)相比,地加瑞克组(22.2%)自基线前列腺特异性抗原中位值下降更明显。第28天,两个治疗组的前列腺特异性抗原中位值自基线下降91%。此后,两个治疗组的前列腺特异性抗原下降水平依然相似,第84天地加瑞克组中位值自基线下降97%,戈舍瑞林组下降99%,第364天地加瑞克组中位值下降98%,戈舍瑞林组中位值下降99%1。
地加瑞克不良反应概览
- 地加瑞克最常见(≥10%)的不良反应为注射部位反应、潮热和体重增加2,3。
- 多数AE是暂时性的,严重程度为1级到2级4,通常不影响患者接受地加瑞克治疗;国内外临床试验中尚未发现重大安全问题2,3。
地加瑞克的常见不良反应及特点
≥5%的接受地加瑞克治疗的患者发生的不良反应2
| 不良反应a | 所有分级b,% (地加瑞克240/80mg) |
|---|---|
| 注射部位疼痛 | 28.02% |
| 潮热 | 25.60% |
| 注射部位红斑 | 17.39% |
| 体重增加 | 8.70% |
| 注射部位肿胀 | 6.28% |
| 背部疼痛 | 5.80% |
| 便秘 | 5.31% |
| 寒战 | 5.31% |
| 关节疼痛 | 5.31% |
| 高血压 | 5.31% |
a 治疗中发生、所有有相关性的事件
b 根据NCI CTCAE, 5.0版
- 在 < 5%的接受地加瑞克治疗的患者中报告的不良事件包括尿路感染(4.83%)、恶心(4.35%)、注射部位硬结 (3.86%)、疲乏 (3.38%)、高胆固醇血症 (3.38%)和注射部位结节 (2.90%)等1,2。
≥5%的接受地加瑞克治疗的患者发生的实验室结果异常2
(其余可能发生的实验室结果异常详见说明书)
| 实验室检查异常 | 所有分级a ,% |
|---|---|
| 丙氨酸转氨酶升高 | 9.66% |
| 天门冬氨酸氨基转移酶升高 | 5.31% |
| 高胆固醇血症 | 3.38% |
a 根据NCI CTCAE, 5.0版
- 上述国际多中心III期临床试验(NCT00295750/CS21)报道的常见AE中,严重AE,即导致死亡、危及生命、需要住院治疗或延长当前住院时间、导致持续或显著丧失能力,严重干扰正常生活功能,导致先天性异常或出生缺陷的不良事件,发生率均<1%2。
- 国内临床试验报道的安全性结果与上述相似,≥5%的不良反应分别是:注射部位肿胀(26.8%)、注射部位红斑 (26.8%)、注射部位疼痛 (24.6%)、潮热 (12.7%)、高血压 (9.9%)、注射部位疼痛 (7.0%)、尿路感染 (7.0%)和疲乏 (5.6%)3;国内外试验中地加瑞克安全性的关键性研究数据一致,未发现重大安全问题。
AE概况
注射部位各种反应(ISR)
- 在接受地加瑞克治疗的前列腺癌患者中,ISR为最常见的不良反应(国外临床研究中比例为35%;国内临床研究中比例为45.1%)2,3;ISR可包括注射部位疼痛、注射部位红斑、注射部位肿胀、注射部位硬结、结节等。
- 注射部位的局部反应多发生在首次注射后,起始剂量发生率为33%,维持剂量发生率为4%2,5;患者/研究者报告的AE等级均为轻到中度2,4;在国际多中心III期临床研究CS21和延长研究CS21A中,12/544(2%)接受地加瑞克治疗的患者因ISR终止临床试验2,5;与对照组GnRH激动剂比较,不良事件发生率相似,耐受性良好总体而言,地加瑞克耐受良好,未发现安全问题5。
- ISR与皮下注射给药有关6。地加瑞克在皮下给药后会形成储存库,不断释放地加瑞克进入血液循环1;日本的研究显示ISR可能是一种对异物的反应,病变处的皮肤活检病理结果显示,变性和坏死的脂肪组织周围存在炎性细胞浸润,早期浸润细胞主要中性粒细胞组成,随后被组织细胞取代7。
- 预防及治疗注射疼痛和局部不良反应的策略包括:
- (1) 注射前向患者解释皮下注射程序,从而减少潜在的焦虑;
- (2) 注意注射部位的选择、患者体位姿势、注射速度与时机、给药技术以及与皮肤接触的药物量8,如慢速皮下注射已被证明可降低出现ISR的风险9;
- (3) 药物或物理治疗,扑热息痛或布洛芬可用于治疗注射部位反应,也可使用冰袋等冷却措施10。
心血管疾病(CVD)
- 国际多中心III期临床研究显示,心血管副作用(例如心绞痛、房颤、心力衰竭和心肌缺血)的总体发生率在亮丙瑞林组和地加瑞克组分别为13%和9%2;国内临床试验中使用地加瑞克的患者发生CVD的比例是7.7%,严重CVD比例1.4%,而使用戈舍瑞林的患者发生CVD的比例是10.6%,严重CVD比例3.5%3
- 多项研究及荟萃分析显示,地加瑞克的CVD发生率显著低于GnRH激动剂11-14;一篇汇总6项III期前瞻性随机对照试验结果的荟萃分析指出,与GnRH激动剂相比,GnRH拮抗剂降低心血管事件发生率达56% (HR 0.438, p=0.0018),治疗第一年心血管事件的绝对风险降低8.2%14。
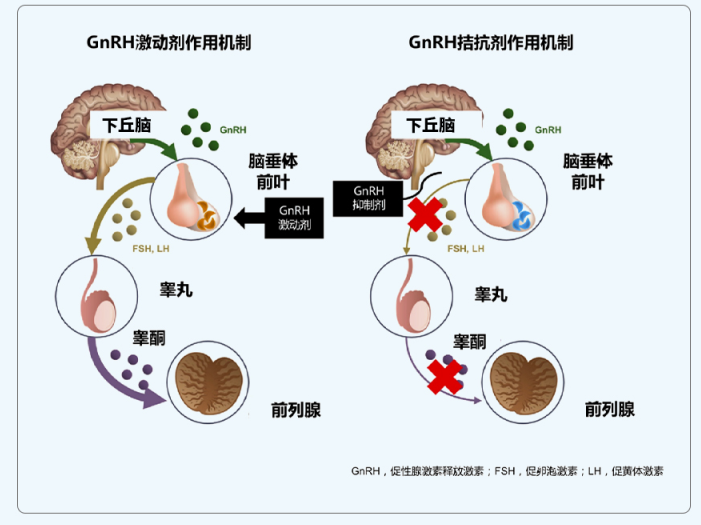
- GnRH激动剂和GnRH拮抗剂的不同作用机制是造成两者CVD发生率差异的主要原因:GnRH激动剂刺激GnRH受体,导致在抑制睾酮前出现FSH、LH和睾酮的激增;地加瑞克 (GnRH拮抗剂)具有直接作用的机制,与受体竞争性、可逆性结合并直接阻断受体,导致FSH、LH和睾酮快速和持续地被抑制15,16;地加瑞克较GnRH激动剂CVD发生率更低的原因包括:
- (1) 研究表明,动脉粥样硬化斑块中表达GnRH受体的细胞几乎均为T细胞,GnRH激动剂激活T细胞,导致促炎性Th1型T细胞生成,增加斑块不稳定性,加剧动脉粥样硬化;地加瑞克阻断T细胞信号传导,维持血管斑块稳定17,18;
- (2) FSH受体表达于多种细胞表面,如脂肪细胞等,FSH通过FSH受体偶连Gαi蛋白,促进钙离子内流,磷酸化环磷酸腺苷 (cAMP)反应元件结合蛋白,导致一系列脂质合成相关的基因激活19;破骨细胞通过FSH相关的信号级联反应,重新吸收斑块内的钙化区域,进一步增加斑块破裂的可能性20;因此,地加瑞克稳定抑制FSH水平的特点可能在脂质代谢、脂肪堆积和骨质吸收中带来其他获益,同时发挥潜在的降低斑块不稳定性的作用。
GnRH激动剂与GnRH拮抗剂作用机制15
高血压
- 国外临床研究中,高血压在接受瑞克治疗患者中的发生率为14%2;国内临床试验报告的高血压发生率为9.9%3。
- 一项基于多中心横断面的人群调查显示,更低的总睾酮水平可能是高血压的潜在风险因素21,这可能是由于在人体中,血管和心肌细胞具有与睾酮结合的受体,睾酮可激活血管舒张21;同时,低水平的睾酮可能与代谢综合征有关22,进而增加高血压的发生风险。
- 对于接受ADT治疗的患者,应定期监测血压水平,根据高血压等级决定是否进行降压治疗;同时应当积极进行生活方式干预 (详见“AE管理”)。
QT间期延长
- 国内临床研究显示,接受地加瑞克治疗患者QTc (校正的QT间期)≥500ms的发生率为 5%3;国外临床研究显示,在接受地加瑞克治疗12个月后,< 1% 的患者出现明显的QT间期异常 (定义为QTc ≥ 500ms)2。
- 在比较地加瑞克与亮丙瑞林的随机、阳性对照试验中定期进行心电图监测。7名患者发生QTcF ≥ 500 msec,其中3名(<1%)来自合并的地加瑞克组,4名(2%)患者来自亮丙瑞林 7.5mg组。自基线至研究结束,地加瑞克组的变化中位值为12.3msec,亮丙瑞林组为16.7msec5。
- 研究表明,睾酮可调控心脏节律,主要通过调控心脏离子通道实现22,23;低睾酮水平能延长心脏动作电位;同时雄激素剥夺疗法 (ADT)可致性腺功能减退,增加QT间期延长和室性心动过速的潜在风险,因此应当对患者的治疗利弊进行个体化评估25。
- 校正的QT间期 (QTc)绝对值与心律失常的发生具有相关性;QTc>500 ms可能与尖端扭转型室速风险显著相关25;对于QT间期>450ms的患者,应谨慎使用ADT26。
- 雄激素去势治疗可能会延长QT间期。对于有先天性长QT综合征、充血性心力衰竭、频繁出现电解质紊乱的患者以及正在服用已知会延长QT间期的药物患者,医护人员应评估雄激素去势治疗的获益是否大于其潜在风险。应纠正电解质紊乱。考虑定期监测心电图和电解质水平1。
肝毒性
- 肝功能受损患者从随机化临床试验中排除。在有轻度(Child Pugh A)或中度(Child Pugh B)肝功能受损的16名非前列腺癌患者中考察了地加瑞克单剂量1mg静脉输注1小时的药代动力学指标。与正常肝功能的非前列腺癌患者相比,在轻度和中度肝功能受损患者中,地加瑞克的暴露量分别降低了10%和18%1。
- 国内外临床试验中较少见地加瑞克严重肝毒性的报道2,3;肝功能实验室检查异常主要为血液中转氨酶和GGT升高,主要为1级或2级4,一般是可逆的。发生3级肝功能实验室检查异常的患者比例<1%2。
- 地加瑞克通过肝胆途径代谢,但由于其并不与肝脏中主要的药物代谢系统(细胞色素P450酶系统)相互作用,因此其他经肝脏代谢的药物与地加瑞克发生药物相互作用的风险极低27,28。
超敏反应
- 尚未针对有速发过敏反应、重度哮喘或血管性水肿严重病史的患者中的安全性特征进行研究。
- 地加瑞克上市后曾报告超敏反应,包括过敏反应、荨麻疹和血管性水肿。发生严重超敏反应时,如果注射尚未完成,应立即停止注射地加瑞克,并对症处理;已知对本品有严重超敏反应史的患者不应再次使用本品1。
骨质疏松
- 骨质疏松是ADT治疗普遍存在的不良反应,研究表明由睾酮转化而来的雌二醇会影响骨代谢29;一项基于老年男性人群的研究表明,低雌二醇水平与低骨量和更高的骨折风险有关30;随着ADT治疗显著降低睾酮水平,雌二醇水平的降低将会导致患者骨质疏松和骨折风险的增加29,31。
- 地加瑞克与GnRH激动剂相比,关节事件发生率更低 (HR 0.64, p=0.041),肌肉骨骼事件的发生率更低 (HR 0.55,p<0.001),血清碱性磷酸酶(S-ALP)降至更低水平(p=0.037)32;与GnRH激动剂相比,地加瑞克作为GnRH拮抗剂对促卵泡激素 (FSH)具有更好的抑制作用,考虑到FSH诱导骨骼吸收增加的潜在作用,抑制FSH可能可以帮助减少骨破坏33。
- 骨质疏松是无症状的,只有当骨质疏松性骨折发生时才表现出临床症状34;骨质疏松性骨折是导致死亡和残疾的重要原因,显著降低生活质量,是接受ADT治疗患者OS的独立负面预后因素35;因此应当重视对骨质疏松的预防和治疗。
代谢副作用
- ADT的代谢事件主要包括胰岛素抵抗、葡萄糖耐受不良和血脂变化36,37;上述症状与代谢综合征重叠,而代谢综合征患者更易发生II型糖尿病38;国内外临床试验中报告的地加瑞克代谢副作用主要为:高胆固醇血症 (国外临床试验中的发生率为3.38%)2,高血糖/肥胖/II型糖尿病 (国内临床试验报告的发生率均在0.2%以下)3。
- 睾酮是一种增加肌肉含量、减少脂肪堆积以及增强胰岛素敏感性的合成激素,因此低水平的睾酮可能与代谢综合征有关,如肥胖等22;而体重增加又可导致睾酮水平下降39,40;接受长期ADT治疗将诱发严重性腺功能减退症,直接导致患者发生血脂异常、胰岛素抵抗、高血糖和代谢综合征的风险增高41;应尽早识别并采取干预措施以降低代谢异常的相关风险38。
地加瑞克用药指南旨在帮助您评估患者出现的不良事件的分级,并提供地加瑞克说明书及医学文献中描述的处理策略。辉瑞公司无法对患者的治疗做出任何建议,应由医生根据特定患者的病史和临床症状做出临床判断,以采取合适的治疗措施。

注射部位各种反应 (ISR)
- 分级及剂量调整4

- 已有多种方法被用于预防各类药物皮下注射治疗引起的ISR,例如口服抗组胺药、短期类固醇治疗和脱敏治疗42,43。
- 应在给药前向患者提供有关地加瑞克可能引起的ISR的相关信息,尤其是未接受类固醇治疗的患者和从未接受过皮下注射治疗的患者,从而减少潜在的焦虑8;开展包含皮肤科医生检查在内的前瞻性研究将更有助于探究如何更准确地评估ISR7。
- 在进行地加瑞克注射前,应谨慎选择注射部位,在身体不会受到压力的区域进行,因此优选腰带外区域或肋骨的部位;腹部是地加瑞克注射的首选部位,因为该区域皮肤有皮下组织,可能会降低注射药物外渗到表面组织平面的风险8。
- 注射应由经验丰富的医疗保健专业人员进行,患者应采取仰卧位,可增加对药物输送的控制 (即增加患者和医技人员的稳定性);应慢速深入皮下注射到腹部,避免皮内注射;慢速皮下注射已被证明可降低出现ISR的风险 (减少注射部位的瘀伤程度和疼痛程度),这可能是因为较慢的注射减少了注射部位的压力,从而减少了组织创伤8。
- 若在给药后确实发生ISR,冷敷纱布可缓解症状,冷敷可减少注射部位的血管收缩,减缓血液流动和新陈代谢,减轻炎症过程和局部生理效应;扑热息痛或布洛芬亦可用于治疗ISR8。
心血管疾病(CVD)
- 美国心脏病学会/美国心脏协会临床实践指南工作组的联合声明中指出,推荐应用治疗指南中推荐的治疗方案以控制CVD风险因素,如高血压、高脂血症、糖尿病和吸烟等44;加拿大泌尿外科协会(CUA)指南建议每一例接受ADT治疗的前列腺癌患者都应筛查并评估CVD危险38;对于既往有心梗和卒中史的患者,ADT治疗选择推荐GnRH拮抗剂38;临床医生须个体化权衡ADT的益处与潜在的心血管毒性45。
- Montazeri等人开发了“ABCDE”模式来管理癌症患者的心血管风险因素46,并针对前列腺癌患者进行了调整47。“ABCDE”分别表示:A (Awareness/Aspirin,知情/阿司匹林),B (Blood pressure,血压),C(Cholesterol/Cigarettes,胆固醇/吸烟),D (Diabetes/Diet,糖尿病/饮食),E (Exercise,运动)47。
高血压
监测与预防
- 在开始接受地加瑞克治疗前,应告知患者高血压发生的可能性及治疗期间血压监测的必要性;对接受ADT治疗患者的生活方式干预包括但不限于:戒烟;每周进行150分钟中等强度的体育活动;采用富含水果、蔬菜和全谷物且饱和脂肪含量低的饮食45。
高血压分级、降压治疗推荐和地加瑞克剂量调整4
- 根据2017ACC/AHA指南评估高血压等级并决定是否开始降压治疗44。
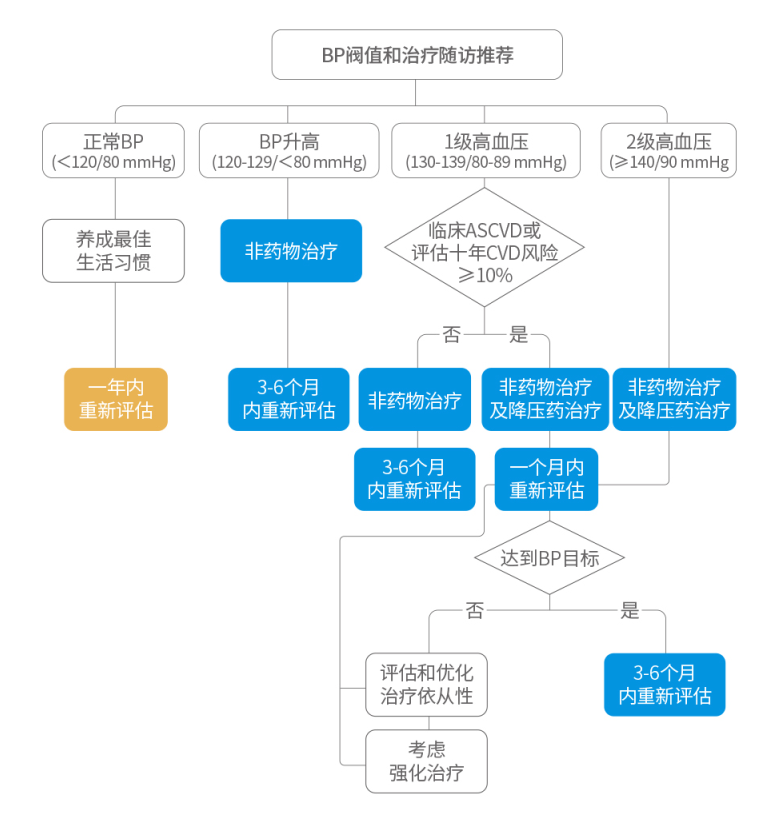
- 2级以上高血压或高血压危象应谨慎或终止地加瑞克治疗。
- 作为护理团队必不可少的合作伙伴,泌尿科医生需与肿瘤科医生和心脏科医生之间进行有效沟通和协作,这对于通过癌症护理和心血管结果等实现患者最佳生存至关重要15。
QT间期延长
监测与预防
- 对于接受ADT治疗的患者,应评估QT间期以及其他导致QT间期延长的药物使用情况 (如抗生素等)。
- ADT可导致长QT间期综合征、尖端扭转型室速25 和猝死,尤其当患者暴露于其他危险因素,如性腺功能减退时。因此,对接受ADT或先前患有长QT间期综合征、充血性心衰、长期电解质紊乱、或长期服用引起QT间期延长药物的患者或已知性腺功能减退患者,医护人员应评估雄激素去势治疗的获益是否大于其潜在风险,权衡利弊后决定是否使用本品,并且应定期监测心电图48;同时对于其他可致QT间期异常的因素,如电解质紊乱等49,应及时纠正并定期监测1。
- 分级及剂量调整4

- 地加瑞克用药时同时使用已知可延长QTc间期的药物或可能诱发尖端扭转型室性心动过速的药物如IA类 (如奎尼丁、丙吡胺)或III类(如胺碘酮、索他洛尔、多非利特、伊布利特)抗心律失常药物、美沙酮、莫西沙星、抗精神病药等,需谨慎评估。
肝毒性
监测
- 在开始地加瑞克治疗前应检查丙氨酸氨基转移酶 (ALT)、天门冬氨酸氨基转移酶(AST)及胆红素基线水平,并在整个治疗期间定期监测上述指标。
- 肝功能异常分级及剂量调整50

- 地加瑞克用于轻度或中度肝功能受损患者时不需要进行剂量调整。但是,由于肝功能受损可降低地加瑞克暴露量,建议肝功能受损患者应每月一次检查血睾酮浓度,直至达到药物去势。一旦达到药物去势可考虑隔月一次检查血浆睾酮浓度。
- 尚未在重度肝功能受损的患者开展研究,因此在该类人群中应谨慎使用。
超敏反应
- 分级及剂量调整4
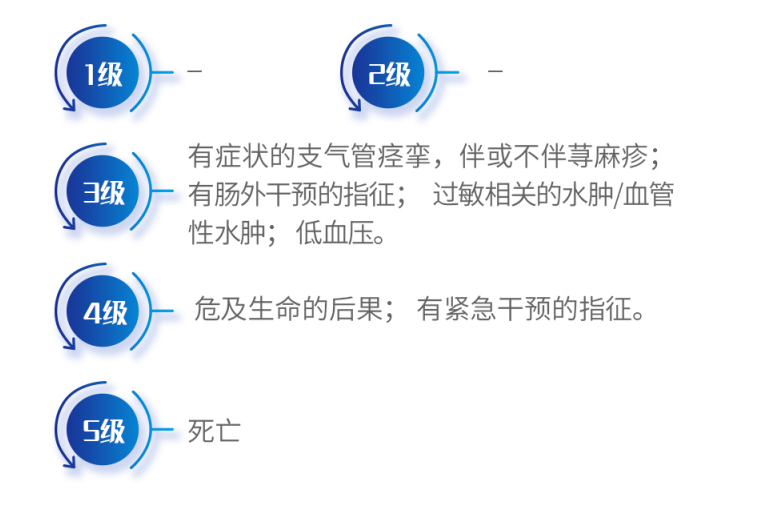
- 发生严重超敏反应时,如果注射尚未完成,应立即停止注射地加瑞克,并对症处理;已知对本品有严重超敏反应史的患者不应再次使用本品1
骨质疏松
监测
- 监测骨密度可精准预测骨折风险,前臂远端骨密度是男性总体骨折风险的最强预测因子51,52;建议在开始ADT治疗前常规评估骨密度,并在治疗过程中进行监测34。
- 分级及剂量调整4

- 双膦酸盐是通过抑制破骨细胞活性和促进破骨细胞凋亡从而减少骨吸收,是治疗男性骨质疏松症的标准用药53;明确识别个体患者骨质疏松症的危险因素有助于决定肿瘤治疗过程中是否使用双膦酸盐进行治疗54。
- 应当对患者进行骨质疏松相关风险和预防措施的教育,如益于整体健康和骨骼健康的生活方式等,包括锻炼和避免吸烟、过量饮酒和过度摄入咖啡因,以及对骨质流失的人进行更积极的干预54。
代谢副作用
分级及剂量调整4
糖耐量异常

高血糖
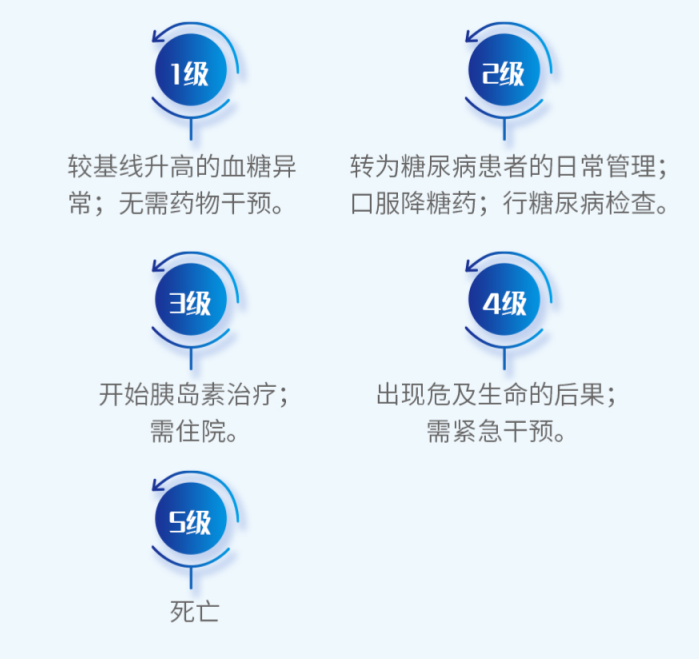
高甘油三酯血症

- 在ADT开始时以及治疗开始后的6-12个月内,应使用空腹血糖水平、血红蛋白A1c水平或口服糖耐量试验进行糖尿病筛查;应在ADT开始时检测基线血脂水平 (甘油三酯、低密度脂蛋白、高密度脂蛋白和总胆固醇),并在整个治疗期间进行监测;应大力鼓励戒烟,并将血压稳定在130/80mm Hg以下45,55。
- 研究表明,运动可使接受ADT的晚期前列腺癌患者获益:运动可降低身体质量指数(BMI)、脂肪量和葡萄糖水平,改善血脂和胰岛素敏感性55,56,因此鼓励患者使用阻力训练和有氧训练结合的锻炼方案,以改善身体成分、代谢状况和身心健康58。
声明:
- 关于地加瑞克更多详细信息请参见完整版药品说明书。
- 辉瑞公司无法针对个体患者不良事件的诊断和处理提出任何临床建议,应当由临床医生根据患者的具体请况作出合理判断和采取相应措施。
- 2025 Canadian Urological Association-Canadian Uro-oncology Group Guideline: Metastatic castration-resistant prostate cancer (Update). 查看全文
- Systemic Therapy in Patients With Metastatic Castration-Resistant Prostate Cancer: ASCO Guideline Update. 查看全文
- 2025 Canadian Urological Association-Canadian Uro-oncology Group Guideline: Metastatic castration-naive and castration-sensitive prostate cancer (Update). 查看全文
- EAU - EANM - ESTRO -ESUR - ISUP - SIOG Guidelines on Prostate Cancer. 查看全文
- NCCN Clinical Practice Guidelines in Oncology: Prostate Cancer. 查看全文
- ESTRO ACROP guideline on prostate bed delineation for postoperative radiotherapy in prostate cancer. 查看全文
- Salvage Therapy for Prostate Cancer: AUA/ASTRO/SUO Guideline Part I: Introduction and Treatment Decision-Making at the Time of Suspected Biochemical Recurrence after Radical Prostatectomy. 查看全文
- 2023 Canadian Urological Association guideline: Genetic testing in prostate cancer. 查看全文
- Addressing the risk and management of cardiometabolic complications in prostate cancer patients on androgen deprivation therapy and androgen receptor axis-targeted therapy: consensus statements from the Hong Kong Urological Association and the Hong Kong Society of Uro-Oncology. 查看全文
- Updates to Advanced Prostate Cancer: AUA/SUO Guideline (2023). 查看全文
- Updated treatment recommendations for prostate cancer from the ESMO Clinical Practice Guideline considering treatment intensification and use of novel systemic agents. 查看全文
请注意:我们不建议超出国家药品监督管理局批准的药品说明书的应用或未在中国(不含港澳台)上市药品的应用。如我们所提供的文献信息及指南共识涉及该等内容,系出于传递科学知识的需要,不应视为对未在中国(不含港澳台)上市药品或已在中国上市但超出国家药品监督管理局批准的药品说明书的药品适应症/用法的推广。
1. 注射用醋酸地加瑞克说明书
2. Klotz, L. et al. The efficacy and safety of degarelix: a 12-month, comparative, randomized, open-label, parallel-group phase III study in patients with prostate cancer. BJU Int 102, 1531-1538, doi:10.1111/j.1464-410X.2008.08183.x (2008).
3. Sun, Y. et al. Efficacy and safety of degarelix in patients with prostate cancer: Results from a phase III study in China. Asian J Urol 7, 301-308, doi:10.1016/j.ajur.2019.09.003 (2020).
4. SERVICES, U. S. D. O. H. A. H. Common Terminology Criteria for Adverse Events (CTCAE) Version 5.0. (2017).
5. Crawford, E. D. et al. Long-term tolerability and efficacy of degarelix: 5-year results from a phase III extension trial with a 1-arm crossover from leuprolide to degarelix. Urology 83, 1122-1128, doi:10.1016/j.urology.2014.01.013 (2014).
6. Thomaidou, E. & Ramot, Y. Injection site reactions with the use of biological agents. Dermatol Ther 32, e12817, doi:10.1111/dth.12817 (2019).
7. Maeda, T. et al. Evaluation of histopathological findings at the injection site following degarelix administration. Support Care Cancer 23, 1377-1381, doi:10.1007/s00520-014-2483-x (2015).
8. Barkin, J., Burton, S. & Lambert, C. Optimizing subcutaneous injection of the gonadotropin-releasing hormone receptor antagonist degarelix. Can J Urol 23, 8179-8183 (2016).
9. L, D.-C. GnRH blockers: a changing paradigm in the management of prostate cancer 2009 - International Journal of Urological Nursing, 2009;2003:2085-2092. (2009).
10 .Graafland N, R. H., Barten E, Jaspars J, van Winkel P, Pelger R, Elzevier H. Satisfaction and Tolerability among Men with Advanced Hormone-Dependent Prostate Carcinoma Treated with One- Monthly Subcutaneous Administration of Degarelix in The Netherlands. UROLOGY, MP-16.07 (2014).
11 .Freedland, S. J. & Abrahamsson, P. A. Androgen deprivation therapy and side effects: are GnRH antagonists safer? Asian J Androl 23, 3-10, doi:10.4103/aja.aja_22_20 (2021).
12 .Sciarra, A. et al. A meta-analysis and systematic review of randomized controlled trials with degarelix versus gonadotropin-releasing hormone agonists for advanced prostate cancer. Medicine (Baltimore) 95, e3845, doi:10.1097/md.0000000000003845 (2016).
13 .Merseburger, A. S., Sedding, D. & Hüter, K. [Cardiovascular risk patients under androgen deprivation therapy: Lower risk with GnRH antagonists compared to LHRH agonists?]. Urologe A 55, 218-225, doi:10.1007/s00120-015-0013-1 (2016).
14 .Albertsen, P. C. et al. Cardiovascular morbidity associated with gonadotropin releasing hormone agonists and an antagonist. Eur Urol 65, 565-573, doi:10.1016/j.eururo.2013.10.032 (2014).
15 .Melloni, C. et al. Cardiovascular Safety of Degarelix Versus Leuprolide for Advanced Prostate Cancer: The PRONOUNCE Trial Study Design. JACC CardioOncol 2, 70-81, doi:10.1016/j.jaccao.2020.01.004 (2020).
16 .Rosario, D. J. et al. The role of gonadotrophin-releasing hormone antagonists in the treatment of patients with advanced hormone-dependent prostate cancer in the UK. World J Urol 34, 1601-1609, doi:10.1007/s00345-016-1818-2 (2016).
17 .Hansson, G. K. Inflammation, atherosclerosis, and coronary artery disease. N Engl J Med 352, 1685-1695, doi:10.1056/NEJMra043430 (2005).
18 .Knutsson, A. et al. Treatment with a GnRH receptor agonist, but not the GnRH receptor antagonist degarelix, induces atherosclerotic plaque instability in ApoE(-/-) mice. Sci Rep 6, 26220, doi:10.1038/srep26220 (2016).
19 .Liu, X. M. et al. FSH regulates fat accumulation and redistribution in aging through the Gαi/Ca(2+)/CREB pathway. Aging Cell 14, 409-420, doi:10.1111/acel.12331 (2015).
20 .Crawford, E. D. et al. The potential role of follicle-stimulating hormone in the cardiovascular, metabolic, skeletal, and cognitive effects associated with androgen deprivation therapy. Urol Oncol 35, 183-191, doi:10.1016/j.urolonc.2017.01.025 (2017).
21 .Qu, M. et al. Association of Serum Testosterone and Luteinizing Hormone With Blood Pressure and Risk of Cardiovascular Disease in Middle-Aged and Elderly Men. J Am Heart Assoc 10, e019559, doi:10.1161/jaha.120.019559 (2021).
22 .Kelly, D. M. & Jones, T. H. Testosterone: a metabolic hormone in health and disease. J Endocrinol 217, R25-45, doi:10.1530/joe-12-0455 (2013).
23 .Furukawa, T. & Kurokawa, J. Non-genomic regulation of cardiac ion channels by sex hormones. Cardiovasc Hematol Disord Drug Targets 8, 245-251, doi:10.2174/187152908786786160 (2008).
24 .Fülöp, L. et al. Effects of sex hormones on ECG parameters and expression of cardiac ion channels in dogs. Acta Physiol (Oxf) 188, 163-171, doi:10.1111/j.1748-1716.2006.01618.x (2006).
25 .De Ponti, F., Poluzzi, E., Cavalli, A., Recanatini, M. & Montanaro, N. Safety of non-antiarrhythmic drugs that prolong the QT interval or induce torsade de pointes: an overview. Drug Saf 25, 263-286, doi:10.2165/00002018-200225040-00004 (2002).
26 .Garnick, M. B., Pratt, C. M., Campion, M. & Shipley, J. The effect of hormonal therapy for prostate cancer on the electrocardiographic QT interval: phase 3 results following treatment with leuprolide and goserelin, alone or with bicalutamide, and the GnRH antagonist abarelix. Journal of Clinical Oncology 2004 22:14_suppl, 4578. DOI: 10.1200/jco.2004.22.90140.4578.
27 .Sonesson, A. & Rasmussen, B. B. In vitro and in vivo human metabolism of degarelix, a gonadotropin-releasing hormone receptor blocker. Drug Metab Dispos 41, 1339-1346, doi:10.1124/dmd.113.051706 (2013).
28 .Sonesson, A. & Rasmussen, B. B. In vitro studies investigating the interactions between degarelix, a decapeptide gonadotropin-releasing hormone blocker, and cytochrome P450. Basic Clin Pharmacol Toxicol 109, 195-202, doi:10.1111/j.1742-7843.2011.00709.x (2011).
29 .Guise, T. A. et al. Estrogenic side effects of androgen deprivation therapy. Rev Urol 9, 163-180 (2007).
30 .Mellström, D. et al. Older men with low serum estradiol and high serum SHBG have an increased risk of fractures. J Bone Miner Res 23, 1552-1560, doi:10.1359/jbmr.080518 (2008).
31 .Khosla, S., Melton, L. J., 3rd, Atkinson, E. J. & O'Fallon, W. M. Relationship of serum sex steroid levels to longitudinal changes in bone density in young versus elderly men. J Clin Endocrinol Metab 86, 3555-3561, doi:10.1210/jcem.86.8.7736 (2001).
32 .Klotz, L. et al. Disease control outcomes from analysis of pooled individual patient data from five comparative randomised clinical trials of degarelix versus luteinising hormone-releasing hormone agonists. Eur Urol 66, 1101-1108, doi:10.1016/j.eururo.2013.12.063 (2014).
33 .Blair, H. C. et al. Skeletal receptors for steroid-family regulating glycoprotein hormones: A multilevel, integrated physiological control system. Ann N Y Acad Sci 1240, 26-31, doi:10.1111/j.1749-6632.2011.06287.x (2011).
34 .Wadhwa, V. K., Weston, R., Mistry, R. & Parr, N. J. Long-term changes in bone mineral density and predicted fracture risk in patients receiving androgen-deprivation therapy for prostate cancer, with stratification of treatment based on presenting values. BJU Int 104, 800-805, doi:10.1111/j.1464-410X.2009.08483.x (2009).
35 .Oefelein, M. G., Ricchiuti, V., Conrad, W. & Resnick, M. I. Skeletal fractures negatively correlate with overall survival in men with prostate cancer. J Urol 168, 1005-1007, doi:10.1097/01.ju.0000024395.86788.cc (2002).
36 .Basaria, S., Muller, D. C., Carducci, M. A., Egan, J. & Dobs, A. S. Hyperglycemia and insulin resistance in men with prostate carcinoma who receive androgen-deprivation therapy. Cancer 106, 581-588, doi:10.1002/cncr.21642 (2006).
37 .Smith, M. R., Lee, H. & Nathan, D. M. Insulin sensitivity during combined androgen blockade for prostate cancer. J Clin Endocrinol Metab 91, 1305-1308, doi:10.1210/jc.2005-2507 (2006).
38 .Kokorovic, A. et al. Canadian Urological Association guideline on androgen deprivation therapy: Adverse events and management strategies. Can Urol Assoc J 15, E307-e322, doi:10.5489/cuaj.7355 (2021).
39 .Kelly, D. M. & Jones, T. H. Testosterone and obesity. Obes Rev 16, 581-606, doi:10.1111/obr.12282 (2015).
40 .Mammi, C. et al. Androgens and adipose tissue in males: a complex and reciprocal interplay. Int J Endocrinol 2012, 789653, doi:10.1155/2012/789653 (2012).
41 .Stellato, R. K., Feldman, H. A., Hamdy, O., Horton, E. S. & McKinlay, J. B. Testosterone, sex hormone-binding globulin, and the development of type 2 diabetes in middle-aged men: prospective results from the Massachusetts male aging study. Diabetes Care 23, 490-494, doi:10.2337/diacare.23.4.490 (2000).
42 .Imakado, S., Hamada, K. & Atsumi, Y. Subcutaneous antihistamine injection is effective to control a local allergic reaction to human insulin. Diabetes Res Clin Pract 85, e42-43, doi:10.1016/j.diabres.2009.05.013 (2009).
43 .Neville, K. A. et al. Insulin allergy desensitization with simultaneous intravenous insulin and continuous subcutaneous insulin infusion. Pediatr Diabetes 9, 420-422, doi:10.1111/j.1399-5448.2008.00348.x (2008).
44 .Whelton, P. K. et al. 2017 ACC/AHA/AAPA/ABC/ACPM/AGS/APhA/ASH/ASPC/NMA/PCNA Guideline for the Prevention, Detection, Evaluation, and Management of High Blood Pressure in Adults: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Hypertension 71, e13-e115, doi:10.1161/hyp.0000000000000065 (2018).
45 .Castro-Alonso, F. J., Dominguez-Pineda, J., Rosales-Sotomayor, G., Flaig, T. W. & Bourlon, M. T. Initiation of ADT in a Man With Locally Advanced Prostate Cancer and Multiple Cardiovascular Risk Factors. Oncology (Williston Park) 32, 243-246 (2018).
46 .Montazeri, K. et al. ABCDE steps to prevent heart disease in breast cancer survivors. Circulation 130, e157-159, doi:10.1161/circulationaha.114.008820 (2014).
47 .Bhatia, N. et al. Cardiovascular Effects of Androgen Deprivation Therapy for the Treatment of Prostate Cancer: ABCDE Steps to Reduce Cardiovascular Disease in Patients With Prostate Cancer. Circulation 133, 537-541, doi:10.1161/circulationaha.115.012519 (2016).
48 .Salem, J. E. et al. Clinical characterization of men with long QT syndrome and torsades de pointes associated with hypogonadism: A review and pharmacovigilance study. Arch Cardiovasc Dis 112, 699-712, doi:10.1016/j.acvd.2019.06.008 (2019).
49 .Salem, J. E. et al. Androgenic Effects on Ventricular Repolarization: A Translational Study From the International Pharmacovigilance Database to iPSC-Cardiomyocytes. Circulation 140, 1070-1080, doi:10.1161/circulationaha.119.040162 (2019).
50 .Trotti, A. et al. CTCAE v3.0: development of a comprehensive grading system for the adverse effects of cancer treatment. Semin Radiat Oncol 13, 176-181, doi:10.1016/s1053-4296(03)00031-6 (2003).
51 .Marshall, D., Johnell, O. & Wedel, H. Meta-analysis of how well measures of bone mineral density predict occurrence of osteoporotic fractures. Bmj 312, 1254-1259, doi:10.1136/bmj.312.7041.1254 (1996).
52 .Melton, L. J., 3rd, Atkinson, E. J., O'Connor, M. K., O'Fallon, W. M. & Riggs, B. L. Bone density and fracture risk in men. J Bone Miner Res 13, 1915-1923, doi:10.1359/jbmr.1998.13.12.1915 (1998).
53 .Olszynski, W. P. et al. Osteoporosis in men: epidemiology, diagnosis, prevention, and treatment. Clin Ther 26, 15-28, doi:10.1016/s0149-2918(04)90002-1 (2004).
54 .Saad, F. et al. Cancer treatment-induced bone loss in breast and prostate cancer. J Clin Oncol 26, 5465-5476, doi:10.1200/jco.2008.18.4184 (2008).
55 .Cormie, P. & Zopf, E. M. Exercise medicine for the management of androgen deprivation therapy-related side effects in prostate cancer. Urol Oncol 38, 62-70, doi:10.1016/j.urolonc.2018.10.008 (2020).
56 .Gardner, J. R., Livingston, P. M. & Fraser, S. F. Effects of exercise on treatment-related adverse effects for patients with prostate cancer receiving androgen-deprivation therapy: a systematic review. J Clin Oncol 32, 335-346, doi:10.1200/jco.2013.49.5523 (2014).



